博白大果油茶遗传多样性的ISSR研究
2013-12-27彭继庆曹福祥范海燕
彭继庆,曹福祥,范海燕
(中南林业科技大学 生命科学与技术学院,湖南 长沙 410004)
博白大果油茶遗传多样性的ISSR研究
彭继庆,曹福祥,范海燕
(中南林业科技大学 生命科学与技术学院,湖南 长沙 410004)
利用ISSR分子标记技术,对博白大果油茶2个天然种群和2个人工种群进行遗传多样性研究,表明博白大果油茶种水平具有较高的遗传多样性,种群的变异主要来自于种群内部,种群间分化程度比较低,各个种群沿着共同方向进化。种群间基因流(Nm)为1.195 4,大于1,足以抵制遗传漂变的作用。聚类分析表明人工种群引种于广西江宁。人工种群和天然种群相比,遗传多样性水平略有降低,但总体差别不大,说明人工种群已经适应了栽培地的气候特征。
博白大果油茶,遗传多样性,ISSR
博白大果油茶Camellia gigantocarpa Hu et Huang又名赤柏子,山茶科山茶属常绿乔木,1965年发现的新种[1]。在广西博白、玉林和陆川一带,海拔 500 m以下有天然林存在多生于富含腐殖质的酸性红壤和黄红壤的山腰、山谷、路旁和林中。天然林分布区多属高温高湿的南亚热带气侯,最低月平均气温8~13 ℃,极端最低气温可达-5 ℃,年降水量为1 500~2 200 mm。博白大果油茶树形优美,花大果大,其种子含油丰富,是重要的观赏植物[2]和油料植物[3-5]。其材质坚硬而重,耐腐朽,最适做雕刻、日常生活用具、农具等,茶油是医药上、工业上的原材料,具有重要的经济价值[6-7]。因森林资源不断遭到砍伐和破坏,博白大果油茶野生资源数量稀少,在《中国植物红皮书》中已将其定为渐危种,现被列为国家二级保护植物。目前对博白大果油茶的研究多集中在栽培、生长规律、核型分析等方面,从分子水平对其濒危原因还没有分析。
ISSR分子标记是在微卫星分子标记技术的基础上发展起来的一种新型分子标记技术,具有操作简单,检测灵敏,重复性好,检测快速等优点,已广泛用于亲缘关系鉴定、品种鉴定、遗传图谱构建,群体遗传多样性分析等多个方面。本研究采用ISSR分子标记技术首次对博白大果油茶天然种群和人工种群进行遗传多样性分析,揭示其遗传多样性水平和遗传结构,探讨人工种群和天然种群之间的基因差异,为博白大果油茶的引种状况做出评价,为博白大果油茶资源保护、群体恢复和有效利用提供指导。
1 材料与方法
1.1 样品材料
本实验样品分别采自于广西省博白县那林镇12个样品、广西省博白县江宁镇11个样品、湖南省新宁县林业科学研究所11个样品及湖南省植物园8个样品,全部为博白大果油茶优树或优树繁殖的实生苗。为了防止采到同一母树的后代,采样过程中保证两个单株间的距离不少于50 m。采同一株的5~10 g新鲜嫩叶用湿纱布擦干净后放到自封袋中,加入50~100 g干燥的硅胶,保证硅胶的质量为新鲜叶子的10倍,摇动袋子使硅胶与叶子充分接触,低温保存,带回实验室,置于-70 ℃超低温冰箱保存备用。
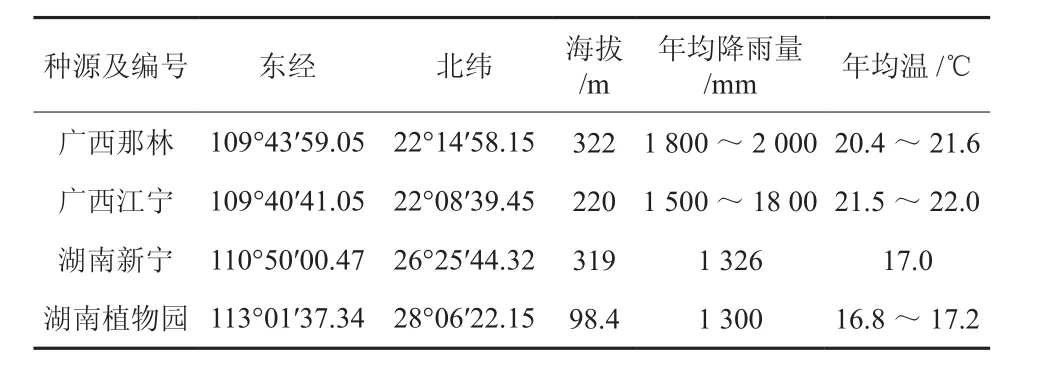
表1 不同种源博白大果油茶地理位置及主要气象因子Table 1 Geographical locations and main meteorological factors of different provenances of C. gigantocarpa
1.2 引物材料
实验所用ISSR引物是根据加拿大哥伦比亚大学公布的第9套ISSR引物序列,由南京金斯瑞生物科技有限公司合成,共100条引物。
1.3 总基因组DNA的提取及检测
博白大果油茶总基因组DNA的提取采用天根生物生化有限公司提供的植物基因组DNA提取试剂盒进行提取,操作步骤按照说明书进行并作适当调整。用1%的琼脂糖凝胶电泳和核酸蛋白测定仪进行检测。
1.4 引物筛选及退火温度确定
利用ISSR最佳反应体系和扩增程序,根据引物序列的Tm值,在Tm-5℃到Tm+5℃范围内,对每条引物进行引物筛选和退火温度确定,选取10条扩增条带清晰、重复性好、多态性高的引物,用于博白大果油茶的ISSR-PCR扩增。
1.5 ISSR-PCR扩增和电泳检测
利用最佳的ISSR-PCR反应体系、扩增程序[8]和筛选出的10条引物对所有的博白大果油茶DNA样品进行PCR扩增。利用1.5%的琼脂糖凝胶电泳进行检测,凝胶成像系统拍照,得到所有DNA样品的扩增图像。
1.6 数据处理与分析
数据统计时,基于以下原则:同一引物的扩增产物中,电泳迁移率一致的条带认为是同一条带;电泳迁移率相同,但条带强度不同,当强带超过弱带的两倍时,视为新带;根据Hardy-Weinberg平衡理论,剔除基因频率小于3/N(N为样本数,本研究中N为42)的条带[9];条带模糊不清不统计。
利用200 bpDNA ladder marker进行对比,确定每条引物扩增片段的大小,并将其进行排序。根据电泳图中扩增的条带有无情况进行赋值,有条带出现的赋值为“1”,无条带出现的赋值为“0”,得到博白大果油茶的0/1数据矩阵。利用PopGen32 软件分析博白大果油茶种群多态性位点百分比(PPB)、Nei’s基因多样性(H)、Shannon信息多样性指数(I)、种群内基因多样性(Hs)、种群总基因多样性(Ht)、种群间遗传分化指数(Gst)和基因流(Nm)。并根据Nei’s遗传一致度和遗传距离,确定各种群间的亲缘关系。
2 结果与分析
2.1 ISSR扩增产物的多态性
利用已经优化的ISSR-PCR扩增体系及筛选出的10条ISSR引物对4个种群的42份博白大果油茶DNA样品进行ISSR-PCR扩增,10个引物对42份实验材料均能很好的扩增,ISSR-PCR扩增的DNA片段大小一般在220~2 000 bp之间,共检测到115条清晰可重复的DNA条带,其中多态性条带为98条,总多态位点百分率为85.22%。每个引物可扩增的多态性条带数目不等,在7~13条之间,多态性最高的为100%,最低的为77.78%,见(见表2)。

表2 ISSR引物扩增的位点Table 2 Amplification sites of ISSR primers
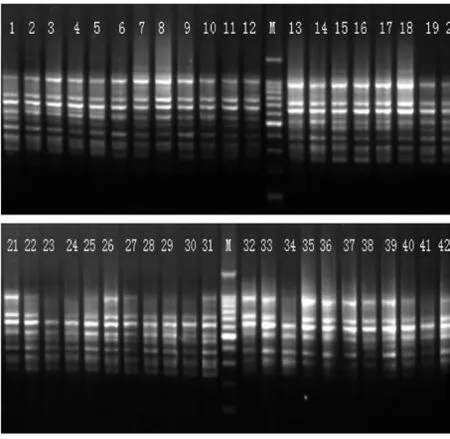
图1 引物UBC825对博白大果油茶的多态性扩增Fig. 1 Polymorphism PCR of C. gigantocarpa in primer UBC825 (M: 200 bp DNA Ladder)
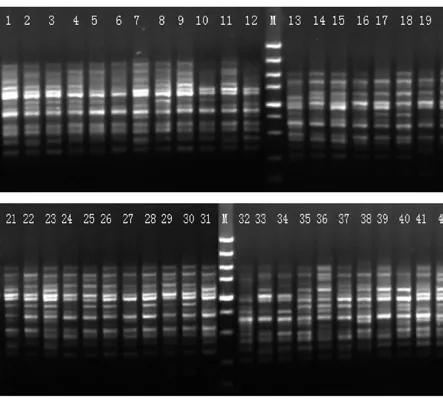
图2 引物UBC840对博白大果油茶的多态性扩增Fig 2 Polymorphism PCR of C. gigantocarpa in primer UBC840 (M: 5 000 bp DNA marker)
2.2 博白大果油茶种群的多态性分析
4个种源地博白大果油茶多态位点百分率在51.30%~66.09%之间,而广西省江宁镇博白大果油茶种群多态位点百分率最高,说明这个种群的多态性最丰富,种群内部基因交流比较频繁,适应环境的能力最强,说明该种群更适合作为引种繁殖目标,有利于博白大果油茶种质资源的保护及利用。

表3 4个种源的博白大果油茶的多态位点百分率Table 3 Proportion of polymorphic bands of 4 provenances of C. gigantocarpa
2.3 博白大果油茶ISSR遗传多样性分析
利用PopGen32软件分析表明,42个博白大果油茶样品的总的观察等位基因数为1.852 2,总的有效等位基因数为1.563 7,总的Nei’s基因多样性指数为0.323 0,总的Shannon信息指数为0.476 6。就各种群而言,博白大果油茶4个居群Na的变异幅度为1.469 6~1.660 9,Ne变异幅度为1.365 5~1.470 2,H的变异幅度为0.199 9~0.264 7,I的变异幅度为0.287 7~0.386 1,说明不仅在种水平具有较高的遗传多样性,而且各个种群间也具有丰富的遗传多样性。
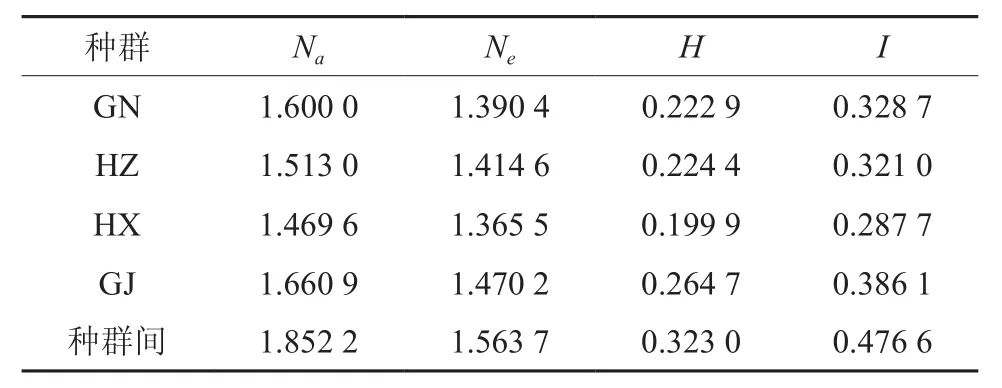
表4 4个种源的博白大果油茶的遗传多样性指标Table 4 Genetic polymorphism indexes of 4 provenances of C. gigantocarpa
2.4 博白大果油茶种群遗传变异的分析
4个博白大果油茶种水平的基因多样性(Ht)为0.323 3,其中群体内基因多样性(Hs)为0.228 0,种群间的基因多样性(Dst)为0.095 3,种群内遗传分化系数(Gst)为0.294 9,其种群内变异为70.51%,说明博白大果油茶的遗传变异主要发生在种群内,地理环境对博白大果油茶种群间的遗传分化影响也较大。种群间基因流(Nm)为1.195 4,大于1,证明居群间存在一定的基因流动,足以抵制遗传漂变的作用。
2.5 遗传一致度与亲缘关系的聚类分析
如表5所示,博白大果油茶4个种群间的Nei’s遗传距离范围在0.111 4~0.215 4之间,湖南新宁与湖南植物园2个种群之间的遗传距离最小,而广西那林与湖南植物园之间的遗传距离最大(为0.215 4),表明它们之间的遗传差异较大;4个种群的遗传一致度范围在0.806 2~0.894 6之间,与遗传距离的结果相一致,广西那林与湖南植物园的遗传一致度最小。每个种群的遗传距离差异不大,说明各种群间的遗传变异保持了相对较高的稳定性。
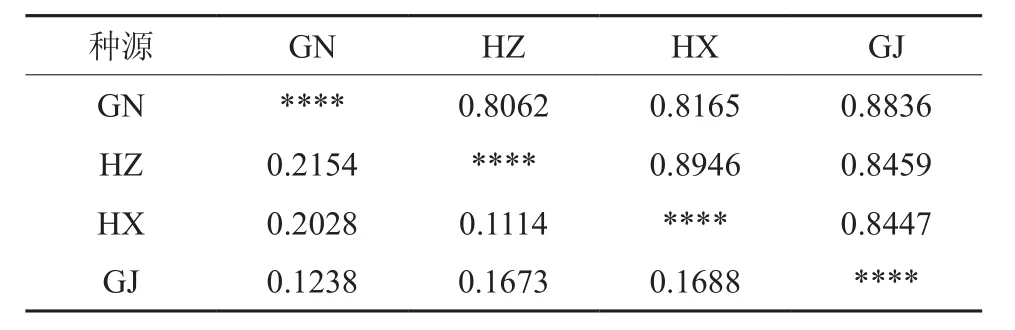
表5 不同地理种源博白大果油茶的Nei’s(1978)遗传距离和遗传一致度†Table 5 Nei’s(1978) genetic distance and genetic identity among C. gigantocarpa of different provenances
对博白大果油茶4个种群进行UPGMA聚类分析(如图3)表明,湖南新宁与湖南省植物园聚为一类,它们的亲缘关系最近,广西省博白县那林镇与广西省博白县江宁镇聚为一类,湖南的两个种群与广西省博白县两个种群聚为一类它们之间的遗传一致度差异仅为0.011,说明他们具有很近的亲缘关系。
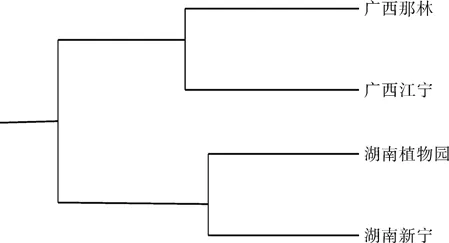
图3 不同种源博白大果油茶Nei’s遗传一致度的UPGMA聚类Fig.3 UPGMA clustering on Nei’s genetic consistent degrees among C. gigantocarpa of different provenances
3 讨 论
遗传多样性是生命系统的基本特性,是物种适应环境和发生进化的遗传基础。在长期的自然演变过程中,由于受生态环境、气候条件、栽培措施以及自然杂交等各种因素的影响,基因组DNA发生改变,产生遗传变异。博白大果油茶多态位点百分比为85.22%。比广布型植物如木荷[10]的遗传位点百分比要低,比壳菜果[11]、资源冷杉等[12-14]的遗传位点百分比要高,这与博白大果油茶的生境、授粉方式和种子萌发能力有很大的关系。
博白大果油茶种群间基因流(Nm)仅为1.195 4,存在一定的基因流动,可以抵制遗传漂变的作用,但是各个种群间的基因交流还不够丰富,这与博白大果油茶面积减少有很大关系;种群间遗传分化系数(Gst)为0.294 9,其种群内变异为70.51%,种群间的变异为29.49%,尽管种群内变异占主导地位,但种群间变异远远高于广布型植物,各种群间基因交流较少,地理环境对博白大果油茶种群间的遗传分化影响较大。
从天然种群和栽培种群来看,博白大果油茶栽培种群的遗传多样性明显低于天然种群,可能有以下三方面原因:一是种群大小,一般来讲,种群中个体越多,遗传多样性越丰富;二是引种栽培时,不要只采摘一棵植株的种子,应该采集多棵,并且采集的植株应该在其分布区均匀分布;三是博白大果油茶从广西引种至湖南,气候条件的差异导致其遗传多样性降低,但目前博白大果油茶已能够在湖南生长、自然更新,这也与最近一段时间气候变暖有很大关系,尤其与冬季最低温明显升高有关。博白大果油茶种群的遗传距离和遗传一致度显示,栽培种群和广西江宁种群的遗传一致度更近,因此,湖南新宁的博白大果油茶种群更有可能引致广西江宁。
同时从聚类图也可知湖南的博白大果油茶人工林与种源地存在一定的遗传距离,表明博白大果油茶发生了适应当地环境的遗传变异,也进一步说明博白大果油茶引种到湖南是可行的。随着全球气候变化,温度升高,本来分布于南亚热带地区(北纬22°08′)的博白大果油茶在湖南地区(北纬26°25′)经过近30年的生长,也能适应当地的生态环境,产生相应的遗传分化茁壮生长。
通过对博白大果油茶种群遗传多样性研究发现,其种群具有较高的遗传多样性,具有较高的适应能力,但目前博白大果油茶种群在急剧减少,成为濒危树种,可能两方面原因:一是当地居民也缺乏保护意识,人为因素干扰频繁,成年的博白大果油茶由于被大量砍伐数量越来越少,幼苗数量也很少,只在保护区尚可见数量不多的博白大果油茶。另一原因是分布屏障,博白大果油茶天然林分布区植株很少且零星分布,阻隔了基因的交流,导致物种遗传基础的衰退,遗传多样性降低。因此,对博白大果油茶种群的保护需要加强宣传教育,建立自然保护区,加大保护力度;利用现代生物技术对博白大果油茶进行进行人工繁殖;合理规划,加大异地引种,扩大博白大果油茶人工林栽培面积,加强种群间的基因交流。
[1] 胡先骕.中国山茶属与连蕊茶属新种和新变种[J].植物分类学报,1965,10(2):131-142.
[2] 邵 群.鄂西南油茶产业发展前景及栽培技术要点[J].恩施职业技术学院学报,2010,22(3):12-15.
[3] 石详刚,王秀娟.博白油茶和红皮糙果茶分类学问题的讨论[J].广西植物,2003,23(5):420-423.
[4] 郑万钧.中国树木志.第3卷[M].北京:中国林业出版社,1997: 3045.
[5] 李克瑞,漆龙霖.山茶属27种植物油脂理化性质及脂肪酸组成的研究[J].中南林学院学报,1984,4(2):11-16.
[6] 唐丽丽.茶油加工及综合应用研究[J].现代农业科技,2010,(4):12-15.
[7] 侯如燕,宛晓春.茶籽的综合利用[J].中国食品与营养,2003,(5):24 -26
[8] 范海艳,曹福祥,彭继庆,等.博白大果油茶ISSR-PCR反应体系的建立与优化[J].中南林业科技大学学报,2011,31(4):97-103.
[9] Lynch M, Milligan BG. Analysis of population genetic structure with RAPD markers[J].Molecular Ecology,1994,3,91-99.
[10] 金则新,李钧敏,李建辉,等.木荷种群遗传多样性的ISSR分析[J].浙江大学学报:农业与生命科学版,2007,33(3):271-276.
[11] 彭继庆,曹福祥,许若娴,等.广西壳菜果遗传多样性的ISSR研究[J].湖南师范大学学报,2012,35(1):61-65.
[12] 张玉荣,罗菊春,喻锦秀,等.资源冷杉遗传多样性的ISSR分析[J].北京林业大学学报,2007,29(6):41-46.
[13] 杨 峰,李志辉,蒋 燚,等.红椎优良家系ISSR遗传多样性分析[J].中南林业科技大学学报,2012,32(6):123-127.
[14] 刘海龙,马锦林,张日清,等.11份山茶属植物亲缘关系的ISSR分析[J].经济林研究,2012,30(4):87-90.
Study on genetic diversity of Camellia gigantocarpa detected by ISSR markers
PENG Ji-qing, CAO Fu-xiang, FANG Hai-yan
(School of Life Science and Technology, Central South University of Forestry & Technology, Changsha 410004, Hunan, China )
By using ISSR molecular marker techniques, the genetic diversity of 2 natural populations and 2 artif i cial populations of Camellia gigantocarpa were studied. The results show that the C. gigantocarpa populations’ genetic diversities were at higher levels,the main genetic variations of C. gigantocarpa populations came from the interior of populations,and the interpopulation differentiation degrees were at lower levels. The populations evolved along the common direction; the gene fl ow (Nm) among C. gigantocarpa was 1.195 4>1.0, this is suff i cient to resist the effect the genetic drift. The UPGMA cluster analysis show that the artif i cial populations were introduced into Jiangning, Guangxi. Comparison with natural population, the artif i cial populations’ genetic diversity levels was slightly lower,but there was little difference. It showed that the artif i cial populations had adapted to the climatic characteristics of cultivation areas.
Camellia gigantocarpa; genetic diversity; ISSR
S718.46
A
1673-923X(2013)07-0062-05
2012-10-16
国家林业公益行业科研专项子项目(200804001);中南林业科技大学校级重点学科建设项目(066)
彭继庆(1986-),男,山东菏泽人,助教,主要从事生物化学与分子生物学方面研究;E-mail:pengjiqing17@126.com
曹福祥(1963-),男,湖南新化人,教授,主要从事生物化学与分子生物学研究;E-mail:csfucao@163.com
[本文编校:吴 毅]
