氮添加对樟树林红壤微生物群落代谢功能的影响
2013-12-27郁培义王志勇闫文德宿少锋李天平
郁培义,朱 凡,王志勇,闫文德,宿少锋,李天平
(1. 中南林业科技大学 生命科学与技术学院,湖南 长沙 410004;2. 南方林业应用技术国家工程实验室,湖南 长沙 410004)
氮添加对樟树林红壤微生物群落代谢功能的影响
郁培义1,2,朱 凡1,2,王志勇1,2,闫文德1,2,宿少锋1,2,李天平1,2
(1. 中南林业科技大学 生命科学与技术学院,湖南 长沙 410004;2. 南方林业应用技术国家工程实验室,湖南 长沙 410004)
为探讨氮添加对土壤微生物群落代谢功能多样性的影响,采用BIOLOG AN、FF、GenIII 和 YT 4种微生物平板测定了氮添加不同水平樟树林红壤微生物的代谢活性及其多样性。结果表明:(1)高浓度施氮对樟树人工林土壤微生物厌氧菌的代谢功能具有促进作用,而低浓度施氮抑制其活性。(2)氮添加不同水平处理均促进土壤微生物革兰氏好氧菌的活性,且施氮浓度越高促进作用越明显。(3)氮添加不同水平处理均抑制土壤微生物真菌和酵母菌活性。多样性的研究结果也与土壤微生物代谢活性的变化相似。
氮添加;BIOLOG;微生物群落; 代谢功能;多样性
土壤微生物作为森林土壤重要组成部分,在凋落物分解、养分循环和植物养分利用过程中发挥着关键作用[1]。土壤微生物对环境变化反应敏感,是土壤环境质量的重要指标[2]。土壤微生物群落功能多样性是土壤微生物群落状态与功能的指标,反映土壤中微生物的生态特征。1991年Garland等首次将BIOLOG微平板技术应用于描述混合的微生物群体特征[3]。近十几年来,BIOLOG技术在微生物生态及环境微生物检测方面的应用取得了长足进步。BIOLOG主要是通过测定微生物对各类碳源利用程度的差异来反映土壤中微生物群落代谢功能的不同,此方法已广泛应用于评价土壤微生物群落的功能多样性[4]。
氮素被认为是陆地生态系统初级生产力的限制性养分元素,因此人类大量使用氮肥来增加土壤可利用性氮素的水平,促进植物的生长。但是研究表明,外加氮输入会增加土壤溶液的氮淋溶,导致土壤的进一步酸化[5]。那么土壤微生物为了适应该环境,必需对自身特性和适应机能进行修饰和改造,使其组织机能和群落结构具有一定的特异性。
中国南方林地许多分布在对酸敏感的红壤地区[6]。外源氮的添加对林地土壤质量影响关系到林业可持续发展,已引起广泛关注。樟树Cinnamomum camphora是我国南方地区重要的材用及造林经济树种。为此,文章采用BIOLOG 技术,利用AN、FF、GEN和YT 4种微孔板分别对外源氮添加不同水平下樟树人工林红壤微生物代谢功能多样性进行研究,以期为深入研究外源氮输入对土壤微生物群落代谢功能的影响,以及为我国林业的可持续发展及环境保护提供参考。
1 材料与方法
1.1 研究区概况
试验地位于湖南省森林植物园(113°02′E,28°06′N)。该地气候属于典型的亚热带湿润季风气候,年均气温约为17.2℃,年均降水量约为1 422 mm,全年无霜期为270~310 d。试验地海拔50~100 m,坡度12°~21°;地层主要是第四纪更新世的残积性网纹红土和砂砾,属典型红壤丘陵区。樟树林是亚热带常见的人工林,在中性以至强酸性红壤丘陵地是很好的经济林树种,大约种植于1982年,其基本特征见表1。

表1 供试土壤的理化特性Table 1 Physicochemical properties of experimental soils in C. camphora forest (n = 3)
1.2 实验设计
植物园模拟氮沉降处理样地建于2010年5月,在樟树林设置了面积25 m×25 m样方9个。分别设置3个处理组,即对照处理N0、低氮处理N1和高氮处理N2,分别按: 0、5、15 g·m-2y-1进行外加氮处理,每个处理组3个重复。根据样地坡度,将高氮处理样地设置于坡度较低处,防止因施氮后短期内雨水冲刷将未溶解于土壤表层和灌木表层的氮冲刷。2010年6月,对样地进行氮处理。方法是根据氮处理水平,将每个样方所施的NH4NO3(固体分析纯)溶解在20 L自来水中后,以背式喷雾器人工来回均匀喷洒,喷洒高度 1.5 m左右。对照样方N0则喷洒等量清水,以尽量减少不同处理间的差异。
1.3 土壤样品采集
于喷施氮1个月(2010年7月)对各样方进行取样,依照均匀并随机的原则,去除凋落物层, 使用直径5 cm“洛阳铲”采0~10 cm的土层,按照“品”字形三点取样,将每个样方的土样充分混合后,手捡粗根、石块和其它杂物后,迅速装入塑料袋并置于冰块上,运至实验室,4℃冰箱保存。
1.4 测定方法
试验使用的 BIOLOG AN、FF、GenIII和YT 4种测试板各有 96个孔,除对照组孔(第一个孔)仅有水和指示剂以外,其余孔均含有不同碳源和四唑盐指示剂。微生物在利用单一碳源的代谢过程发生氧化还原反应,产生电子转移,从而使四唑盐指示剂变成紫色,通过测定各板孔的吸光值及其变化来反映微生物的代谢能力的多样性[7]。
BIOLOG GenIII板适用于测定革兰氏好氧细菌,BIOLOG FF板适用于测定丝状真菌,BIOLOG YT板适用于测定酵母菌,BIOLOG AN板适用于测定厌氧细菌。
具体实验步骤是,实验前应先将待测土壤从冰箱内提前4小时拿出,放置于室温下恢复土壤微生物的活性。称取10 g土样倒入装有90 mL灭菌生理盐水的三角瓶中,200 r/min振荡30 min,使土壤中微生物均匀分散,制成10-2稀释度的土壤稀释液。然后按10倍稀释法进行稀释,取10-3倍数的上清菌液用8道移液排枪接入BIOLOG 4种微平板(150 μL/孔)。放入28 ℃恒温培养箱培养,每隔24 h进行读数,连续10 d。
土壤微生物多样性指数计算方法[8-9]如下:
BIOLOG 微平板反应一般采用每孔颜色平均变化率(AWCD)来描述。
计算公式为:

式中:C 为每个有培养基孔的光密度值,R 为对照孔( A1) 的光密度值,n 为培养基碳源种类,YT板n值为 31,其余微平板(AN板、GenIII板和FF板)n值为95。
采用Shannon指数、Simpson指数和Mclntosh指数来反映细菌群落代谢功能的多样性。Shannon指数计算公式:
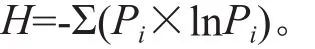
式中:Pi为第i孔吸光值与整个平板相对吸光值总和的比率
Simpson指数计算公式:

式中,Pi为第i孔吸光值与整个平板相对吸光值总和的比率。
Mclntosh指数计算公式:
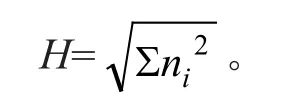
式中:ni为第i孔的相对吸光值。
1.5 统计分析
本文用 SPSS13.0 对数据进行处理分析,Sigmaplot10.0 辅助作图。利用 One-Way ANOVA方差分析不同氮添加处理对土壤微生物多样性差异显著性(P<0.05)。
2 结果与分析
2.1 BIOLOG AN平板的AWCD值的变化
平均颜色变化率( AWCD) 是土壤微生物群落碳源利用能力的重要指标,反映了土壤微生物的代谢活性。BIOLOG AN板用来测定土壤中的厌氧菌及其活性,平板共有96个孔,除第一孔只加水与指示剂外,其他95个孔,装有不同的碳源。由图1可以看出,不同施氮处理下,AWCD值呈现先上升后趋于平缓的趋势。在培养的156 h内,3条曲线相互交叉,而在培养后期,曲线才明显分离。说明不同施氮处理对樟树土壤微生物厌氧菌代谢活性产生一定的影响。表现为:与对照相比,高浓度施氮(N2)促进厌氧菌代谢活性,而低浓度施氮(N1)抑制其活性。其代谢活性的先后顺序为:N2> N0> N1。
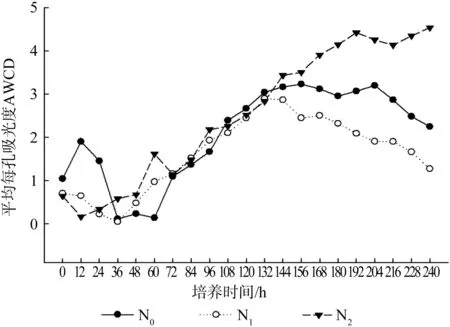
图1 AN板平均每孔吸光度随时间的变化规律Fig. 1 Variation of AWCD values with time in BIOLOG AN plate
2.2 BIOLOG FF平板的AWCD值的变化
BIOLOG丝状真菌鉴定微平板(FF 板)主要用于丝状真菌及其活性的鉴定。不同施氮处理组樟树人工林利用平板95种不同碳源的AWCD值如图2所示。在终止培养的240 h内,BIOLOG FF平板均形成较为明显的S型曲线。即经过48 h短暂的调整期后迅速增长直至生长停滞期。整体上来看,对照组N0的AWCD值增加速率显著高于其余施氮组,代谢活性的先后顺序为,N0>N2>N1。表明对照组的土壤微生物丝状真菌的代谢活性较强。而经不同浓度施氮处理后,樟树土壤微生物生理活性降低,代谢减慢。

图 2 FF板平均每孔吸光度随时间的变化规律Fig. 2 Variation of AWCD values with time in BIOLOG FF plate
2.3 BIOLOG GenIII平板的AWCD值的变化
BIOLOG GenIII平板用来测定土壤中革兰氏阳性好氧细菌与革兰氏阴性好氧细菌利用单一碳源的能力。其变化速率越快,BIOLOG的代谢活性就越强。如图3所示,与其他微孔板相比,BIOLOG GenIII平板中细菌启动速度较快,在24 h之后即进入快速生长期直至增长达到平稳,其中曲线N0达到平稳期所需时间最长(192 h)。可以看出不同施氮处理土壤微生物的好氧细菌代谢活性AWCD值均高于对照组,且施氮浓度越高代谢活性越强,到培养后期,差异更加明显。由此进一步说明,不同施氮处理对樟树土壤样品中好氧菌均起到不同程度的促进作用。
2.4 BIOLOG YT平板的AWCD值的变化
BIOLOG YT平板是用来测定土壤中酵母菌活性。不同施氮处理土壤微生物酵母菌代谢活性产生一定的影响。由图4可以看出,同BIOLOG FF平板曲线变化相似,经过48 h调整期立即进入增长期,且增长速率较快,直至156 h。总体来看,在樟树林土壤样品培养的240 h内,对照样地土壤微生物酵母菌利用不同碳源的AWCD变化值最高,到培养结束时达最高值,与对照样地相比,不同施氮处理土壤微生物酵母菌活性均降低,大小顺序依次为:N0>N2>N1,说明不同施氮处理抑制土壤微生物酵母菌的活性。
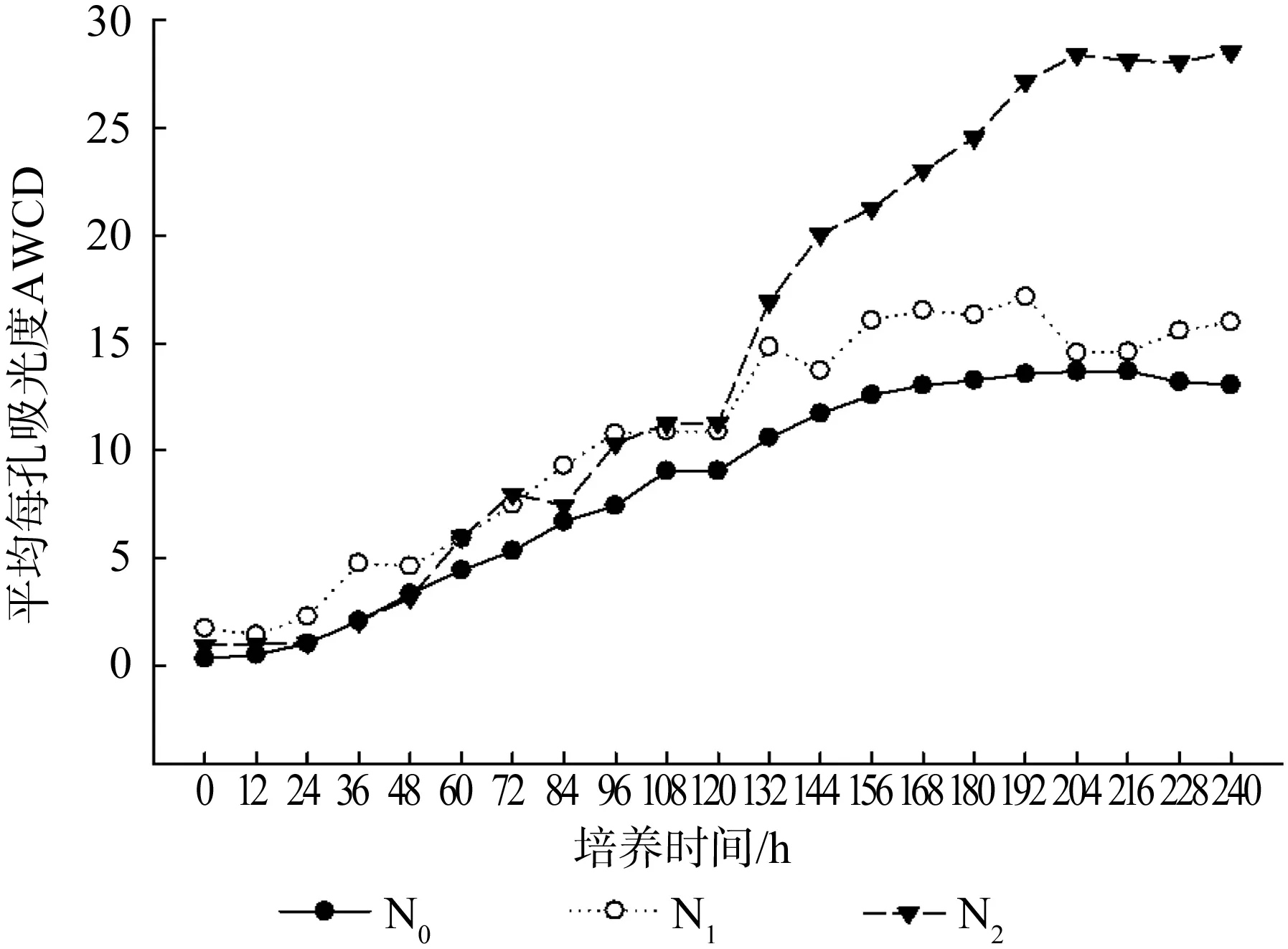
图 3 樟树GenIII板平均每孔吸光度随时间的变化规律Fig. 3 Variation of AWCD values with time in BIOLOG GenIII plate

图4 樟树YT板平均每孔吸光度随时间的变化规律Fig. 4 Variation of AWCD values with time in BIOLOG YT plate
2.5 樟树林土壤微生物群落碳代谢功能多样性的变化
为了对土壤微生物代谢功能多样性进一步分析,本文分别计算了不同施氮处理水平,樟树林土壤微生物Shannon指数、Simpson指数和McIntosh指数,它们分别从不同侧面反映土壤微生物群落的丰富度、群落内常见物种的优势度和微生物物种的均匀度。表2列出了在培养156 h的吸光值计算结果。不同研究人员所采用的时间和方法并不统一,如侯晓杰等利用48 h的值[10],罗希茜等采用72 h[11],郑华等则采用当AWCD值接近0.6时来确定时间的方法[12]。在本研究中,土壤微生物经过延滞期适应BIOLOG测试板提供的环境,然后对数生长至156 h之后生长减缓进入稳定期。

表2 不同氮处理樟树样地土壤微生物多样性变化(平均值±标准误,n=3)Table 2 Changes of soil microbial diversity in C. camphora forest under different N treatments(means ± SE,n = 3)
多样性指数结果表明,樟树林样地,不同施氮处理BIOLOG AN平板和BIOLOG GenIII 平板3个指数均显著高于对照样地,表明一定的施氮促进土壤微生物细菌代谢功能多样性;BIOLOG FF平板显示,不同施氮水平3个指数中除Shannon指数较施氮组高外,其他指数均不同程度的低于对照样地,其中高氮处理样地N2达到显著水平,说明外源氮输入抑制土壤微生物丝状真菌代谢功能多样性;相比之下BIOLOG YT平板对照样地N0的Simpson指数高于其他施氮处理样地,但未达到显著水平,而Shannon指数和McIntosh指数低于施氮组。说明表征土壤微生物酵母菌代谢功能多样性的3个指数表现不一致。
3 结论与讨论
本研究通过BIOLOG 4 种微生物平板对樟树人工林红壤微生物代谢功能及其多样性的研究表明,外源氮添加不同水平的处理对土壤微生物群落代谢功能有不同程度的影响。具体表现为,氮添加对土壤微生物细菌的代谢功能具有促进作用,而抑制土壤微生物真菌和酵母菌的活性。大量研究表明施氮可以通过改变土壤养分的有效性以及调节土壤养分的储存和转化,改变土壤肥力,从而刺激土壤微生物的生长[13-14],但长期施氮会对土壤微生物活性起到抑制作用[15]。这与王曙光[16]等中国科学院禹城实验站研究结果不一致,可能与施肥量、各地水热条件、土壤类型及理化性质等的不同而有关,原因有待进一步的研究。土壤微生物群落功能的多样性与土壤类型及土壤肥力密切相关[17-19]。不同的施氮处理对土壤微生物产生不同的影响。施氮可能通过使土壤中的碳,氮以及土壤pH值发生变化影响土壤微生物的代谢功能,从而进一步使微生物利用碳源的能力以及群落功能多样性发生变化。
[1] Singh J S, Raghubanshi A S, Singh R S, et al. Microbial biomass acts as a source of plant nutrients in dry tropic forest and savanna[J]. Nature, 1989,338:499-500.
[2] Insam H, Hutchinson T C, Reber H H. Effects of heavy metal stress on the metabolic quotient of the soil micro flora[J].Soil Biology Biochemistry, 1996,28:691-694.
[3] Garland J L, Mills A L. Classification and Characterization of Heterotrophic Microbial Communities on the Basis of Patterns of Community Level Sole-Carbon-Source Utilization[J]. Applied and Environmental Microbiology,1991,57 (8): 2351-2359.
[4] Rogers B F,TateⅢ R L.Temporal analysis of the soil microbial community along a top sequence in Pineland soils[J]. Soil Biology Biochemistry,2001,33:1389-1401.
[5] Blake L, Goulding K W T. Effects of atmospheric deposition,soil pH and acidification on heavy metal contents in soils and vegetation of semi-natural ecosystems at Rothamsted Experimental Station,UK[J].Plant and Soil,2002,240(2):235-251.
[6] 张万儒.森林土壤生态管理[M].北京:中国科学技术出版社,1994:119-128.
[7] Du X G, Tang M, Chen H, et al. Mycorrhizae and diversity of microbial community in rhizosphere soils of robinia pseudoacacia at different ages on the loess plateau[J]. Scientia Silvae Sinicae,2008,44(4):78-82.
[8] Baath E, Berg B, Lohm U, et al. Effects of experimental acidif i cation and liming on soil organisms and decomposition in a Scots pine forest [J]. Pedobiologia,1980,20:85-100.
[9] Zhou D Q. Course on Microbiology[M]. Beijing: Higher education Press, 1993,198-199.
[10] 侯晓杰,汪景宽,李世朋.不同施肥处理与地膜覆盖对土壤微生物群落功能多样性的影响[J].生态学报,2007,27(2):655-661.
[11] 罗希茜,郝晓晖,陈 涛,等.长期不同施肥对稻田土壤微生物群落功能多样性的影响[J]. 生态学报,2009,29(2):740-748.
[12] 郑华,欧阳志云,王效科,等.不同森林恢复类型对土壤微生物群落的影响[J].应用生态学报,2004,15(11):2019-2024.
[13] Lovell R D, Jarvis S C, Bardgett R D. Soilmicrobial biomass and activity in long-term grassland: effects of management changes[J]. Soil Biology and Biochemistry, 1995,27: 969-975.
[14] Bardgett R D, Lovell R D, Hobbs P J, et al. Seasonal changes in soil microbial communities along a fertility gradient of temperate grasslands[J]. Soil Biology and Biochemistry,1999,31:1021-1030.
[15] Fauci M F, Dick R P. Soil microbial dynamics: short and longterm effects of inorganic and organic nitrogen[J].Soil Science Society of America,1994,58:801-806.
[16] 王曙光,侯彦林.尿素肥斑扩散对土壤微生物群落结构的影响 [J].生态学报 ,2004,24(10): 2269-2274.
[17] 梁小翠,闫文德,田大伦,等.樟树对土壤中PAHs 的修复及其影响因子[J].中南林业科技大学学报,2012,32(12):176-180.
[18] 赵大勇,闫文德,田大伦,等.不同施肥量对樟树与湿地松土壤氮矿化速率的影响[J].中南林业科技大学学报,2012,32(5):129-133.
[19] 钟文辉,蔡祖聪.土壤管理措施及环境因素对土壤微生物多样性影响研究进展[J].生物多样性,2004,12(4):456-465.
Effects of nitrogen addition on metabolic function of microbial community in red soil of Cinnamomum camphora forest
YU Pei-yi1,2, ZHU Fan1,2, WANG Zhi-yong1,2, YAN Wen-de1,2, SU Shao-feng1,2, LI Tian-ping1,2
(1.School of Life Science and Technology, Central-South University of Forestry & Technology, Changsha 410004, Hunan, China;2. National Engineering Lab. For Applied Technology of Forestry & Ecology in South China, Changsha 410004, Hunan, China)
In order to study the effects of nitrogen addition on soil microbial metabolic characteristics,the metabolic activity and the diversity of soil microbial community were determined by four kinds of plates(BIOLOG AN, FF, GenIII and YT plates)with different nitrogen treatments on Cinnamomum camphora forest in Hunan Botanical Garden. The results show that (1) a high concentration of nitrogen promoted metabolic function of soil microbial anaerobic bacteria, and low nitrogen concentration inhibited its activity; (2) For the soil microbial gram aerobic bacteria,the metabolic function were enhanced signif i cantly under different nitrogen additions; (3) In addition, the metabolic activity of soil microbial fungi and yeast were avoided by different nitrogen additions. The research results of soil microbial diversity were similar to the trend of soil microbial metabolic activity.
nitrogen addition;BIOLOG;microbial community; metabolic function; diversity
S792.23
A
1673-923X(2013)03-0070-05
2012-10-16
“十二五”农村领域国家科技计划课题(2011BAD38B0204);国家林业局推广项目(2012-64);湖南省自然基金项目(10JJ3003);湖南省林业厅项目;湖南省普通高校青年骨干教师培养对象
郁培义(1984-),男,山西太原人,硕士研究生,主要从事城市生态学研究工作
朱 凡(1973-),女,湖南武汉人,副教授,博士,主要从事森林生态方面的研究;E-mail:forestranger33@hotmail.com
[本文编校:吴 毅]
