2种抗生素对球等鞭金藻的毒理学研究
2013-12-24皋德祥宋国梁葛利云邓欢欢张明华
皋德祥,宋国梁,葛利云,邓欢欢,张明华,3
(1.温州医学院水域科学与环境生态研究所,浙江 温州 325035;2.环球环境保护科学设计研究院有限公司 ,浙江 绍兴 312000;3.University of California Land,Air and Water Resources Department,Davis CA 95616)
球等鞭金藻 (Isochrysis galbana),亦称金褐藻(golden brown algae),属于金藻门、普林藻纲、等鞭藻目、等鞭藻科、球等鞭金藻属。球等鞭金藻无细胞壁,易消化.富含多糖、胡萝素及高能量的脂类物质,尤其是富含贝类生长发育所需的不饱和脂肪酸,DHA、EPA等,是一种在海洋中广泛分布的单细胞藻类[1]。其特点是个体较小,繁殖较快,营养丰富,移动速度适中,没有细胞壁,易被贝类的幼虫捕捉、吞下和消化吸收,因而是海洋经济双壳动物幼虫良好的基础饵料[2]。
抗生素类药物主要用于治疗人和动物的各种疾病,同时也长期用于动物饲养和水产养殖业中用来促进生长、繁殖和预防疾病,此类抗生素药物大部分经由人类和动物排泄物以原药或者代谢产物的形式进入环境[3]。抗生素主要针对人类和动物体内的病原性目标致病菌。抗生素及其代谢产物在环境中以低浓度存在,不仅会使环境中产生耐抗生素菌和抗性基因,还会对人体及环境中的其他非目标生物体产生潜在的生态毒理效应[4]。
球等鞭金藻在水产经济动物生产中有着重要的作用。作为一种具有DHA,EPA生产潜力的藻种,球等鞭金藻的研究越来越受到重视,由于球等鞭金藻个体小,生长繁殖快,营养丰富,且无细胞壁,因此是进行水生生态毒理学研究的理想测试体[5]。本文以球等鞭金藻为对象,选取了恩诺沙星(ENR)、盐酸环丙沙星 (CIP)2种抗生素,研究了不同抗生素浓度对球等鞭金藻的生长量、叶绿素含量、过氧化氢酶 (CAT)活性等方面的抑制影响,目的在于为抗生素在现代水产养殖业中的合理安全使用提供数据参考。
1 材料与方法
1.1 实验仪器材料
藻种为球等鞭金藻,取自浙江省海洋水产养殖所,后经温州医学院扩大培养。
抗生素为 ENT(纯度≥98.0%,Amresco产品)和CIP(纯度≥88.5%,Amresco产品)。
1.2 实验方法
藻液的制备球等鞭金藻的培养选用F/2培养基,在BXZ智能型气候箱内进行,培养条件为培养箱温度 (25±1)℃,24 h光照,光强度4 000 lx,每天定时摇瓶4次。
F/2培养基1 L用量:75 g·L-1NaNO31 mL,5 g·L-1NaH2PO4·H2O 1 mL,30 g·L-1NaSiO3·9H2O 1 mL,3.15 g·L-1FeCl3·6H2O1mL,4.36 g·L-1Na2EDTA·2H2O 1 mL,0.75 g· L-1Na2HCO30.75 g,35 g·L-1海盐35 g。配方中各试剂的用量加入到1 L锥形瓶中,再121℃高压灭菌15 min待用。
抗生素浓度的选择。先做预实验,确定浓度范围,使用96EC50值[6]包括在其中,在此浓度范围内取5个浓度值作为正式实验的染毒剂量,同时还设对照组 (不添加抗生素)。
根据96EC50的浓度确定实验组浓度梯度为:ENR分别为0,5,10,15,20,25 mg·L-1;CIP分别为0,2,5,10,30,50和70 mg·L-1;
将抗生素投入到球等鞭金藻生长到对数期的浓度一致的藻液中,每个浓度设两组平行样。测其初始吸光度。之后将藻液放在25℃人工气候箱中,光强4 000 lx条件下培养,24 h光照,每天人工摇动4次,每天交换各瓶位置,使之均匀接受光照,试验开始96 h后,取出测其吸光度,计算抑制率/%=100× (对照组-实验组) ÷对照组。
1.3 分析方法
藻液浓度的测定。在680 nm波长下,以F/2培养基为参比测定原藻液及各工作藻液的吸光度值D680nm。以上测得的吸光度值 D680nm为横坐标,球等鞭金藻个数为纵坐标绘制标准曲线,使用藻液时通过测定吸光度值D680nm来确定藻液浓度,计算公式为:藻液浓度=84.37D680nm-0.212,相关系数为R2=0.996,其中藻液的浓度以105为数量级。
叶绿素含量的测定。叶绿素的实验室测量方法采用分光光度法[7],采用丙酮热提取法提取后利用分光光度计在某一特定波长下测定其吸光度,即可用公式计算出提取液中各色素的含量[8-9]。叶绿素测定主要按照三色法公式,计算出叶绿素a、叶绿素b与总叶绿素的含量。
CAT活性的测定。本文采用碘量滴定法[10]对球等鞭金藻的CAT活性进行测量分析。
2 结果与分析
2.1 抗生素对球等鞭金藻生长量影响
2.1.1 ENR对球等鞭金藻96EC50的测定
将ENR分别投入到球等鞭金藻生长到对数期的浓度一致的藻液中,每个浓度设2个平行样,测其初始吸光度;随后将藻液放入培养箱中继续培养,96 h后,取出分别测其吸光度,两平行样取平均值进行计算抑制率。图1中将ENR浓度对数为横坐标,计算得到的抑制率为纵坐标。图中50%抑制率相对应的浓度即为ENR对球等鞭金藻的96EC50。
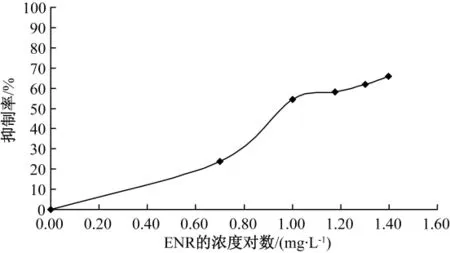
图1 不同浓度ENR对球等鞭金藻抑制率的影响
图1 中实验数据表明,ENR浓度越高,其相对球等鞭金藻生长的抑制率也越高。当其浓度为25 mg·L-1时,抑制率达到65.80%。当抑制率为50%时,其对应的浓度约为8.913 mg·L-1。由图1可见,在ENR毒性实验中,其剂量、抑制效应关系表现良好,随ENR浓度的增加,球等鞭金藻生长受到抑制愈加明显,说明浓度越大,对藻液毒性越强,愈加抑制球等鞭金藻的生长。在0~10 mg·L-1浓度下有明显的抑制效果。当 ENR浓度大于10 mg·L-1后,对球等鞭金藻的生长抑制幅度变小,抑制率趋于最大。
2.1.2 CIP对球等鞭金藻96EC50的测定
CIP对球等鞭金藻96EC50的实验方法同ENT的方法。图2中将CIP的浓度对数为横坐标,计算得到球等鞭金藻的抑制率为纵坐标,图中50%抑制率相对应的浓度即为CIP对球等鞭金藻的96EC50。

图2 不同浓度CIP对球等鞭金藻抑制率的影响
图2 表明,随着CIP浓度的增加,其对球等鞭金藻的抑制效果也越明显。本实验设计的CIP浓度跨度大,当为70 mg·L-1时,其对球等鞭金藻的抑制率高达80.80%;当抑制率为50%时,其对应的CIP浓度为25.12 mg·L-1。由此可知,在 CIP毒性实验中,其剂量—抑制效应关系表现明显。随CIP浓度的增加,球等鞭金藻的生长受到抑制愈加明显,细胞密度逐渐降低。在0~70 mg·L-1的浓度梯度中,CIP对球等鞭金藻都有明显的抑制效果,幅度较大。
2.2 抗生素对球等鞭金藻叶绿素含量影响
2.2.1 ENR对球等鞭金藻叶绿素含量的影响
在加入ENR 96 h后,对样品的叶绿素含量也进行了测定,ENR浓度和叶绿素含量的关系如图3所示。

图3 不同浓度ENR对球等鞭金藻叶绿素含量的影响
图3 中为不同浓度的ENR影响下叶绿素含量比较图,本实验分别测定了样品的叶绿素a,叶绿素b和总叶绿素的含量。ENR投加浓度范围为0~25 mg·L-1,总叶绿素浓度范围在2.0 mg·L-1内。由图3可知,随着ENR浓度的变化,球等鞭金藻叶绿素含量变化不大。在ENR浓度在15 mg·L-1时,球等鞭金藻叶绿素的含量甚至高于对照组的值。
2.2.2 CIP对球等鞭金藻叶绿素含量的影响
同样在加入96 h后,CIP浓度和叶绿素含量的关系如图4所示。
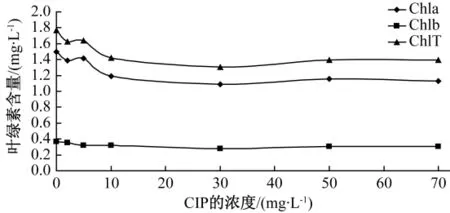
图4 不同浓度CIP对球等鞭金藻叶绿素含量的影响
图4 为不同浓度CIP影响下球等鞭金藻叶绿素含量的比较图。本实验分别测定了样品的叶绿素a,叶绿素b和总叶绿素的含量。CIP浓度范围为0~70 mg·L-1,叶绿素浓度范围在1.8 mg·L-1内。CIP浓度在0~10 mg·L-1范围内,叶绿素含量有明显的下降趋势,其中叶绿素b下降的幅度比叶绿素a下降的幅度要明显。CIP浓度在10~70 mg·L-1范围内,叶绿素含量整体平缓抗生素抑制球等鞭金藻的叶绿素趋于最大。而在整个浓度区间内球等鞭金藻叶绿素b的含量变化一点都不明显。
2.3 抗生素对球等鞭金藻CAT活性的影响
2.3.1 ENR对球等鞭金藻CAT活性影响
用碘量滴定法对加入了ENT的96 h后的球等鞭金藻样品进行CAT测定。不同浓度ENT藻液培养96 h后,其浓度同球等鞭金藻CAT活性的关系如图5所示。

图5 不同浓度ENT对球等鞭金藻CAT活性的影响
图5 中表明了随着ENT的浓度的升高,球等鞭金藻的CAT活性呈递减趋势,ENT在0~25 mg·L-1范围内金藻的CAT浓度减少的幅度很小。
2.3.2 CIP对球等鞭金藻CAT活性的影响
用碘量滴定法对加入了CIP后96 h的球等鞭金藻样品进行CAT活性测定。不同浓度CIP加入藻液培养96 h后,CIP浓度同球等鞭金藻CAT活性的关系如图6所示。
图6 中可以看出,CIP浓度在0~10 mg·L-1范围时,球等鞭金藻CAT活性下降的比较明显。在CIP浓度>10 mg·L-1后,球等鞭金藻 CAT活性还是小于对照组的,但是减小的幅度随着CIP的浓度升高而不明显。
3 小结和讨论
ENT和CIP对球等鞭金藻的96EC50的分别为8.913和25.12 mg·L-1,根据国家环保局的新化学物质危害评估准则[11]中的生态毒理学危害性分级标准:EC50极毒 (3级)<1.0 mg·L-1,高毒 (2级)1.0~10.0 mg·L-1,中毒 (1级)10.0~100.0 mg·L-1,低毒 (0级) >100 mg·L-1,确定 ENT和CIP对球等鞭金藻的危害等级分别为高毒和中毒,即分别为2级和1级。这表明水产养殖业应该注意谨慎使用ENT和CIP等抗生素,认识到其对饵料球等鞭金藻的危害,以提高养殖产品的产量。
通过对投放2种抗生素的球等鞭金藻叶绿素测定结果表明,总体上来讲2种抗生素对球等鞭金藻的叶绿素生长没有明显的抑制效果。ENT浓度在15 mg·L-1时球等鞭金藻的叶绿素含量甚至大于对照组叶绿素含量,这种现象可以用毒物的兴奋效应来解释,即在低浓度下某些有毒化合物可以在一定的程度上促进细胞的某些生理活动[12]。CIP在低浓度0~10 mg·L-1范围内对球等鞭金藻的叶绿素含量影响比较大,浓度越大抑制效果越明显;而在>10 mg·L-1后,随着CIP浓度的升高,其对球等鞭金藻叶绿素含量的抑制效果基本达到了稳定的趋势,即达到了一个抑制的阈值。
通过对投放2种抗生素的球等鞭金藻的CAT活性的测定可以看出,总体上球等鞭金藻的CAT活性是随着ENT和CIP浓度的升高有小幅度的减小。但是ENT浓度对球等鞭金藻的CAT活性影响不明显。CIP在0~10 mg·L-1范围内对球等鞭金藻的CAT活性影响比较明显,CIP浓度>10 mg·L-1后,其浓度对球等鞭金藻的CAT活性抑制效果就基本上达到了稳定的趋势。
ENT对球等鞭金藻叶绿素与对CAT活性的影响效果一致,抑制效果均不明显。而CIP对叶绿素和CAT活性的影响都表现为在0~10 mg·L-1浓度内抑制效果较明显,当浓度>10 mg·L-1后,CIP浓度升高对两者的抑制效果影响不大。这说明抗生素对叶绿素和CAT活性的作用机制在某种程度上有无相似性还有待进一步分析研究。
[1] 戴俊彪,吴庆余.室内外培养海洋单细胞微藻的生长及生化组分 [J].海洋科学,2000,24(6):29-32.
[2] Zhang Man,Zeng Bo,Wang Minghu,et al.The temperature elevation suppresses the light energy utilization and growth of hlolorella pyrenoidosa under high light intensity conditions [J].Acta Ecologica Sinica,2007,27(2),662-667.
[3] 王蓓蕾,蒋煜峰,朱琨.水环境中抗生素的研究进展[J].农业与技术,2012,32(4):158-159.
[4] 刘建超,陆光华,杨晓凡,等.水环境中抗生素的分布、累积及生态毒理效应 [J].环境监测管理与技术,2012,24(4):14-20.
[5] 李锋,刘淇,王群,等.聚六亚甲基胍对球等鞭金藻和亚心形扁藻的生长抑制试验 [J].安徽农业科学,2008,36(6):2179-2180.
[6] 吴妹英.鳗鱼养殖常用药物对铜绿微囊藻繁殖的影响[J].福建水产,2009,123(4):15-21.
[7] 金相灿,屠清瑛.湖泊富营养化调查规范 [M].北京:中国环境科学出版社,1990:268-270.
[8] 岳红,卢其能,赵昶灵,等.贮藏条件对马铃薯龙葵素和叶绿素含量的影响 [J].浙江农业科学,2011(5):1082-1084.
[9] 吴志旭,张雅燕.叶绿素a测定方法的改进及最优提取时间探讨 [J].甘肃环境研究与监测,2003,16(2):150-152.
[10] 郝建军,康宗利,于洋.植物生理学实验技术 [M].北京:化学工业出版社,2007:102-103.
[11] 国家环保保护总局.新化学物质危害评估导则 [M].北京:中国环境科学出版社,2004:12.
[12] 王长海,孙颖颖.球等鞭金藻细胞生长抑制因子的初步研究 [J].海洋通报,2006,25(3),29-33.
