佛手低温胁迫相关基因的差异表达
2013-12-23陈文荣叶杰君李永强张真真曹诣斌郭卫东
陈文荣,叶杰君,李永强,张真真,曹诣斌,郭卫东
(浙江师范大学化学与生命科学学院,金华 321004)
低温是影响经济作物产量和品质的主要环境因素之一。植物经低温胁迫后,植物脯氨酸、甜菜碱和可溶性糖等兼容渗透剂大量积累,从而改变了原有的细胞壁结构以及脂质膜和碳水化合物的组成[1]。同时,低温胁迫能够诱导植物体内某些基因的表达,这些基因的表达蛋白可能直接参与低温胁迫的应答或者间接调控其他靶基因的表达[2]。Weiser[3]早在1970年就提出植物抗寒性诱导过程中基因表达改变的观点,指出多年生木本植物的低温适应性可能需要两个条件,即特异基因的转录激活和在最大抗寒过程中新蛋白质的低温诱导合成。陈香波等[4]列表总结了从拟南芥、黑麦、欧洲油菜、大麦、菠菜、小麦、苜蓿、马铃薯等鉴定分离出与植物抗寒性有关的低温诱导基因62个,并指出这些基因的功能与抗冰冻脱水、膜脂相变、低温下酶活性以及“抗冻活性”有关。
柑橘属(Citrus)植物的果实是世界第一大水果类别,我国的柑橘产量位居世界第一。柑橘属植物是亚热带植物,性喜温暖,对低温反应敏感,所以温度是影响柑橘属植物产量和品质的一个重要气候因素。佛手(Citrusmedicavar.sarcodactylisSwingle)是芸香科柑橘属香橼的变种,其果型奇特,具有较高的观赏和药用价值,也是中国特色的物种。但是由于佛手抗寒性差,植株半致死温度为-4℃左右[5],低温冻害后其品质和产量均会受到影响。研究表明,低温胁迫下佛手的ERF6基因[6]和GRAS基因[7]的表达量发生明显的变化,低温对两种基因的表达均有诱导作用。由于抗寒性差的原因,佛手的栽培地局限在亚热带北缘以南地区,这很大程度的限制了佛手在我国北方广大地区的栽培、种植和佛手产业的发展。
目前,对寒敏感柑橘类植物的研究很少[8],对佛手等寒敏感柑橘类植物对低温应答的分子途径、低温诱导特异基因的表达变化情况和引起寒敏感的分子机理少有报道。本文以浙江金华地区佛手主栽品种青皮佛手为试材,采用mRNA差异显示技术获得佛手低温胁迫前后差异表达的cDNA片段,BLAST确定其功能后,采用半定量PCR技术确定这些基因在佛手低温胁迫前后的表达量变化情况,从而获得寒敏感佛手低温胁迫相关基因,分析低温应答分子机制。通过本研究为佛手寒敏感基因的获得和寒敏感机制的研究提供依据。
1 材料与方法
1.1 材料
选取长势一致的2年生青皮佛手(C.medicacv. Qingpi)盆栽苗,采自浙江师范大学佛手实验基地——浙江锦林佛手有限公司。在人工气候室进行预培养及抗寒锻炼,温度设置参照刘祖祺等的方法,预培养温度为20(黑夜)/28(白天) ℃,光照每天14 h,光照强度100 μmol·m-2·s-1,湿度75%,定期浇水;预培养3周后在2 d时间内将温度缓慢降至4 ℃进行冷锻炼7d。
1.2 低温处理
随机选取3盆青皮佛手盆栽苗移入冷库,处理条件为温度-4 ℃,光照14 h,湿度75%,温度控制精度为±0. ℃1,处理时间为24 h。取完整、无病虫害的自当年生春夏梢顶向下数第5—11叶位的7张叶片用于后续实验。
1.3 DDRT-PCR分析
1.3.1 DDRT-PCR引物及内参引物的设计
mRNA差异显示分析引物按Genhunter Corporation RNA imageTM Kit 序列进行设计,引物序列见表1。引物由上海invitrogen合成。

表1 锚定引物、随机引物及内参引物列表
1.3.2 总RNA提取及mRNA纯化
采用Trizol试剂盒(invitrogen)提取叶片总RNA,DNAase消化去除基因组DNA,并采用OligotexTM-d(T)30
1.3.3 cDNA第一链合成
纯化得到的mRNA应用3种锚定引物(H-T11G,H-T11C, H-T11A)参照invitrogen的SuperscriptTMIII Reverse Transcriptase进行mRNA反转录得到cDNA。
1.3.4 DDRT-PCR扩增
将3′锚定引物3条,5′随机引物8条,共24对引物组合,分别进行PCR扩增。扩增体系和程序主要参考Liang等1992年提供的方法,略加更改。25 μL反应体系中含10×PCR Buffer(Mg2+Plus) 2.5 μL、dNTP(2.5mmol/L each) 2 μL、锚定引物(20 μmol/L)和随机引物(20 μmol/L) 各2.0 μL、TAKARA Taq(5 U/μL) 0.2 μL以及2 μLcDNA模板溶液,加无菌纯水补充总体积至25 μL。PCR反应程序为94 ℃预变性5 min,然后进行94 ℃变性30 s,40 ℃退火2 min、72 ℃延伸1 min的循环反应,共40个循环,最后于72 ℃下延伸5 min,4 ℃保存。
1.3.5 差异片段的分离及回收
采用8%非变性聚丙烯酰胺凝胶电泳分离差异片段,银染显色。从银染结果中选取差异表达的条带进行回收,选取的标准是,处理和对照条带同一高度上有无差异和明显的表达量差异。聚丙烯酰胺凝胶回收使用BioFlux的Biospin聚丙烯酰胺凝胶DNA回收试剂盒进行。
1.3.6 差异片段的重扩及回收
直接取回收的差异片段2 μL作为模板,选择对应的引物组合,进行二次扩增,PCR的体系与程序与上文中相同。重扩后1%的琼脂糖凝胶电泳,紫外灯下检测重扩后的条带是否与回收的条带片段大小相同,如是同一条带进行琼脂样凝胶的回收。琼脂糖凝胶回收用的试剂盒是上海生工生产的UNIQ-10 DNA胶回收试剂盒(SK1131)回收和纯化目的片段。
1.4 差异片段的克隆
采用氯化钙2次重悬法制备JM109感受态细胞,回收的差异片段与pMD18-T Simple Vector(TaKaRa)16 ℃进行连接,连接产物转入JM109感受态细胞,菌液涂平板后挑取单菌斑培养,做菌液PCR检测对重组子进行阳性鉴定,反应体系和程序和生成目的片段的PCR反应一致。
1.5 阳性转化重组子的测序和序列的生物信息学分析
阳性克隆子的测序工作由上海英骏生物工程技术服务有限公司(Invitrogen,China)商业化完成,采用通用引物M13F/M13R组合起始测序。序列对比在NCBI (http://www.ncbi.nlm.nih.gov/)网站上,进行BLASTx和BLASTn分析。
1.6 半定量RT-PCR鉴定目的基因表达量差异
1.6.1 引物设计
β-actin引物参考Genbank中已发表的序列,设计兼并引物,在佛手cDNA中扩增出目的片段后,克隆、测序,再设计特异引物,设计的佛手特异引物序列为:Sense:TGCCATCCACGCCGTTCTATCT,Antisense:ATCACGACCAGCCAAGTCCAAA,引物均采用primer primer5设计,由上海生物工程有限公司合成。
1.6.2 半定量RT-PCR反应条件的确定
以cDNA为模板,目的基因引物对和β-actin在异管同台PCR中进行反应,设置不同的循环数,22、24、26、28、30、32、34、36个循环数,确定合适的条件,保证扩增均处于线性期。PCR反应程序参数为94 ℃预变性5 min,然后进行94 ℃变性30 s,50—60 ℃退火30 s、72 ℃延伸30 s的循环反应,循环数为22—36个,最后于72 ℃下延伸5 min,4 ℃保存。
1.6.3 PCR产物的检测
PCR扩增产物在含溴化乙锭的2.0%琼脂糖凝胶中电泳,电泳结果在紫外灯下用Bio-red公司成像系统自带Quantity One软件进行扫描成像和光密度分析。
2 结果与分析
2.1 总RNA的提取与检测结果
提取的总RNA经DNA酶消化后在全波长酶标仪(Thermo)上测定OD260/OD280,结果比值均在1.8—2.0之间,说明RNA样品的纯度较好。用1%的琼脂糖凝胶电泳测定总RNA完整性,电泳结果显示,28S、18S条带清晰,无降解,说明总RNA完整性好,可以用于后续实验。
2.2 mRNA差异显示结果
以青皮佛手对照和处理组叶片总RNA为模板,分别用3种锚定引物进行逆转录反应,得到6种cDNA;再以这6种cDNA为模板,3种锚定引物与8种随机引物组合进行PCR扩增。对相同引物组合扩增得到的对照组和处理组的PCR产物进行差异比较。在mRNA差异显示过程中,聚丙烯酰胺凝胶上24对引物组合在佛手mRNA中共扩增出3000多条cDNA序列。图1为其中7组引物对扩增出的佛手对照和处理cDNA片段。
通过DDRT-PCR,比较对照组和处理组扩增结果,121条差异表达的cDNA片段被成功克隆和测序。经生物信息学分析,差异表达序列中有33条为功能已知序列,88条为未知序列(其中5条具有开放性阅读框)。
2.3 半定量RT-PCR分析结果
将上述的33条已知差异表达序列及5条具有开放性阅读框的未知序列进行半定量RT-PCR分析,以进一步确定低温胁迫前后这些差异表达片段表达量的变化。差异片段进行RT-PCR的引物序列、退火温度及PCR反应循环数见表2。
表2DDRT的产物进行半定量RT-PCR验证时各产物对应的引物序列、退火温度和循环数
Table2Oligonucleotideprimersequences,PCRconditionsandcyclenumbersfortheconfirmationofdifferentialdisplay(DD)productswithquantitativerelativereversetranscription(RT)-PCR
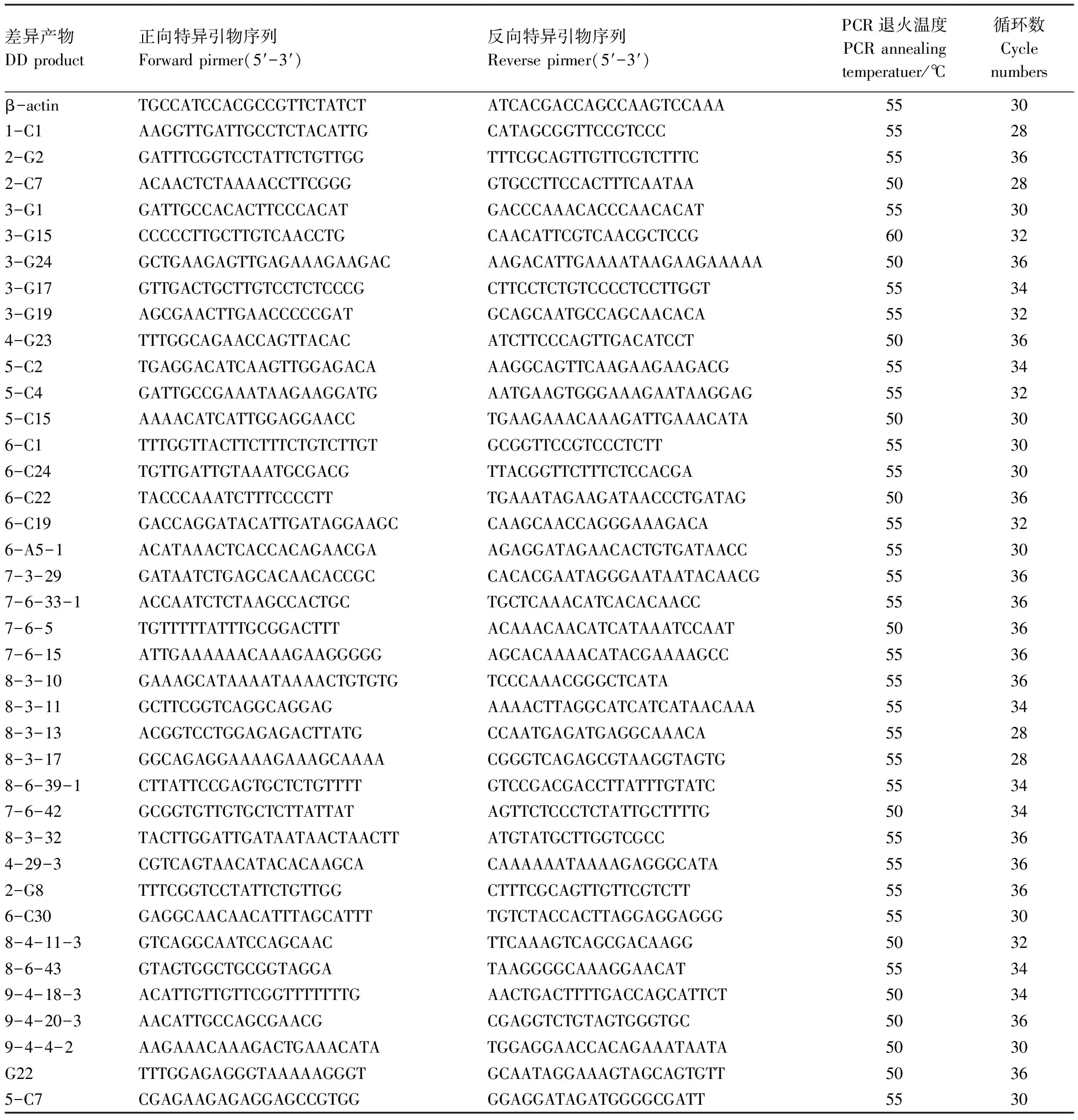
差异产物DDproduct正向特异引物序列Forwardpirmer(5′-3′)反向特异引物序列Reversepirmer(5′-3′)PCR退火温度PCRannealingtemperatuer/℃循环数Cyclenumbersβ-actinTGCCATCCACGCCGTTCTATCTATCACGACCAGCCAAGTCCAAA55301-C1AAGGTTGATTGCCTCTACATTGCATAGCGGTTCCGTCCC55282-G2GATTTCGGTCCTATTCTGTTGGTTTCGCAGTTGTTCGTCTTTC55362-C7ACAACTCTAAAACCTTCGGGGTGCCTTCCACTTTCAATAA50283-G1GATTGCCACACTTCCCACATGACCCAAACACCCAACACAT55303-G15CCCCCTTGCTTGTCAACCTGCAACATTCGTCAACGCTCCG60323-G24GCTGAAGAGTTGAGAAAGAAGACAAGACATTGAAAATAAGAAGAAAAA50363-G17GTTGACTGCTTGTCCTCTCCCGCTTCCTCTGTCCCCTCCTTGGT55343-G19AGCGAACTTGAACCCCCGATGCAGCAATGCCAGCAACACA55324-G23TTTGGCAGAACCAGTTACACATCTTCCCAGTTGACATCCT50365-C2TGAGGACATCAAGTTGGAGACAAAGGCAGTTCAAGAAGAAGACG55345-C4GATTGCCGAAATAAGAAGGATGAATGAAGTGGGAAAGAATAAGGAG55325-C15AAAACATCATTGGAGGAACCTGAAGAAACAAAGATTGAAACATA50306-C1TTTGGTTACTTCTTTCTGTCTTGTGCGGTTCCGTCCCTCTT55306-C24TGTTGATTGTAAATGCGACGTTACGGTTCTTTCTCCACGA55306-C22TACCCAAATCTTTCCCCTTTGAAATAGAAGATAACCCTGATAG50366-C19GACCAGGATACATTGATAGGAAGCCAAGCAACCAGGGAAAGACA55326-A5-1ACATAAACTCACCACAGAACGAAGAGGATAGAACACTGTGATAACC55307-3-29GATAATCTGAGCACAACACCGCCACACGAATAGGGAATAATACAACG55367-6-33-1ACCAATCTCTAAGCCACTGCTGCTCAAACATCACACAACC55367-6-5TGTTTTTATTTGCGGACTTTACAAACAACATCATAAATCCAAT50367-6-15ATTGAAAAAACAAAGAAGGGGGAGCACAAAACATACGAAAAGCC55368-3-10GAAAGCATAAAATAAAACTGTGTGTCCCAAACGGGCTCATA55368-3-11GCTTCGGTCAGGCAGGAGAAAACTTAGGCATCATCATAACAAA55348-3-13ACGGTCCTGGAGAGACTTATGCCAATGAGATGAGGCAAACA55288-3-17GGCAGAGGAAAAGAAAGCAAAACGGGTCAGAGCGTAAGGTAGTG55288-6-39-1CTTATTCCGAGTGCTCTGTTTTGTCCGACGACCTTATTTGTATC55347-6-42GCGGTGTTGTGCTCTTATTATAGTTCTCCCTCTATTGCTTTTG50348-3-32TACTTGGATTGATAATAACTAACTTATGTATGCTTGGTCGCC55364-29-3CGTCAGTAACATACACAAGCACAAAAAATAAAAGAGGGCATA55362-G8TTTCGGTCCTATTCTGTTGGCTTTCGCAGTTGTTCGTCTT55366-C30GAGGCAACAACATTTAGCATTTTGTCTACCACTTAGGAGGAGGG55308-4-11-3GTCAGGCAATCCAGCAACTTCAAAGTCAGCGACAAGG50328-6-43GTAGTGGCTGCGGTAGGATAAGGGGCAAAGGAACAT55349-4-18-3ACATTGTTGTTCGGTTTTTTTGAACTGACTTTTGACCAGCATTCT50349-4-20-3AACATTGCCAGCGAACGCGAGGTCTGTAGTGGGTGC50369-4-4-2AAGAAACAAAGACTGAAACATATGGAGGAACCACAGAAATAATA5030G22TTTGGAGAGGGTAAAAAGGGTGCAATAGGAAAGTAGCAGTGTT50365-C7CGAGAAGAGAGGAGCCGTGGGGAGGATAGATGGGGCGATT5530
为了提高半定量RT-PCR的准确性,每个差异片段做不同模板来源重复,PCR板内重复和不同批次PCR重复,只有这3个重复表达趋势一致的差异片段才被视为阳性。每一批次的PCR反应都带有内参β-actin,并在同一块琼脂糖凝胶上成像,只有同块胶上的β-actin表达量一致的,才记做1个重复,这样可以尽可能的减少凝胶成像上所带来的假阳性。
根据半定量RT-PCR分析鉴定,38个差异片段中有4个是假阳性片段,34个阳性片段。在通过鉴定的阳性片段中,有29个差异片段低温胁迫前后表达量上调,其表达量变化见图2;有5个差异片段低温胁迫前后表达量下调,其表达量变化见图3。

图2 29个上调基因经过半定量RT-PCR分析后的琼脂糖凝胶电泳图
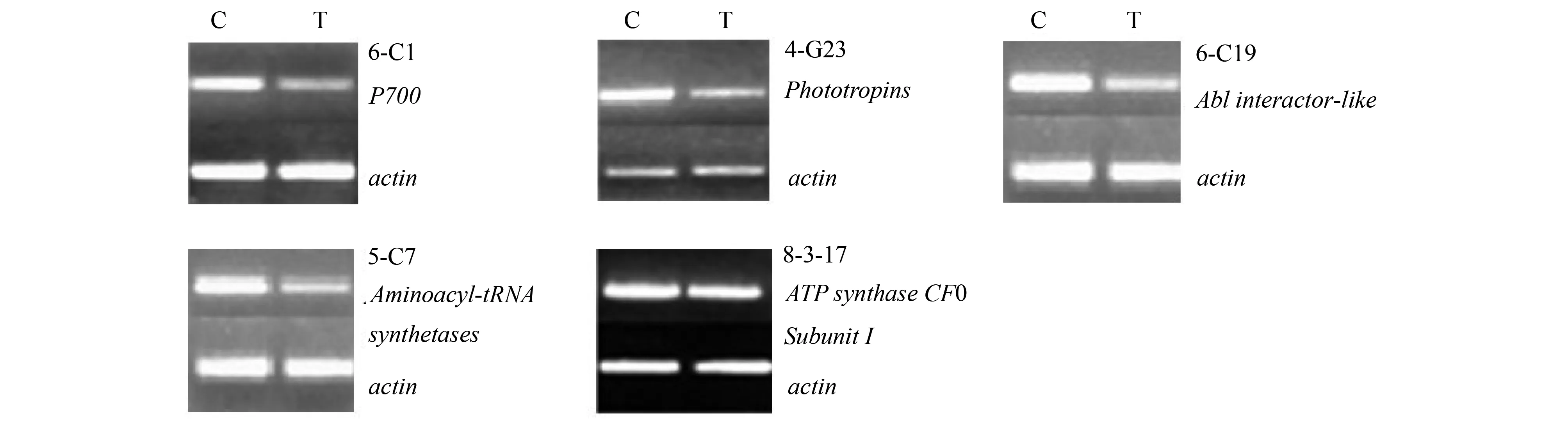
图3 5个下调基因经过半定量RT-PCR分析后的琼脂糖凝胶电泳图
将这34个阳性差异片段根据其对应的功能和寒胁迫的关系进行分类,可分为植物逆境应答、新陈代谢、细胞壁重建、信号转导、氧化应激、转录调节、蛋白、脂肪和糖合成和转运、未知功能蛋白,共8类,其对应功能、分类情况和序列信息见表3。
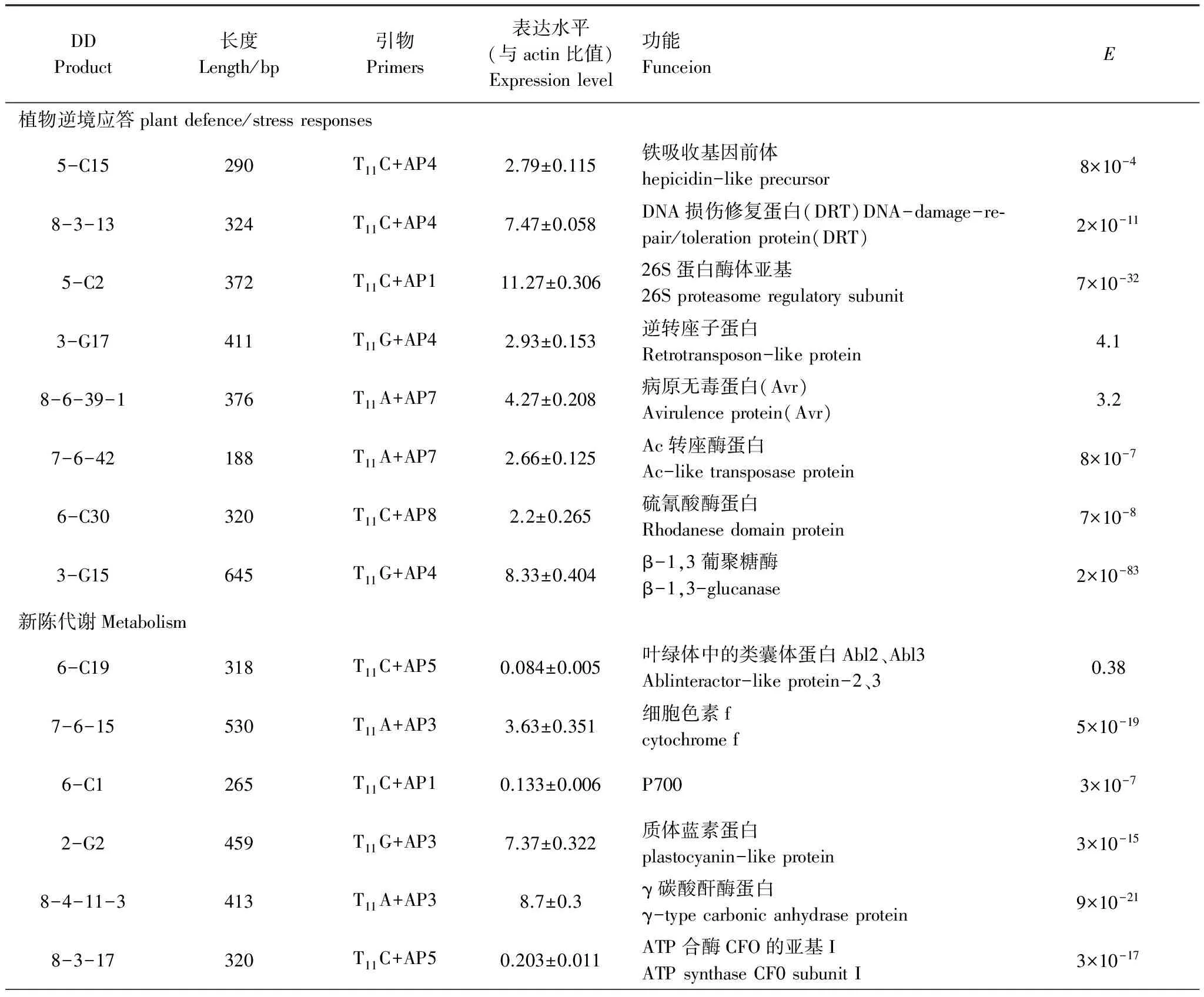
表3 DD产物对应功能列表
续表
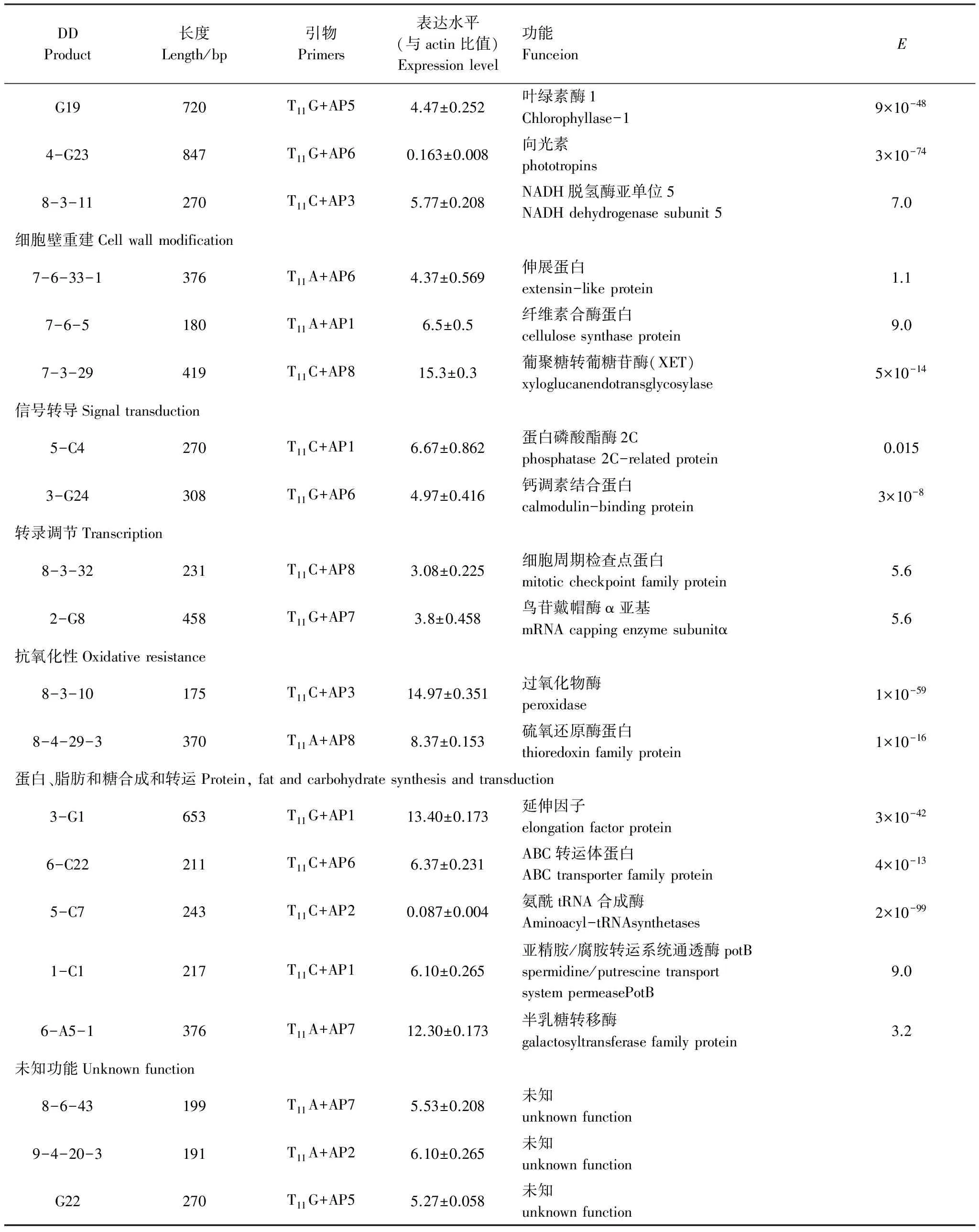
DDProduct长度Length/bp引物Primers表达水平(与actin比值)Expressionlevel功能FunceionEG19720T11G+AP54.47±0.252叶绿素酶1Chlorophyllase-19×10-484-G23847T11G+AP60.163±0.008向光素phototropins3×10-748-3-11270T11C+AP35.77±0.208NADH脱氢酶亚单位5NADHdehydrogenasesubunit57.0细胞壁重建Cellwallmodification7-6-33-1376T11A+AP64.37±0.569伸展蛋白extensin-likeprotein1.17-6-5180T11A+AP16.5±0.5纤维素合酶蛋白cellulosesynthaseprotein9.07-3-29419T11C+AP815.3±0.3葡聚糖转葡糖苷酶(XET)xyloglucanendotransglycosylase5×10-14信号转导Signaltransduction5-C4270T11C+AP16.67±0.862蛋白磷酸酯酶2Cphosphatase2C-relatedprotein0.0153-G24308T11G+AP64.97±0.416钙调素结合蛋白calmodulin-bindingprotein3×10-8转录调节Transcription8-3-32231T11C+AP83.08±0.225细胞周期检查点蛋白mitoticcheckpointfamilyprotein5.62-G8458T11G+AP73.8±0.458鸟苷戴帽酶α亚基mRNAcappingenzymesubunitα5.6抗氧化性Oxidativeresistance8-3-10175T11C+AP314.97±0.351过氧化物酶peroxidase1×10-598-4-29-3370T11A+AP88.37±0.153硫氧还原酶蛋白thioredoxinfamilyprotein1×10-16蛋白、脂肪和糖合成和转运Protein,fatandcarbohydratesynthesisandtransduction3-G1653T11G+AP113.40±0.173延伸因子elongationfactorprotein3×10-426-C22211T11C+AP66.37±0.231ABC转运体蛋白ABCtransporterfamilyprotein4×10-135-C7243T11C+AP20.087±0.004氨酰tRNA合成酶Aminoacyl-tRNAsynthetases2×10-991-C1217T11C+AP16.10±0.265亚精胺/腐胺转运系统通透酶potBspermidine/putrescinetransportsystempermeasePotB9.06-A5-1376T11A+AP712.30±0.173半乳糖转移酶galactosyltransferasefamilyprotein3.2未知功能Unknownfunction8-6-43199T11A+AP75.53±0.208未知unknownfunction9-4-20-3191T11A+AP26.10±0.265未知unknownfunctionG22270T11G+AP55.27±0.058未知unknownfunction
3 讨论
低温胁迫容易引起植物光合、呼吸作用关键基因的表达下调,同时植物生长停滞以保证代谢所需的碳水化合物及能量;植物抗冷机制还包括细胞物理结构(质膜组成和细胞骨架)的适应性发变、胞内渗透保护物质(脯氨酸、甜菜碱和可溶性糖)大量积累[1]、抗氧化剂的合成水平上升;使植物恢复物质与能量代谢平衡。植物对冷胁迫的应答过程中发生的一系列生理、生化变化,是复杂的内在分子机制调控的结果,涉及大量的基因在表达模式、转录水平及转录后修饰方式等方面发生变化,但不同植物对低温胁迫的应答机制也存在着一定的差异[2]。揭示植物在逆境下所表现出的复杂的基因表达变化情况,对于正确解答植物对逆境的应答机制有非常重要的科学意义。
相对于枳等耐寒的柑桔属植物,佛手对低温胁迫较敏感,-4 ℃低温处理后,嫩叶出现萎蔫等典型症状[5]。本研究通过mRNA差异显示技术筛选和半定量RT-PCR技术验证,获得了34个阳性差异cDNA片段。这34个佛手低温胁迫相关基因,根据其功能的归属大致可分为以下几类:8个与植物组织抵御相关基因、9个与光合作用或其他代谢相关基因、3个细胞壁代谢相关基因、5个与蛋白、脂肪和糖合成和转运相关基因、2个与信号转导相关基因、2个与抗氧化相关基因、2个与转录调节相关基因和3个功能未知基因。以下探讨其中一部分关键基因的功能和应答机理。
3.1 光合作用相关基因
低温使得生物膜结构发生显著变化,进而导致植物体内新陈代谢的有序性被打破,特别是光合作用受到影响。植物叶绿体的类囊体膜在光下催化ADP形成ATP的反应,有两种类型:循环式光合磷酸化(cyclic photophosphorylation)和非循环式光合磷酸化。在34个佛手低温胁迫相关基因中,有4个基因对应蛋白功能与循环式光合磷酸化的光合链相关:6-C19(类囊体蛋白ALB2、ALB3,Ablinteractor-like protein-2、3)、6-C1(P700)、2-G2(质体蓝素蛋白,plastocyanin-like protein)、7-6-15(细胞色素f,cytochrome f)。半定量PCR结果表明,佛手的Ablinteractor-like和P700,在低温胁迫后表达量明显下调;plastocyanin-like和cytochromef表达量略微上调。这些基因在低温胁迫后表达量的变化,说明佛手在低温逆境中其循环式光合磷酸化途径受到了影响,进而影响到佛手的光合作用,这可能是低温造成佛手光合能力下降的原因之一。
除此之外,在佛手低温胁迫下获得的光合相关基因片段还有8-4-11-3、G19、8-3-17、8-3-17、4-G23分别同源于γ碳酸酐酶(γ-type carbonic anhydrase protein)、叶绿素酶1(Chlorophyllase-1)、ATP合酶CFO亚基I(ATP synthase CF0 subunit I)及向光素(phototropins)基因。其中γ碳酸酐酶和叶绿素酶对应的片段在低温胁迫后表达量增加。碳酸酐酶被认为在逆境条件下参与了光合速率的调节,Downton和Slatyer[9]认为在干旱或高温条件下光合速率的变化与碳酸酐酶活性的变化有一定的相关性。叶绿素酶1的作用是降解叶绿素,低温胁迫能使原有的叶绿素受到破坏而降解,本研究中佛手叶绿素酶1基因表达量的增加,可能是用于水解低温下受破坏的佛手叶绿素。ATP合酶CFO亚基Ⅰ和向光素对应的佛手差异片段在低温胁迫后表达量减少,魏家绵等[10]研究表明,叶绿体中的ATP合酶亚基Ⅰ可以通过与亚基Ⅱ-CF1亚基δ的交联会引起光合磷酸化的抑制。向光素能够结合黄素单核苷酸(FMN)进行自动磷酸化作用,它介导植物向光性运动、叶绿体移动与气孔开放等反应,在蓝光信号传导反应中它启动生长素载体的运动和诱导Ca2+的流动,从而调节植物细胞代谢相关反应。
植物体代谢的重新调整,是植物增加抗性的主要机理之一[11],而佛手的低温引起的差异片段中有8个基因与光合作用有关,这就说明了在低温胁迫下佛手的光合作用受到了很大的影响,从而影响到了佛手的正常代谢。
3.2 植物逆境应答相关基因
低温胁迫会导致多种基因的应激上调,以应对突如其来的冷害,增加植物对寒冷的抵御能力。在佛手低温胁迫获得的差异片段中,有8个与植物逆境应答有关,这些片段经BLAST比对后与拟南芥等植物逆境胁迫下表达的、有功能注释的基因同源,且这些片段在低温胁迫后均上调。植物通过诱导表达或上调表达一系列基因,在植物逆境应答中降解异常蛋白、修复损伤蛋白、运输有毒物质、维持细胞平衡,从而增加植物对胁迫环境的抵御能力。
8-3-13高度同源于拟南芥在辐射和化学试剂诱导下产生的DNA损伤修复蛋白DRT[12]基因,DRT能与胁迫后受到损伤的DNA结合,从而起到对损伤DNA的保护作用[13]。本研究中,佛手DRT的表达量在低温下明显增加,有利于了修复低温胁迫造成的DNA损伤,减轻对植株生长、代谢的影响。
环境胁迫下,植物会启动蛋白降解以维持细胞的正常功能[14]。5-C2高度同源于拟南芥26S蛋白酶体亚基(26S proteasome regulatory subunit)的基因。26S蛋白酶体被认为在依赖ATP的非溶酶体降解途径中起着重要作用[15],它不仅能破坏不稳定的调节蛋白,而且还能降解长命的组成性表达蛋白;另外,它能快速消除因突变或多种环境胁迫(如高温、氧化胁迫和重金属)造成的结构不正常的蛋白质,部分介导生物的抗逆性[16-17],因此它在逆境下对维持细胞的生存能力似乎是不可缺少的。佛手低温胁迫后5-C2的表达量明显上调,过量的26S 蛋白酶体将对佛手由于低温胁迫产生的一些不正常的蛋白质进行降解,以提高其对低温的抵御能力。
硫氰酸酶(Rhodanese domain protein)能使有毒的氰化物转变为无毒的硫氰酸盐,具有使植物组织解毒的功能[18]。而在佛手低温胁迫后明显上调的6-C30高度同源于拟南芥逆境中高表达的Rhodanesedomain。植物在低温胁迫下容易积累有毒的中间物质,硫氰酸酶能够减少其中氰化物对植株造成的伤害。
8-6-39-1同源于拟南芥缺铁激发的病原无毒蛋白(Avirulence protein, Avr)基因,此基因的作用机制是与抗性基因R(Resistance gene, 简称R基因)相互识别、结合而作用从而增加植物对胁迫环境的适应性。具体作用机制是R基因的受体蛋白识别特定的avr基因产物,从而激发含有蛋白激酶的信号传递,诱导植物抗性表达[19]。
转座酶(Ac-like transposase protein)和逆转座子蛋白(Retrotransposon-like protein)都被认为和植物的胁迫抗性有一定关系,7-6-42同源于拟南芥的Ac-liketransposase,3-G17同源于水稻的Retrotransposon-like,它们在佛手低温胁迫后表达量都明显增加。转座酶与抗病基因核糖体蛋白S5(RPS5)有一定关系[20],而逆转座子蛋白与水稻[21]、小麦[22]、玉米[23]和烟草[24]抵御冷害逆境有关,表明佛手在逆转座子基因功能性上与其它作物在这个方面具有一定的共性。
植物受病原物侵染时常产生一些发病相关蛋白(Pathogenesis-related Proteins,简称PR蛋白)进行抵御,β-1,3-葡聚糖酶(β-1,3-glucanase)即是其中之一[25]。3-G15 98%同源于受乙烯胁迫的甜橙中分离鉴定的β-1,3-glucanase[26],同时81%同源于受寒冷胁迫诱导的“Fortune”柑橘(克莱门氏小柑橘x酸桔)中分离鉴定的β-1,3-glucanase[27]。β-1,3-glucanase在佛手低温胁迫后表达量明显增加,它的增加能加速β-1,3-葡聚糖的水解[28],水解的寡糖产物被认为是植物防御反应的重要激发子。
3.3 细胞壁代谢相关基因
佛手低温胁迫下获得的差异片段中,有3个片段的功能与细胞壁组分和细胞壁代谢相关,它们通过增厚细胞壁、调整细胞壁的成分,从而增加佛手对低温的耐受能力,其对应功能是:纤维素合酶(Cellulose synthase protein)、伸展蛋白(Extensin-like protein)、葡聚糖转葡糖苷酶(Xyloglucanendotransglycosylase,XET)。
纤维素和伸展蛋白是植物细胞壁的主要组成成分,7-6-5和7-6-33-1高度同源于拟南芥的Cellulosesynthase和Extensin-like,这2个基因在佛手低温胁迫后表达量的都增加。可以被认为是在受到低温胁迫时,佛手通过加强细胞壁合成能力,加厚细胞壁来抵御低温对它的伤害,同时提高其抵御寒冷的能力[29]。同时佛手的伸展蛋白基因100%同源于香橼在病毒胁迫下获得cDNA片段[30],此片段在病毒胁迫后香橼中也是上调表达,伸展蛋白的积累量与细胞经胁迫后受到的伤害程度呈正相关[31],这也在一定程度上证明了佛手抗寒性低在-4℃的低温下细胞已经受到伤害[32]。
7-3-29与拟南芥的Xyloglucanendotransglycosylase高度同源,XET能够改变植物细胞壁主要成分,因此在形态学发生和组织形成过程中起着至关重要的作用[33]。拟南芥中存在着XET基因家族,其中TCH4能够迅速的对低温进行反应,通过增加TCH4的表达量调整植物细胞壁的成分、细胞大小、形状,从而增加对低温的抗性。
3.4 抗氧化性相关基因
细胞的抗氧化能力与植物的抗寒性呈正相关的。植物遭遇低温胁迫或经历低温锻炼其实都是经历一个氧化胁迫的过程。低温下由于植物对O2的利用能力降低,多余的O2能在代谢过程中被转化成对植物有毒害作用的活性氧。故过剩的O2对需O2生物有潜在毒性,必须通过植物抗氧化系统及时清除。
8-3-10同源于过氧化物酶(POD)基因,并在佛手低温胁迫后基因表达量增加。这说明低温对POD有一定诱导作用,而低温诱导产生的POD一定程度缓解了植物氧化性伤害;但随氧化程度的加重,植物细胞受到伤害加重甚至死亡,这些抗氧化酶合成的量也将逐渐降低并最终失活。
硫氧还蛋白(Thioredoxin family protein)在维持细胞氧化还原平衡上起着重要作用[34],8-4-29-3同源于拟南芥的thioredoxinfamily。硫氧还蛋白M1型基因AtTRX m1与生物环境胁迫有一定的相关性,尤其在逆境胁迫引起的氧化胁迫中,蛋白质中半胱氨酸残基易被活性氧氧化,在蛋白质分子内或分子间形成较稳定的二硫键(—S—S—),这些被氧化半胱氨酸残基能为TRX系统还原,从而恢复其功能,除此之外,Trx还直接或间接调控植物抗氧化保护酶系统的活性[35],因此,本研究中TRX的上调表达能够增强植物对逆境的耐受力。
3.5 其他重要功能基因
6-C22高度同源于拟南芥的ATP-binding转运体(ABC)基因,从半定量结果来看,佛手的ABC 转运体基因在低温胁迫后表达量明显上调。Moussatova等[36]认为ABC 转运体是一种整合的膜蛋白,可以在有ATP的前提下把细胞所产生的毒素和异生素转运出细胞外[37-38]。而从植物适应胁迫环境是一个需要 ATP的过程来推测,循环电子传递或叶绿体呼吸电子传递可能会提供额外的ATP 以适应低温胁迫下一些耗能的反应[39-40]。低温胁迫下ABC 转运体的表达量增加,佛手可供给的ATP的增加,从而对低温胁迫下的佛手起保护作用。
1-C1同源于亚精胺/腐胺转运通透酶potB基因,在低温胁迫后表达量增加。多胺广泛存在于生物细胞中,是一类低分子脂肪含氮物,多胺与植物的抗逆性关系密切,包括水分胁迫、温度胁迫和盐胁迫。在逆境胁迫下,植物细胞内多胺含量及合成酶的活性显著上升,所以用于转运多胺的通透酶的量也将上升,以提高对增加的亚精胺和腐胺的转运能力[41]。
综上所述,佛手受低温胁迫时有一个复杂的生理和分子调控下的抵抗机制。低温胁迫下,有大量相关基因表达或差异表达,根据基因功能分析,其中与植物逆境应答和光合作用有关的基因的下调表达可能是造成佛手寒敏感的主要原因。要找到佛手寒敏感机制的关键基因及信号传导机制还有待于更深入和广泛的研究。
[1] Zhang C K, Lang P, Dane F, Ebel R C, Singh N K, Locy R D, Dozier W A. Cold acclimation induced genes of trifoliate orange (Poncirustrifoliata). Plant Cell Reports, 2005, 23(10/11): 764-769.
[2] Hughes M A, Dunn M A. The molecular biology of plant acclimation to low temperature. Journal of Experimental Botany, 1996, 47(3): 291-305.
[3] Weiser C J. Cold resistance and injury in woody plants. Science, 1970, 169(3952): 1269-1278.
[4] Chen X B, Zhang A P, Yao Q H. Advances in researches on Gene engineering of plant for cold resistance. Biotechnology Information, 2001, (4): 14-20.
[5] Guo W D, Zhang Z Z, Jiang X W, Chen M G, Zheng J S, Chen W R. Semilethal temperature of Fingered Citron (Citrusmedicavar.sarcodactylisSwingle) under low temperature stress and evaluation on their Cold Resistance. Acta Horticulturae Sinica, 2009, 36(1): 81-86.
[6] Cao Y B, Shi R, Chen W R, Guo W D. Comparative analysis of expression changes of ethylene response factor 6(ERF6) in Fingered Citron and Trifoliate Orange under cold stress. Acta Horticulturae Sinica, 2011, 38(10): 1873-1882.
[7] Shi R, Cao Y B, Chen W R, Guo W D. On cDNA cloning and expression analysis of GRAS gene in Fingered Citron. Journal of Zhejiang Normal University: Natural Sciences, 2011, 34(4): 446-451.
[8] Sanchez-Ballesta M T, Lafuente M T, Zacarias L, Granell A. Involvement of phenylalanine ammonia-lyase in the response of Fortune mandarin fruits to cold temperature. Physiologia Plantarum, 2000, 108(4): 382-389.
[9] Downton J, Slatyer R O. Temperature dependence of photosynthesis in cotton. Plant Physiology, 1972, 50(4): 518-522.
[10] Shi X B, Wei J M, Shen Y G. Insights into the subunit interactions of the chloroplast ATP synthase. Chinese Science Bulletin, 2002, 47(1): 58-62.
[11] Cheeseman J M. Mechanisms of salinity tolerance in plants. Plant Physiology, 1998, 87(3): 547-550.
[12] Pang Q, Hays J B, Rajagopal I, Schaefer T S. Selection ofArabidopsiscDNAs that partially correct phenotypes ofEscherichiacoliDNA-damage-sensitive mutants and analysis of two plant cDNAs that appear to express UV-specific dark repair activities. Plant Molecular Biology, 1993, 22(3): 411-426.
[13] Lloyd R G. Conjugational recombination in resolvase-deficient ruvC mutants ofEscherichiacoli K-12 depends on recG. Journal of Bacteriology, 1991, 173(17): 5414-5418.
[14] Breusing N, Grune T. Regulation of proteasome-mediated protein degradation during oxidative stress and aging. Biological Chemistry, 2008, 389(3): 203-209.
[15] Fu H, Girod P A, Doelling J H, van Nocker S, Hochstrasser M, Finley D, Vierstra R D. Structure and functional analysis of the 26S proteasome subunits from plants. Plant Molecular Biology Reporter, 1999, 26(7): 137-146.
[16] Lommel L, Chen L, Madura K. The 26S proteasome negatively regulates the level of overall genomic nucleotide excision repair. Nucleic Acids Research, 2000, 28(24): 4839-4845.
[17] Peng Z H, Staub J M, Serino G. The cellular level of PR500, a protein complex related to the 19S regulatory particle of the proteasome, is regulated in response to stresses in plants. Molecular Biology of the Cell, 2001, 12(2): 383-392.
[18] Picton R, Eggo M C, Merrill G A, Langman M J S, Singh S. Mucosal protection against sulphide: importance of the enzyme rhodanese. Gut, 2002, 50(2): 201-205.
[19] Lamb C J, Zhang D P. A ligand-receptor mechanism in plant-pathogen recognition. Science, 1996, 274(5295): 2038-2039.
[20] Holt B F, Belkhadir Y, Dangl J L. Antagonistic control of disease resistance protein stability in the plant immune system. Science, 2005, 309(5736): 929-932.
[21] Zhang S, Gu Y Q, Singh J, Coleman-Derr D, Brar D S, Jiang N, Lemaux P G. New insights intoOryzagenome evolution: high gene colinearity and differential retrotransposon amplification. Plant Molecular Biology, 2007, 64(5): 589-600.
[22] Ansari K I, Walter S, Brennan J M, Lemmens M, Kessans S, McGahern A, Egan D, Doohan F M. Retrotransposon and gene activation in wheat in response to mycotoxigenic and non-mycotoxigenic-associatedFusariumstress. Theoretical and Applied Genetics, 2007, 114(5): 927-937.
[23] Steward N, Ito M, Yamaguchi Y, Koizumi N, Sano H. Periodic DNA methylation in maize nucleosomes and demethylation by environmental stress. Journal of Biological Chemistry, 2002, 277(40): 37741-37746.
[24] Mhiri C, Morel J B, Vernhettes S, Casacuberta J M, Lucas H, Grandbastien M A. The promoter of the tobacco Tnt1 retrotransposon is induced by wounding and by abiotic stress. Plant Molecular Biology, 1997, 33(2): 257-266.
[25] Thimmapuram J, Korban S S. Characterization and expression of β-1, 3-glucanase genes in peach. Molecular Genetics and Genomics, 2001, 265(3): 469-479.
[26] McCollum T G, Doostdar H, Burkhart M D, Neidz R P, Mayer R T, McDonald R E. Biochemical and molecular characterization of a β-1, 3-endoglucanase from Valencia Orange Callus. HortScience, 1996, 31(4): 614-614.
[27] Sanchez-Ballesta M T, Gosalbes M J, Rodrigo M J, Granell A, Zacarias L, Lafuente M T. Characterization of a β-1, 3-glucanase from citrus fruit as related to chilling-induced injury and ethylene production. Postharvest Biology and Technology, 2006, 40(2): 133-140.
[28] Domingo C, Conejero V, Vera P. Genes encoding acidic and basic class III β-1, 3-glucanases are expressed in tomato plants upon viroid infection. Plant Molecular Biology, 1994, 24(5): 725-732.
[29] Nogueira F T S, De Rosa V E Jr, Menossi M, Ulian E C, Arruda P. RNA expression profiles and data mining of sugarcane response to low temperature. Plant Physiology, 2003, 132(4): 1811-1824.
[30] Tessitori M, Maria G, Capasso C, Catara G, Rizza S, de Luca V, Catara A, Capasso A, Carginale V. Differential display analysis of gene expression in Etrog citron leaves infected byCitrusviroidIII. Biochimica et Biophysica Acta (BBA) -Gene Structure and Expression, 2007, 1769(4), 228-235.
[31] Ding B L, Tan H H, Zhu S Q. Advances on research of the relationship between stresses and plant cell wall. Journal of Guangxi Academy of Sciences, 2001, 17(2): 87-90.
[32] Weiser R L, Wallner S J, Waddell J W. Cell wall and extensin mRNA changes during cold acclimation of pea seedlings. Plant Physiology, 1990, 93(3): 1021-1026.
[33] Purugganan M M, Braam J, Fry S C. The Arabidopsis TCH4xyloglucan endotransglycosylase (Substrate specificity, pH optimum, and cold tolerance). Plant Physiology, 1997, 115(1): 181-190.
[34] Borutova R, Faix S, Placha I, Gresakova L, Cobanova K, Leng L. Effects of deoxynivalenol and zearalenone on oxidative stress and blood phagocytic activity in broilers. Archives of Animal Nutrition, 2008, 62(4): 303-312.
[35] Cavalca L, Guerrieri N, Colombo M, Pagani S, Andreoni V. Enzymatic and genetic profiles in environmental strains grown on polycyclic aromatic hydrocarbons. Antonie van Leeuwenhoek, 2007, 91(4): 315-325.
[36] Moussatova A, Kandt C, O′Mara M L, Tieleman D P. ATP-binding cassette transporters in Escherichia coli. Biochimica et Biophysica Acta, 2008, 1778(9):1757-1771.
[37] Hannivoort R A, Dunning S, Vander B S, Schroyen B, Woudenberg J, Oakley F, Buist-Homan M, van den Heuvel F A, Geuken M, Geerts A, Roskams T, Faber K N, Moshage H. Multidrug resistance-associated proteins are crucial for the viability of activated rat hepatic stellate cells. Hepatology, 2008, 48(2): 624-634.
[38] Lu H, Klaassen C. Gender differences in mRNA expression of ATP-binding cassette efflux and bile acid transporters in kidney, liver, and intestine of 5/6 nephrectomized rats. Drug Metabolism and Disposition, 2008, 36(1): 16-23.
[39] Locher K P. Structure and mechanism of ABC transporters. Current Opinion in Structural Biology, 2004, 14(4): 426-431.
[40] Toyoda Y, Hagiya Y, Adachi T, Hoshijima K, Kuo M T, Ishikawa T. MRP class of human ATP binding cassette (ABC) transporters: historical background and new research directions. Xenobiotica, 2008, 38(7/8): 833-842.
[41] Wu S G, Ren X P. The relationship between Plant polyamine and several adverse stress. Journal of Shangqiu Vocational and Technical College, 2005, 4(2): 58-59.
参考文献:
[4] 陈香波, 张爱平, 姚泉洪. 植物抗寒基因工程研究进展. 生物技术通报, 2001, (4): 14-20.
[5] 郭卫东, 张真真, 蒋小韦, 陈民管, 郑建树, 陈文荣. 低温胁迫下佛手半致死温度测定和抗寒性分析. 园艺学报, 2009, 36(1): 81-86.
[6] 曹诣斌, 石瑞, 陈文荣, 郭卫东. 低温胁迫下佛手和枳乙烯应答因子6(ERF6)表达变化的比较分析. 园艺学报, 2011, 38(10): 1873-1882.
[7] 石瑞, 曹诣斌, 陈文荣, 郭卫东. 佛手GRAS基因的克隆及表达分析. 浙江师范大学学报: 自然科学版, 2011, 34(4): 446-451.
[10] 石晓冰, 魏家绵, 沈允钢. 叶绿体ATP合酶CF1与CF0亚基间的相互作用. 科学通报, 2001, 46(18): 1550-1554.
[31] 丁宝莲, 谈宏鹤, 朱素琴. 胁迫与植物细胞壁关系研究进展. 广西科学院学报, 2001, 17(2): 87-90.
[41] 吴诗光, 任雪平. 植物多胺与几种逆境胁迫的关系. 商丘职业技术学院学报, 2005, 4(2): 58-59.
