中药泽泻对小鼠前体脂肪细胞3T3-L1细胞增殖及凋亡的影响
2013-12-23潘开瑞刘卫红
潘开瑞 刘卫红
(1.河南中医学院第一附属医院制剂室 河南郑州 450000;2.河南中医学院第一附属医院中心实验室 河南郑州 450000)
随着人民生活水平的提高和生活方式的改变,肥胖已成为多发病和影响人类健康的危险因素之一,成为迫切需要解决的问题。脂肪组织包含脂肪细胞、前脂肪细胞、巨噬细胞、成纤维细胞、内皮细胞和平滑肌细胞,脂肪组织分泌的50余种生物活性分子统称为脂肪因子。这些脂肪因子通过自分泌、旁分泌、内分泌作用方式,形成代谢-神经内分泌-免疫网络。当机体长期处于能量过度摄入状态时,脂肪组织在其体积增大的同时,分泌各种脂肪因子参与代谢综合征各组分如胰岛素抵抗、2型糖尿病、血脂紊乱、高凝状态等的发生,并可直接作用于血管,促发动脉粥样硬化的发生、发展[1,2]。
充分理解脂肪因子功能,治疗才能更加有效和明确,中医药以整体观辨证论治,防治结合,更符合减肥基本原则,临床应用泽泻治疗肥胖症,取得了较好的临床疗效,本实验通过观察其对体外培养的前体脂肪细胞增殖以及凋亡的影响,以期揭示其治疗单纯性肥胖疗效产生的分子机制,为减肥中药推广应用提供理论依据。
1 材料
(1)细胞株:3T3-L1细胞株购自中科院上海细胞所。(2)试剂:RPMI1640培养基,胰蛋白酶、胎牛血清,SDS(十二烷基硫酸钠)、EDTA(乙二胺四乙酸),96孔细胞培养板;吖啶橙。(3)仪器:Milli-Q型超纯水仪(美国Milipore公司),CK40倒置显微镜(日本Olympus公司),CO2细胞培养箱(美国Thermo公司),荧光显微镜BX41。(4)试药:泽泻购自河南中医学院第一附属医院药房,水煮提取,高压灭菌,4℃备用。
2 方法
2.1 3T3-L1细胞培养及实验分组
细胞在含有100IU·L-1青霉素和100μg·mL-1链霉素、10%胎牛血清(FBS)的RPMI1640培养基,37℃、5% CO2条件下培养。实验细胞分为正常对照组,不同浓度泽泻(0.001-10mg/ml)组。
2.2 细胞形态学观察
将对数生长期细胞调制成密度约1×105·mL-1的细胞悬液,加入96孔板,每孔100μL,37℃、5% CO2条件下培养24h,待细胞贴壁后,更换无血清培养基,加入不同浓度的泽泻(0.001-10mg/ml),倒置显微镜下观察,同时记录细胞生长的形态学变化。
2.3 AO/EB染色法检测细胞凋亡
根据MTT实验结果,选取10mg/ml组作为刺激组。在6孔培养板中预先置入玻璃盖玻片,接种细胞悬液,10mg/ml泽泻干预后,予95%乙醇固定15分钟,微干,然后准备荧光染色。将100mg/L溶于PBS的吖啶橙和100mg/L溶于PBS的溴化乙锭各5μl在照相前混匀后加入,轻轻吹打,30秒后用荧光显微镜观察照相。观察正常对照组和10mg/ml泽泻组凋亡情况。
3 结果
3.1 泽泻对前体脂肪细胞增殖的影响
结果如图1所示,不同浓度的泽泻作用于前体脂肪细胞24小时候,细胞增殖发生变化,各组间细胞活性比正常组降低,且10mg/ml组与对照组相比,差异具有统计学意义。(图1)
3.2 凋亡形态学改变
结果图2所示,光镜下可见细胞贴壁生长,长梭形,经过AO/EB染色后,胞核为均一,均质的绿色荧光,经过中药刺激组可见细胞核边聚,固缩,可见溴乙啶染色的橙黄色荧光。(图2)
4 讨论
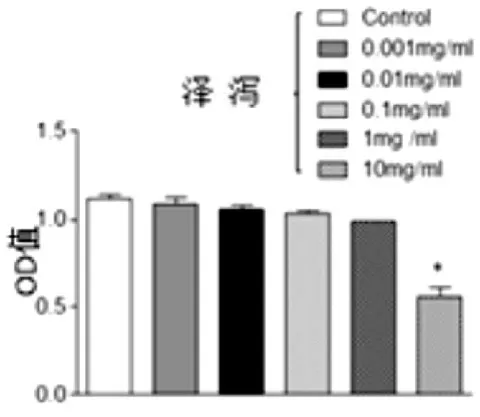
图1 不同浓度泽泻作用于前体脂肪细胞的细胞的MTT增殖活性(0.001-10mg/ml)
流行病学研究表明,我国青少年单纯性肥胖症已处于失控的奇高状态。脂肪组织被认为不仅是能量储存器官,而且是功能活跃的内分泌器官。脂肪因子在代谢综合征的发生、发展过程中起重要作用,尤其是肥胖时内脏脂肪组织分泌的促炎症脂肪因子可直接导致胰岛素抵抗和血管损伤,等[3,4]。基于脂肪因子为药物靶点的减肥防治策略已成为比较关注的方向。临床中许多中草药在治疗肥胖中具有较好的疗效,因此,中药成分对肥胖的作用已成为关注的热点[5]。

图2 前体脂肪细胞的凋亡形态学改变:A,B,C组为正常对照组的光镜照片,D,E,F组为正常组染色结果;G,H,I组为刺激组的染色结果
本实验结果显示,不同浓度的泽泻(0.001-10mg/ml)作用前体脂肪细胞24h使细胞增殖活性下降,能够明显抑制细胞的增殖,并且呈现剂量依赖性,10mg/ml组与正常对照组相比差异具有统计学意义(P<0.05)。提示泽泻有可能具有抑制细胞增殖作用。
细胞正常情况和早期凋亡情况下,细胞核染色亚啶橙染色,当细胞处于晚期凋亡时候,溴乙啶染色细胞核。AO/EB凋亡染色结果显示,正常组细胞细胞核亚啶橙染色,而10mg/ml的泽泻作用后细胞核溴乙啶着色。这与MTT结果相吻合,提示泽泻可能通过抑制细胞增殖并诱导凋亡来做用于前体脂肪细胞。这可能为中药减肥药物的作用机理提供一定的理论依据。之后的实验还将从脂肪因子相关基因及其蛋白表达活性进一步阐述泽泻对前体脂肪细胞作用的机理。
[1]路玲玲,宰军华,崔琳,李强,张莎莎,金小琴.人脂联素基因启动子荧光素酶报告基因载体的构建[J].世界科学技术——中医药现代化,2013,15(1):55-61.
[2]崔琳,李强,路玲玲,宰军华,张莎莎.脂联素调控序列荧光素酶报告基因荧光素酶活性的分析[J].中国实验方剂学杂志.2013,19(6):211-215.
[3]岳杉,耿厚法,班博.BRL37344对3T3-L1脂肪细胞脂肪分解与脂肪因子表达的影响[J].山东医药,2012,52(17):10-12.
[4]岳晶晶,周芹,何庆等.不同频率间歇低氧对3T3-L1脂肪细胞炎症因子和脂肪因子的影响[J].天津医药,2012,40(4):308-311.
[5]孙阳,陈树春.内皮祖细胞与脂肪因子[J].中国老年学杂志,2012,32(6):1312-1314.
