白斑综合征病毒对脊尾白虾的致病性研究
2013-12-23万夕和王李宝费荣梅
沈 辉 , 万夕和 王李宝 费荣梅, 李 淑, 柏 玲, 凌 云 黎 慧 高 波
(1. 江苏省海洋水产研究所, 江苏 南通 226007; 2. 上海海洋大学, 上海 201306; 3. 南京农业大学, 江苏 南京 210095)
自20世纪90年代以来, 白斑综合征病毒给全球对虾养殖业造成了巨大的经济损失[1]。在已报道的研究中, 该病毒可感染并致死多个对虾种类, 如中国对虾(Penaeus chinensis)[2-4]、南美白对虾(Penaeus vannamei)[5]、斑节对虾(Penaeus mondom)[6-8]等一些重要对虾经济养殖品种。
脊尾白虾又称小白虾, 是中国特有的经济虾类之一[9]。近年来, 由于味道鲜美, 养殖效益较高, 脊尾白虾的养殖规模面积迅速扩大。但随着养殖密度的不断增大, 其病害问题开始日益凸显。目前, 对脊尾白虾的研究报导主要集中在生物学[10]及繁殖育种学[11]方面, 而脊尾白虾疾病的研究工作相对较少, 吴友吕等[12]通过电子显微镜的观察发现浙江发病的脊尾白虾体内存在一种杆状病毒, 雷质文[13]等在对WSSV进行研究时认为脊尾白虾是WSSV的宿主之一。2010年、2011年江苏沿海多数地方海水养殖中发生了脊尾白虾大规模死亡的现象, 本课题组通过对大量发病样品进行病毒检测分析发现, 发病样品中白斑综合征病毒感染率为100%。另外, 通过感染试验, 进一步研究了白斑综合征病毒对脊尾白虾的感染特性和致病性。
1 材料与方法
1.1 发病虾的分析
发病脊尾白虾取自江苏南通东凌养殖场、江苏大丰裕华滩养殖场等。取10只发病虾的鳃丝、肝 胰脏、肌肉、肠道等组织器官, 提取DNA或RNA模板后进行WSSV、桃拉病毒(TSV)及传染性皮下及造血组织坏死病毒(IHHNV)的检测, 采用的引物序列见表1。

表1 对虾病毒检测引物及检测结果 Tab. 1 The primers for testing virus in shrimp and the test results
1.2 WSSV对脊尾白虾的感染试验
1.2.1 实验条件
实验在江苏省海水增养殖技术及种苗中心进行。实验用海水为天然海水, 海水相对比重为1.021, pH为 7.8~8.3, 海水经沙滤及暗沉淀后备用, 实验用小水泥池容积为2 m3, 24 h充气, 每天换水1次, 换水量为80%。
1.2.2 实验用虾
发病虾: 2011年8月在江苏南通东凌养殖场发病池塘采取, 部分病虾个体现场取其鳃、肝胰脏、肠道等组织器官固定, 部分样品放干冰带回实验室-70℃感染实验及鉴定备用。
健康虾: 2011年9月在江苏省海洋水产研究所繁殖育种基地采取, 选择体表干净, 活力强, 体长(5±0.5)cm, 体质量(2.3±0.3)g, 肢体健全个体进行WSSV、TSV及IHHNV的检测, 检测结果为阴性样品作为感染实验用虾。
1.2.3 人工注射感染
病毒粗提液的制备按谢数涛[14]等的方法并进行部分调整后对病虾体内WSSV进行粗提。取体表发红、显微观察甲壳带有白斑且PCR扩增为阳性的濒死病虾, 在冰浴下剪碎, 按0.1 g组织加入1 mL TN缓冲液(pH 7.4), 于匀浆器中匀浆, 将匀浆液以3 500 r/min离心15 min, 弃沉淀, 将上清液经0.45 µm孔径滤膜过滤, 过滤后液体即为病毒粗提液。
取健康虾进行试验分组, 分别为空白组、注射生理盐水组、注射病毒液组, 各组设立平行A组和B组, 注射剂量为0.2 mL。每个小水泥池养殖100尾脊尾白虾进行观察实验。每天监测各组虾的生理状态, 并记录各组死亡个数, 并收集濒死虾固定后, 进行超微细胞病理观察。另外, 每天取对照组、注射生理盐水组及注射病毒液组5只死亡虾(未死亡或死亡不足5只时取同样设置组补足数量)进行WSSV的病毒检测, 检测方法同上。
2 结果
2.1 脊尾白虾发病特征
江苏南通东凌海水养殖场以及大丰裕华滩海水养殖场于2011年8月和2011年9月分别发生了脊尾白虾大量死亡现象。发病虾(图1)表现为反应迟钝, 沿池塘四周慢慢游动; 摄食量减少, 甚至不摄食。虾体发红, 胃肠空虚(图1-1), 甲壳易于剥落, 甲壳部白斑肉眼观察不明显, 对头胸甲及尾部甲壳显微观察可见明显白斑(图1-2)。

图1 发病脊尾白虾 Fig.1 The infected shrimp
2.2 发病虾WSSV、TSV、IHHNV等相关病原检测结果
应用分子生物学手段对3种常见虾类病毒进行了检测, 结果发现, 所有的样品中, WSSV的检测率为100%, 而TSV和IHHNV检出率都为0, 详细结果见表1。在WSSV检测过程中, 虽然有20%的样品仅第一对引物检测为阴性, 但第二对引物检测表现为阳性, 此类样品的WSSV检测结果仍应判为阳性。
2.3 WSSV对脊尾白虾的致病性
感染实验进行过程中, 注射病毒粗提液组在感染实验进行第2天后就出现摄食量减少, 部分虾离群在水面上独游, 游动时失去平衡, 部分虾长卧池底对外界刺激反应减弱。感染实验第3天, 注射病毒组部分虾失去摄食行为, 身体发红, 游动靠边, 注射生理盐水组也有个别死亡。在第4天注射病毒组出现了死亡, 随后死亡个数逐渐增加, 死亡高峰出现在第8天, 14 d后注射病毒组感染实验总累积死亡率达到68.5%, 死亡个体表现为游动缓慢, 不摄食, 通体微红, 头胸甲部在显微观察下有白色斑点。
应用分子生物学方法对感染后的发病个体以及死亡个体都进行了检测, 结果发现, 所有的发病及死亡个体虾都能检出WSSV。

表2 脊尾白虾人工感染病毒死亡统计及病毒检测结果 Tab. 2 The mortality of artificial infected Exopalaemon carinicauda Holehuis and virus test results
2.4 病毒电镜观察
对健康虾、发病虾及感染虾的鳃、肝胰脏及肠道组织器官细胞切片观察发现, 健康虾的细胞核形态正常, 核膜与核孔结构清晰, 线粒体、内质网及微管等器官形态正常, 未见明显的病毒粒子和其他病原(图2-1)。在发病虾与感染实验病虾的各组织器官的细胞核出现肿胀, 染色质消失(图2-2); 线粒体变圆, 内嵴消失, 甚至出现空泡化等一系列的细胞病理变化(图2-2, 2-3)。另外, 在各组织器官的细胞核与细胞质中都发现了大量的杆状病毒, 病毒粒子大小约为(130~170)nm×(305~405)nm; 核衣壳呈子弹形, 一端较细而一端较粗, 完整病毒粒子由核心、衣壳和囊膜构成, 核心与核衣壳结合紧密, 囊膜为单位单层膜结构(图2-2, 2-3, 2-4)。
3 讨论
3.1 WSSV的致病性
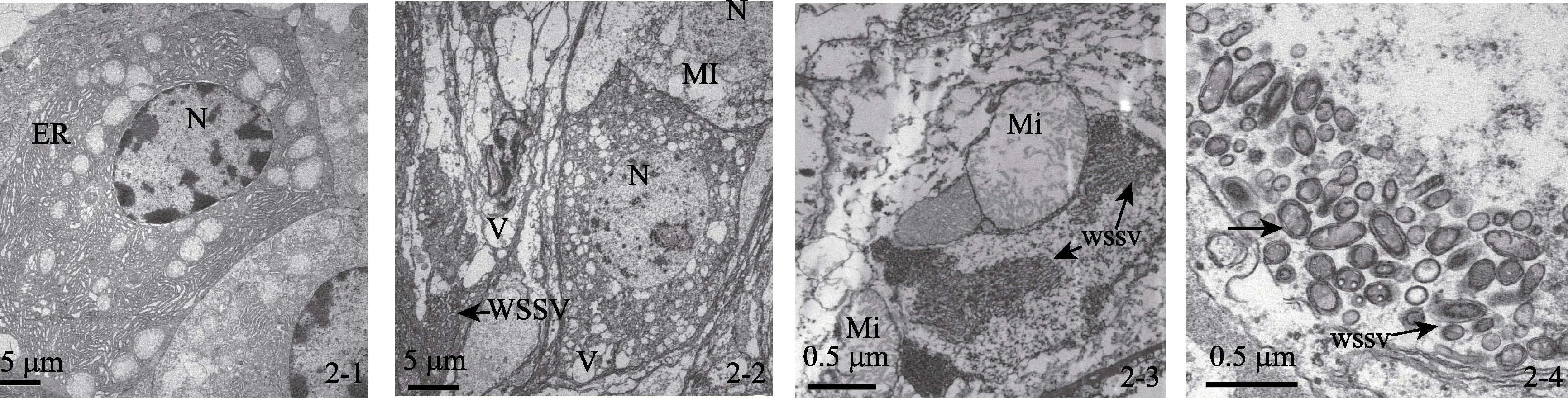
图2 WSSV感染下引起的细胞超微结构变化 Fig. 2 Changes of Exopalaemon carinicauda Holehuis cell ultrastructure induced by WSSV infection
作者通过对发病虾及其感染虾的体表症状、细胞病理、病毒分子生物学检测及病毒感染实验进行了WSSV对脊尾白虾的感染及致病性研究。首先, 体表症状表明, 池塘发病虾与感染虾死亡症状基本一致。其次, 在感染实验中, 将病毒粗提液最后通过滤膜过滤, 以避免其他病原因素, 如弧菌[18-19]、寄生 虫[20]等因素的影响, 结果显示, 感染虾出现了大量的死亡, 14 d累积死亡率达68.5%, 表明WSSV对脊尾白虾具有较强的致病性。再次, 对实验虾病毒分子 生物学检测发现, 发病虾及感染虾WSSV为阳性, TSV及IHHNV未检出, 由此可以排除其他两种病毒的可能性。最后, 对发病虾、健康虾及感染虾的细胞超微观察后, 发现WSSV健康虾的细胞形态正常, 在各组织器官的细胞质中未见WSSV粒子, 而发病虾与感染虾都出现了明显的病理变化, 且细胞病理变化相似, 在各组织器官的细胞质中还发现了大量的成熟或装配的WSSV粒子。以上实验结果符合柯赫氏法则, 作者认为, WSSV感染脊尾白虾并可以导致大规模的死亡。
3.2 脊尾白虾感染WSSV的特征与死亡率
WSSV感染甲壳类动物基本都会引起甲壳表皮细胞、鳃上皮细胞的组织器官坏死, 进而在寄主甲壳部分产生肉眼可见白色斑点, 如中国对虾[2]、斑节对虾[6]及克氏原螯虾(Cambarus proclarkii)[21]发病时甲壳带有的明显白斑。脊尾白斑感染WSSV死亡时身体发红, 甲壳部白色斑点肉眼不可见, 但剥离后在光镜下可见, 这与斑节对虾[7]的死亡特征有些类似, 正因为无明显白点和体表发红, 则很容易与TSV的感染[16]特征相混淆。WSSV对大部分虾类都是强致病性病毒, 据相关流行病学的研究报道, 该病毒可引起中国对虾、南美白对虾及斑节对虾等虾类80%以上的死亡率, 在实验条件下会更高。在作者的感染实验中脊尾白虾死亡率为68.5%, 而在野外自然池塘养殖条件下死亡率仅在30%~40%, 死亡率明显低于其他经济养殖虾类。另外, WSSV感染并引起脊尾白虾的死亡周期与其他虾类也有所不同。据WSSV流行病学研究报道, WSSV引起虾类的死亡一般在夏末秋初, 因池塘理化因子如温度[22]、溶解氧[23]、盐度[24]的剧变及多种病原因子如弧菌与病毒的共同作用毒力加倍下[25], 死亡率达到高峰。但作者对脊尾白虾流行病学调查后发现, 除夏末秋初的死亡高峰期外, 从春季开始就有零星死亡, 且进入秋末冬初气温较低时, 部分养殖池塘仍出现较高的死亡率。分析原因, 作者认为, 这与脊尾白虾的苗种获取方式有关, 脊尾白虾为抱卵孵化虾类, 目前苗种以种虾留池自繁的方式为主, 因此初步推断WSSV长期感染是因为病毒的垂直传播, 其传播机制正在研究中。
[1] Lightner D V, Revdman R M. Shrimp diseases and current diagnostic methods [J]. Aquaculture, 1998, 164: 201-220.
[2] Lo C F, Kou G H. Virus-associated white spot syndrome of syndrome in Taiwan: a review [J]. Fish Pathol, 1998, 33: 365-371.
[3] Chou H Y, Huang C Y, Wang C H, et al. Pathology of a baculovirus infection causing white spot syndrome in cultured penaeid shrimp in Taiwan [J]. Disease of Aquatic Organisms, 1995, 23: 165-173.
[4] 倢黄 , 宋晓玲, 于佳, 等.杆状病毒性的皮下及造血组织坏死对虾暴发性流行病的病原和病理学[J]. 海洋水产研究, 1995, 16(1): 1- 10.
[5] Boonyaratpalin S, Supamattaya K, Kasornchandra J, et al. Non-occluded baculo-like virus, the causative agent of yellow head disease in the black tiger shrimp [J]. Fish Pathol, 1993, 28(3): 103-109.
[6] Magbanua F O, Natividad K T, Migo V P, et al. White spot syndrome virus (WSSV) in culturedPenaeus mondomin the Philippines[J]. Disease of Aquatic Organisms, 2000, 42: 77-82.
[7] 翁少萍, 何建国, 钟慰, 等.斑节对虾白斑综合症杆状病毒致病性及组织细胞特异性研究[J].中山大学学报论丛, 1996, 增刊: 16-22.
[8] 张吕平, 胡超群, 任春华.对虾白斑杆状病毒(WSBV)对斑节对虾血液病理学研究[J].热带海洋, 2000, 19(3): 1-8.
[9] 李明云.池养脊尾白虾的繁殖、生长及其最大持续轮捕量的初步探讨[J].水产学报, 1994,18(2):85-92.
[10] 王兴强, 阎斌伦, 甡马 , 等.脊尾白虾生物学及养殖生态学研究进展[J].齐鲁渔业, 2005, 22(8):21-23.
[11] 徐加涛, 徐国成, 于斌, 等.脊尾白虾繁殖生物学及人工育苗生产技术[J].中国水产, 2007, 4:52-55.
[12] 吴友吕, 陈全震.脊尾白虾杆状病毒病研究[J].水产科技情报, 1995, 22(1):8-13.
[13] 雷质文, 倢黄 , 史成银, 等.白斑综合症病毒(WSSV)的宿主调查[J].海洋与湖沼, 2002, 33(3): 250-258.
[14] 谢数涛, 何建国, 闫庆生, 等.对虾白斑症病毒的分离纯化及形态结构观察[J].中山大学学报(自然科学版), 2000, 39(4): 90-93.
[15] Lo C F, Hsu H C, Tsai M F, et al. Specific genomic DNA fragment analysis of different geographical clinical samples of shrimp white spot syndrome virus[J]. DIS Aquat Org, 1999,35: 175-185.
[16] Nunan L M, Poulos B T, Lightner D V. Reverse transcription polymerase chain (RT-PCR) used for the detection of Taura Syndrome virus(TSV) in experimentally infected shrimp[J]. Dis Aquat Org, 1998, 34: 87-91.
[17] Nunan L M, Poulos B T, Lightner D V. Use of polymerase chain reaction (PCR) for the detection of infectious hypodermal and hematopoietic necrosis virus (IHHNV) in penaeid shrimp [J]. Mar Biotechnol, 2000,2: 319-328.
[18] 陈强, 鄢庆枇, 甡马 .溶藻弧菌致病性研究进展[J].海洋科学, 2006, 30(8):83-89.
[19] Alapide-Tendencia E V, Dureza L A. Isolation ofVibriospp.frompenaeus monodon(fabricius) with red disease syndrome[J]. Aquaculture, 1997, 154: 107-114.
[20] 许文军, 谢建军, 施慧, 等.池塘养殖脊尾白虾(Exopalaemon carinicauda)感染血卵涡鞭虫的研究[J]. 海洋与湖沼,2010, 3(41): 396-402.
[21] 丁正峰, 薛辉, 夏爱军, 等.白斑综合征病毒在养殖克氏原螯虾中感染流行研究[J]. 南京农业大学学报, 2008, 31(4): 129-133.
[22] Sung H. Characterisation of monoclonal antibodies to haemocyte subpopulations of tiger shrimp (Penaeus monodon): immunochemical differentiation of three major haemocyte types[J]. Fish & Shellfish Immunology, 1999, 9(3): 167-179.
[23] 刘发义, 赵鸿儒. 对虾养殖池中若干水质问题探讨[J].海洋科学, 1991, 15(3): 6-8.
[24] Hauton C, Hawkins L E, Hutchinson S. The effects of salinity on the interaction between a pathogen (Listonella anguillarum) and components of a host (Ostrea edulis) immune system[J]. Comp Biochem Physiol, 2000, 127: 203-212.
[25] Lee K K, Yang T I, Liu P C, et al. Dual chanllenges of infectious pancreatic necrosis virus and Vibrio carchariae in the grouper,Epinephelussp.[J]. Virus Research, 1999, 66: 131-134.
