羊栖菜不同分子质量褐藻多酚抗氧化活性研究
2013-12-23杨小青卢虹玉李延平
杨小青, 卢虹玉, 李延平, 刘 义
(1. 广东医学院 广东天然药物研究与开发重点实验室, 广东 湛江 524023; 2. 广东海洋大学 水产品加工广东普通高校重点实验室, 广东 湛江 524045)
羊栖菜(Sargassum fusiforme)是一种褐藻门马尾科植物, 多分布在我国沿海, 已有大规模人工养殖[1], 有较高的食用和药用价值, 是重要的经济海藻[2]。近年来, 随着海藻资源开发利用研究的不断发展, 羊栖菜因富含多糖、多酚、萜类等多种生物活性成分而引起了人们的关注。现代药理学研究表明, 羊栖菜及其提取物具有抗氧化、抗肿瘤、降血脂、降血糖等多种功效[3]。
研究发现羊栖菜含有较高的褐藻多酚(phlorotannin), 可占藻体干质量的2%, 仅次于海黍子[4]。褐藻多酚是主要存在于褐藻类植物中的一类独特的次生化合物, 其基本结构单元是间苯三酚[5]。研究表明, 羊栖菜褐藻多酚具有卓越的抗氧化和自由基清除能力[6-7]。由于越来越多的证据表明, 自由基参与许多疾病的病理过程, 从而诱发如心血管疾病、癌症、神经退行性等疾病[8]。因此,寻找天然来源的自由基清除剂和抗氧化剂对于该类疾病的防治具有重要意义。目前有关羊栖菜多酚的活性报道多限于粗提物, 未见进一步的研究[9-11]。本文对羊栖菜褐藻多酚(SFP)的粗提物进行了精制纯化, 并检测不同分子质量SFP馏分的体外自由基清除活性, 旨在寻找自由基清除效果好的SFP组分, 为羊栖菜的开发利用提供更详实的理论依据。
1 材料与方法
1.1 仪器和材料
1.1.1 仪器
SHZ-D()Ⅲ循环水式真空泵(巩义市予华仪器有限责任公司); EYELAN-1000旋转蒸发仪(TOKYO RIKAKIKAI CO.LTD JAPAN); DLSB-5/25低温冷却循环泵(河南斯泰仪器有限公司); SKY-1102C恒温培养摇床(上海苏坤); 电子天平BS210S(北京塞多利斯仪器系统有限公司); himacCRⅡ高速离心机(HITACHI); EYELA FDU-1100冷冻干燥仪(TOKYO RIKAKIKAI CO.LTD JAPAN); UV2550紫外分光光度(SHIMADZU)。
1.1.2 材料
羊栖菜购于浙江温州三丰水产食品有限公司; DPPH(1, 1-二苯基-2-三硝基苯肼)购于日本东京株式会社; VE、没食子酸(GA)、Vc均购于美国Sigma公司; 羟自由基与超氧阴离子试剂盒购于南京建成生物工程研究所, 其余试剂均为国产分析纯。
1.2 实验方法
1.2.1 不同分子质量羊栖菜褐藻多酚的制备
将所购羊栖菜阴干后用打粉机打磨成粉, 称取干粉480 g用80%甲醇按1 : 10室温浸提3次, 每次12 h, 旋转蒸发去除甲醇, 经正己烷、乙酸乙酯萃取后获得水相和乙酸乙酯相SFP提取物, 两相分别过截留分子质量为30 000、10 000及5 000的超滤膜包, 获得水相分子质量大于30 000(SFPW1)、10 000~ 30 000(SFPW2)、50 00~10 000(SFPW3)、小于 5 000(SFPW4)以及乙酸乙酯相分子质量大于 30 000(SFPO1)、10 000~30 000(SFPO2)、5 000~ 10 000(SFPO3)、小于5 000(SFPO4)共8个组分, 经冷冻干燥后留待备用。
1.2.2 多酚含量的测定
采用Folin-Ciocalteu法[12]测定各组分多酚含量。取10 mL棕色容量瓶, 加入1 mL样品, 2 mL Folin-Ciocalteu试剂摇匀, 2 min后加入12 mol/L的Na2CO3溶液6 mL, 混合充分后于暗处静置60 min, 于765 nm处测定吸光度。以GA为标准品制作标准曲线, 各组分多酚含量以其在羊栖菜总酚中所占质量百分数表示。
1.2.3 总抗氧化能力的测定
采用普鲁士蓝法[13]检测各组分的总抗氧化能力。取10 mL容量瓶, 加入样品1 mL, 去离子水 5 mL, 1 mol/L盐酸0.2 mL, 1%铁氰酸钾1.5 mL, 1%十二烷基硫酸钠(SDS)0.5 mL, 0.2%六水合三氯化铁0.5 mL, 定容至10 mL, 室温放置30 min后于750 nm处测定吸光度值。以GA为标准品制作标准曲线, 在同一浓度下(3 mg/L)比较Vc、VE及SFP在750 nm处吸光度。
1.2.4 DPPH清除率的测定
称取10 mg DPPH置于100 mL棕色容量瓶中, 用无水乙醇定容至100 mL, 配制成浓度为100 mg/L DPPH标准溶液。将GA、Vc、VE及SFP分别配制成不同的浓度梯度。取2 mL DPPH标准溶液, 加入2 mL 配制好的样品混匀反应60 min后, 以50% 乙醇为空白对照, 于527nm 处测吸光度值为A, 另取2 mL DPPH标准溶液加入2 mL去离子水按上法测吸光度值为A0, 清除率= (A0-A)/A0×100%。
1.2.5 羟自由基清除率的测定
将GA、Vc、VE及SFP分别配制成不同的浓度梯度, 以蒸馏水代替样品作空白按试剂盒说明进行操作, 测得吸光度值为A0, 测得样品吸光度值为A, 清除率=(A0-A)/A0×100%。
1.2.6 抗超氧阴离子自由基的测定
将GA、Vc、VE及SFP配制成40 mg/L的样品, 按试剂盒说明测得吸光度值为A, 蒸馏水代替样品测得吸光度值为A0, 清除率=(A0-A)/A0×100%。
2 结果
2.1 不同分子质量SFP含量
不同分子质量SFP含量结果如表1。各组分含量以其在羊栖菜提取物总酚中所占质量百分数表示。水相各组分多酚含量明显比乙酸乙酯相高, SFPW1含量最高, 两相中各组分多酚含量随着分子质量的降低而逐渐降低。

表1 不同分子质量SFP的含量 Tab. 1 Content of SFP with different molecular weight
2.2 不同分子质量SFP总抗氧化能力
在同一浓度3 mg/L下比较各组分的总抗氧化能力, 结果见图1。乙酸乙酯相各组分的总抗氧化能力均强于水相, 其中SFPO4总抗氧化能力最强, 相当于2.36 mg/L的GA, 强于VE及Vc; 除SFPW2外其余组分总抗氧化能力均介于Vc与GA之间。这样的结果表明羊栖菜可作为天然抗氧化剂的来源。
2.3 不同分子质量SFP对DPPH的清除率
不同分子质量SFP对DPPH的清除率及IC50值见表2。由表2可知各组分对DPPH的清除率均能达到平台期, 但与阳性对照比各组分对DPPH没有突出的清除能力。在20 mg/L浓度下比较各组分清除率发现SFPO1对DPPH清除能力最强, 清除率达到77.2%; SFPW3最弱, 清除率仅为50.2%。比较各组分清除50% DPPH所需浓度可知, SFPO1最低, 为10.1 mg/L, 优于VE; 其他组分均高于阳性对照, 其中SFPO4最高, 达到21.4 mg/L。
2.4 不同分子质量SFP对羟自由基的清除能力
不同分子质量SFP对羟自由基的清除率及IC50值见表3。由表3可见, 不同分子质量SFP对羟自由基的清除能力均好于阳性对照; 在20 mg/L浓度下, SFPO1与SFPO2对羟自由基清除能力相当, 清除率分别为77.6%和77.1%, SFPW2清除能力最弱, 清除率只有25.4%。由表3可知, 乙酸乙酯相对羟自由基的清除能力明显强于水相; SFPO1对羟自由基的清除能力最好, IC50为9.04 mg/L。
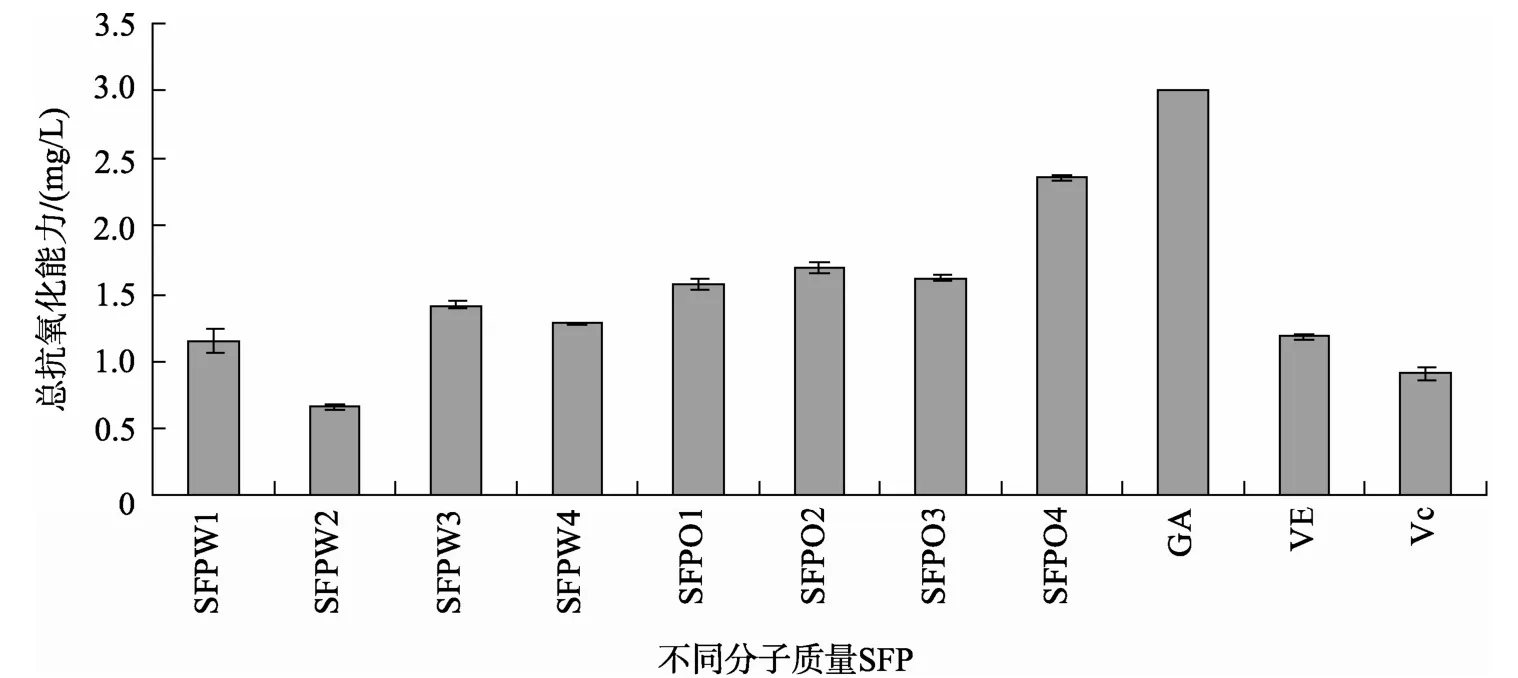
图1 3 mg/L浓度下不同分子质量SFP总抗氧化能力 Fig. 1 Total antioxidant capacity of SFP with different molecular weight at the concentration of 3 mg/L
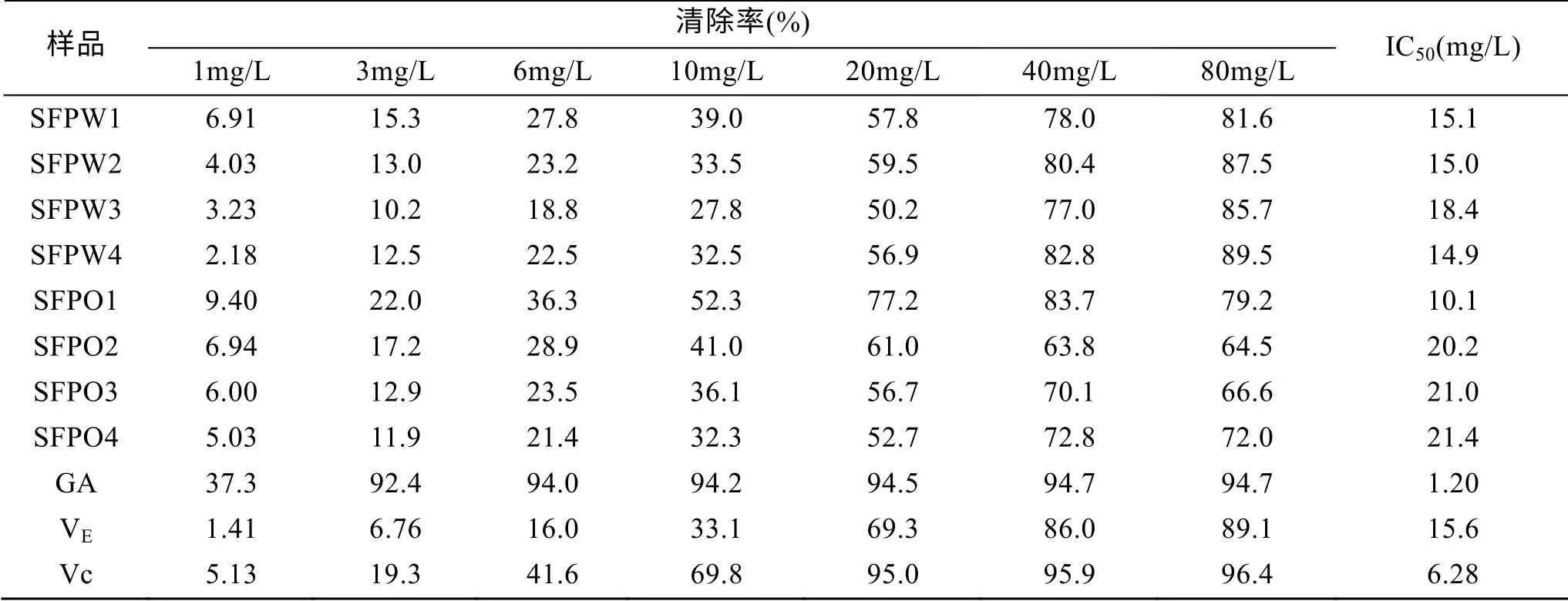
表2 不同分子质量SFP对DPPH的清除率及IC50值 Tab. 2 Scavenging effect and IC50 values of SFP with different molecular weight on DPPH
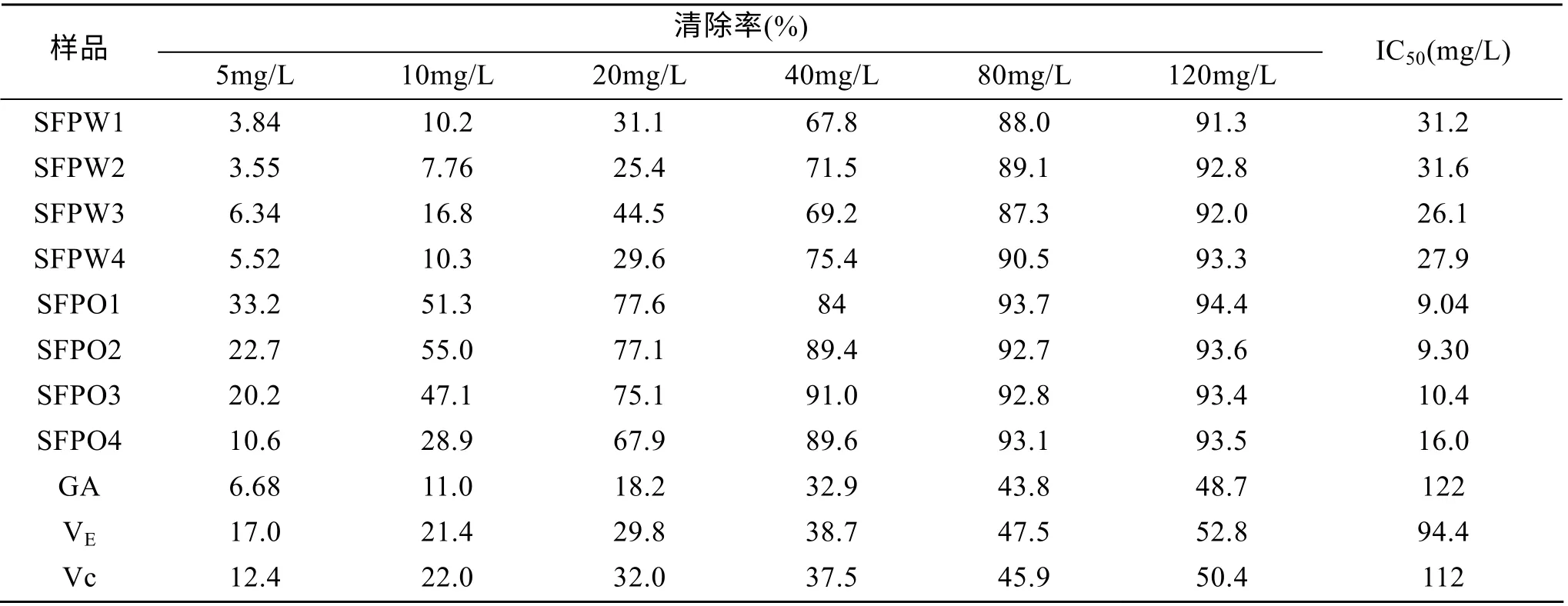
表3 不同分子质量SFP对羟自由基的清除率及IC50值 Tab. 3 Scavenging effect and IC50 values of SFP with different molecular weight on hydroxyl free radical
2.5 不同分子质量SFP抗超氧阴离子自由基的能力
在40 mg/L浓度下比较各组分对超氧阴离子自由基清除率结果见图2。乙酸乙酯相SFP对超阴离子的清除能力明显强于水相, 水相各组分对超氧阴离子清除能力无差别。SFPO1对超氧阴离子的清除能力最强, 强于阳性对照, 清除率达到18.6%; 其余组分均高于GA和Vc。
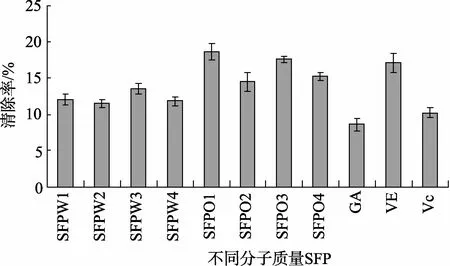
图2 40 mg/L浓度下不同分子质量SFP对超氧阴离子自由基的清除能力 Fig.2 Scavenging ability of SFP with different molecular weight on super anion radical at the concentration of 40 mg/L
3 分析与讨论
DPPH·是一类较为稳定的自由基, 属于芳香类自由基, 其较长的半衰期使该方法保持了良好的重现性, 应用DPPH进行定量分析简便、快速且不受葡萄糖等杂质的干扰[14]。因此, DPPH法是一种评价天然抗氧化剂氧化活性快速、简便、灵敏可行的方法, 在国内外应用广泛[15-16]。O2-·不仅自身具有毒性, 而且可以经过一系列反应生成其他活性氧自由基, 进一步对生物体产生损伤作用, 且停留时间较长。超氧阴离子自由基是生物活性最高的氧中心自由基之一, 它在生命过程和化学反应中作为电子受体, 形成不同的活性氧自由基链中的第一个自由基, 经过一系列反应生成其他的氧自由基[17]。在各种活性氧自由基中, 羟自由基的反应活性最强(二阶速率: 10-1010/M/S), 对机体危害最大, 因为·OH是仅次于F- 的强氧化剂, 几乎可以和所有的细胞组分(核酸、蛋白质和脂质等)发生反应[18]。可见这两种自由基具有较大的危害, 清除O2-·和·OH具有重要的意义。
实验中发现羊栖菜褐藻多酚主要以高分子质量形式存在, 而这与褐藻多酚结构的特点有关。魏玉西等[5]在报道中提到, 褐藻多酚中间苯三酚连接方式及单体数量的不同, 导致了褐藻多酚化合物的结构差异, 酚羟基的还原性是酚类化合物的共性之一,故Folin-Ciocalteu法中磷钼酸和磷钨酸被还原的程度不同而颜色不同, 所得样品含量亦有差异, 而这都与样品的结构密切相关, 高分子质量褐藻多酚以间苯三酚单体多聚形成, 能作为氢供体的酚羟基比低分子质量褐藻多酚多, 测得的高分子质量褐藻多酚含量高。
对所得SFP 8个组分总抗氧化能力及对DPPH、羟自由基、超氧阴离子自由基清除能力的检测研究后发现, SFPO1的综合抗氧化活性最好, 甚至对羟自由基与超氧阴离子的清除能力强于没食子酸、VE和Vc。林超等[19]通过对BEL-7402人肝癌细胞株和A-549人肺癌细胞株的抑制活性筛选实验,证明鼠尾藻中高相对分子质量的海藻多酚抗肿瘤作用强于低相对分子质量海藻多酚。他们还发现鼠尾藻和海黍子中高分子质量多酚的抑菌作用好于低分子质量多酚。魏玉西等[20]研究了鼠尾藻和海黍子两种褐藻中高相对分子质量褐藻多酚的抗氧化活性, 结果表明, 其对羟自由基,超氧阴离子和DPPH均有很高的清除效率。Blunden 等[21]从泡叶藻和墨角藻分离出具有裂解质粒DNA、抑制某些酶等生物活性的高相对分子质量褐藻多酚。可见高分子质量的褐藻多酚在多种活性上比低分子质量褐藻多酚更具优势, 这与本实验结果相符。
本实验对不同分子质量段SFP抗氧化活性的研究, 证实羊栖菜褐藻多酚会因为分子质量大小和溶剂的不同而表现出不同的抗氧化活性。在已得到羊栖菜褐藻多酚组分中乙酸乙酯萃取相分子大于 30 000的综合抗氧化活性最好, 对于部分自由基的清除能力甚至强于没食子酸、VE和Vc。为下一步的分离SFP得到高纯度、高活性的天然抗氧化剂提供了依据。
[1] 赵越剑. 羊栖菜对阳光紫外线辐射的生理生态学响应[D]. 汕头: 汕头大学理学院, 2009.
[2] 郑海龙, 郭建敏, 杜广曦. 羊栖菜脱腥脱色研究[J].浙江农业大学学报, 1998, 24(4): 421-424.
[3] 陈帆, 占舟. 海洋药物羊栖菜中单糖的毛细管色谱分离研究[J]. 温州师范学院学报(自然科学版), 2001, 22(6): 34-36.
[4] 严小军. 中国常见褐藻的多酚含量测定[J]. 海洋科学集刊, 1996, 37: 61-65.
[5] 魏玉西, 郭道森, 牛锡珍, 等. 褐藻中多酚化合物的研究进展[J]. 海洋科学, 2002, 26(10): 18-20.
[6] Yuan Y V, Walsh N A. Antioxidant and antiproliferative activities of extracts from a variety of edible seaweeds[J]. Food and Chemical Toxicology, 2006, 44: 1144-1150.
[7] Zou Y P, Qian Z J, Li Y, et al. Antioxidant Effects of Phlorotannins Isolated fromIshige okamuraein Free Radical Mediated Oxidative Systems[J].Food Chem,2008, 56: 7000-7009.
[8] 李云. 综述自由基对人体健康的影响及目前的预防措施[J]. 内蒙古石油化工, 2011, 1: 87-89.
[9] 张燕平, 张虹, 洪永平, 等. 羊栖菜提取物体外自由基清除能力的研究[J]. 郑州工程学院学报, 2003, 24(1): 50-53.
[10] 叶红, 周春红, 高蓓蕾, 等. 羊栖菜乙醇提取物的抗氧化活性[J]. 湖北农业科学, 2011, 50(22): 4695-4697.
[11] 韩华, 战松海, 单联刚, 等. 羊栖菜中清除自由基活性物质的研究[J]. 中国海洋药物, 2008, 27(3): 31-34.
[12] ISO14502-1, Determination of substances characteristic of green and black tea-Part 1:Content of total polyphenols in tea-Colorimetric method using Folin-Ciocalteu reagent[S].
[13] Kadriye Işıl, Berker & Kubilay, Güçlü & İzzet, et al. Total antioxidant capacity assay using optimized ferricyanide/prussian blue method [J]. Food Anal, 2010, 3: 154-168.
[14] 赵艳红, 李建科, 李国秀. 天然抗氧化物体外活性评价方法的优选与优化[J]. 食品科学, 2008, 29(6): 64-69.
[15] Nicle Cotellen, Jean Luc Bernier, Jean Pierre Catteau, et al. Antioxidant properties of hydroxy-flavones[J]. Free Radical Biology and Medicine, 1996, 20(1): 35-43.
[16] Ting Sun, Chi Tang Ho. Antioxidant activities of buckwheat extracts[J]. Food Chemistry, 2005, 90(4): 743-749.
[17] 蒲法章. 超氧阴离子自由基和过氧亚硝酸根离子荧光测定法的研究[D]. 泰安: 山东农业大学化学与材料科学学院, 2010.
[18] 文镜, 张西, 陈曦, 等. 体内羟自由基的检测方法[J]. 食品科学, 2004, 25(10): 351-355.
[19] 林超. 两种褐藻中多酚化合物的生理活性研究[D].青岛: 青岛大学化工学院,2005.
[20] 魏玉西, 徐祖洪. 褐藻中相对高分子质量褐藻多酚的抗氧化活性研究[J]. 中草药, 2003, 34(4): 317-319.
[21] Barwell C J, Blunden G, Manandhar P D. Isolation and characterization of brown algal polyphenols as inhibitors of α-amylase, lipase, and trypsin [J]. J Appl Phycol, 1989, 1: 318-321.
