VEGF-siRNA诱导 MCF-7细胞凋亡及其机制
2013-12-23,,
,,
(滨州医学院生物化学教研室,山东 烟台 264003)
血管内皮生长因子(VEGF)是目前发现的最重要的肿瘤血管生成促进因子。VEGF可通过旁分泌机制刺激肿瘤细胞血管生成,进而加速肿瘤细胞的增殖。新的研究结果也显示,除了旁分泌作用机制外,VEGF还可通过自分泌机制抑制肿瘤细胞的凋亡,促进肿瘤的发生发展。survivin是目前发现的最强的抗凋亡因子,它通过抑制细胞凋亡和促进细胞进入增殖期两方面的作用对抗细胞凋亡。近几年来,关于VEGF 与survivin相关性的研究逐渐展开。但是,应用RNA干扰(RNAi)技术沉默乳癌细胞VEGF表达后survivin基因是否相应下调,国内外尚未见报道。本文研究在前期实验的基础上,应用RNAi技术下调人乳癌MCF-7细胞VEGF表达后,采用流式细胞仪检测细胞凋亡,分别从基因和蛋白水平检测survivin在转染前后的变化,以探讨靶向VEGF的siRNA下调VEGF表达后引起的细胞凋亡状态的改变,以及细胞凋亡与凋亡相关基因survivin的关系,从分子水平探讨下调VEGF后诱导细胞凋亡的机制,为肿瘤的分子治疗寻求新方向。现将结果报告如下。
1 材料和方法
1.1 实验材料
人乳癌MCF-7细胞株,由青岛大学医学院生物化学与分子生物学实验室冻存。DMEM培养基购自美国Gibco公司,标准胎牛血清购自民海生物科技有限公司。AMV逆转录试剂盒购自Promega公司;PCR检测试剂盒购自TaKaRa公司,Annexin V-FITC细胞凋亡检测试剂盒购自贝博公司;免疫组化检测试剂盒SP-9001及DAB显色试剂盒购自北京中杉试剂公司;兔抗人survivin单克隆抗体为Thermo公司产品。
1.2 实验方法
1.2.1细胞培养 MCF-7细胞在含体积分数0.10胎牛血清、青霉素100 kU/L、链霉素100 mg/L的DMEM培养基中贴壁生长后,置37 ℃、体积分数0.05 CO2饱和湿度环境下培养。
1.2.2siRNA设计与合成 根据文献[3]设计引物,VEGF siRNA序列:正义链5′-GGAGUACC-CUGAUGAGAUCUU-3′,反义链5′-GAUCUCAU-CAGGGUACUCCUU-3′;阴性对照siRNASCR(sc-ramble siRNA)序列:正义链5′-UUCUCCGAACG-UGUCACGUTT-3′,反义链5′-ACGUGACACGUU-CGGAGAATT-3′。两序列均行BLAST比对分析以排除其同源性,并对VEGF siRNA正义链末端行甲基化修饰,以增强其稳定性。所用引物均由大连宝生物公司合成,所有序列均由上海吉玛生物技术有限公司化学合成。
1.2.3siRNA转染细胞及分组 选取生长状态良好、贴壁生长至70%~80%融合的细胞种板。按每孔1.5×105个细胞数接种于6孔培养板,体积分数0.05 CO2、37 ℃条件下培养。转染前1 d改用不含抗生素、仅含血清的培养基进行培养,细胞融合度达30%~50%时进行转染。转染时,弃去细胞孔板中旧培养液,按LipofectamineTM2000使用说明方法进行操作,首先用不含抗生素和血清的DMEM培养基将siRNA (50 pmol)和LipofectamineTM2000 (2.5 μL)分别稀释至250 μL(siRNA的终浓度为100 nmol/L),室温孵育5 min后将两者缓慢混匀,再经室温孵育20 min后加到细胞板孔中,细胞置于含体积分数0.05 CO2、37 ℃饱和湿度的培养箱中培养,4 h后加入常规含血清培养基正常培养。实验分为6组。空白对照组:实验时弃正常培养基,只加无血清无抗生素的培养基;脂质体对照组:不加siRNA,只加入空脂质体LipofectamineTM2000;3个浓度siRNA组:siRNA终浓度分别为50、100、200 nmol/L;阴性对照(siRNASCR)组:siRNASCR终浓度为100 nmol/L。
1.2.4流式细胞术检测细胞凋亡 转染VEGF siRNA 24 h后,流式细胞术检测细胞凋亡情况。常规消化收集细胞,D-Hanks液轻柔冲洗细胞两次,然后以400 μL Binding Buffer悬浮细胞,密度大约为1×108/L,然后加入5 μL Annexin V-FITC,轻柔混匀,2~8 ℃避光孵育15 min,孵育结束后加入10 μL的PI,轻柔混匀,2~8 ℃避光孵育5 min,1 h内应用流式细胞仪检测细胞凋亡情况。
1.2.5半定量RT-PCR检测survivin基因mRNA表达水平 转染VEGF siRNA 24 h后,按照Trizol试剂盒操作说明提取细胞总RNA。将所提取总RNA 1 μg行20 μL体系逆转录反应,具体步骤按照逆转录试剂盒操作说明的方法进行。取cDNA行后续25 μL体系PCR反应,以β-actin为内参,其中survivin引物序列分别为:上游引物5′-GAGCTG-CAGGTTCCTTATC-3′,下游引物5′-ACAGCATC-GAGCCAAGTCAT-3′,扩增产物为434 bp;β-actin的引物序列为:上游引物5′-GTGACAGCAGTCGG-TTGG-3′,下游引物5′-AAAACTTACTACTCGG-AAGG-3′,产物长度298 bp。survivin PCR反应条件:94 ℃预变性3 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,循环30次;72 ℃延伸5 min。PCR扩增产物经琼脂糖凝胶电泳后观察拍照,然后应用天能分析软件对各条带进行吸光度(A)扫描,以各组survivin mRNA RT-PCR产物与其对应内参β-acting的A值之比表示survivin基因mRNA表达水平。
1.2.6免疫组化检测MCF-7细胞survivin蛋白的表达 取对数生长期细胞,接种于铺好盖玻片的24孔板,正常培养24 h后弃去培养液,按照1.2.3所述方法进行VEGF siRNA转染,48 h后弃去培养液,PBS冲洗3次,每次5 min,然后加40 g/L的多聚甲醛固定(4 ℃,30 min),固定结束后吸干多聚甲醛,PBS冲洗3次,每次5 min。然后进行免疫组织化学染色,按照试剂盒的说明书操作。DAB显色,操作严格按照DAB试剂盒说明书进行,显微镜下观察显色情况,控制显色时间。显色结束,自来水冲洗终止反应,梯度乙醇脱水,二甲苯透明,中性树胶封片,实验重复3次以上。survivin阳性染色呈棕黄色颗粒状,定位于细胞质和细胞核。在每张玻片上随机抽取3个视野,应用VIDAS图像分析系统进行吸光度分析。
1.3 统计学处理
2 结 果
2.1 各组细胞凋亡情况比较
转染24 h以后,与空白对照组相比较,3个浓度siRNA组MCF-7细胞早、晚期凋亡率均增加,差异有显著意义(F=35.81、30.12,q=6.08~56.53,P<0.05);siRNASCR组、脂质体对照组早、晚期凋亡率差异无统计学意义(P>0.05)。见表1。
2.2 各组survivin mRNA表达比较
转染VEGF siRNA后24 h,3个浓度siRNA组survivin mRNA表达均下调,差异有显著性(F=21.59,q=11.56~253.20,P<0.05、0.01);其中50 nmol/L siRNA组survivin mRNA表达高于100 nmol/L siRNA组和200 nmol/L siRNA组,差异有统计学意义(q=8.75~35.40,P<0.05);100 nmol/L siRNA组和200 nmol/L siRNA组之间比较差异无统计学意义(P>0.05)。siRNASCR组、脂质体对照组与空白对照组比较,差异无统计学意义(P>0.05)。见图1、表2。
2.3 各组survivin蛋白表达水平比较
与空白对照组比较,3个剂量siRNA组survivin蛋白表达水平均降低(F=35.64,q=25.72~273.20,P<0.05、0.01);其中50 nmol/L siRNA组survivin 蛋白表达明显高于100、200 nmol/L siRNA组(q=69.80~358.70,P<0.01),100 nmol/L siRNA组和200 nmol/L siRNA组之间差异无显著性(P>0.05);siRNASCR组、脂质体对照组与空白对照组之间比较差异无显著意义(P>0.05)。见表2。
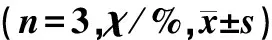
表1 各组细胞凋亡情况比较
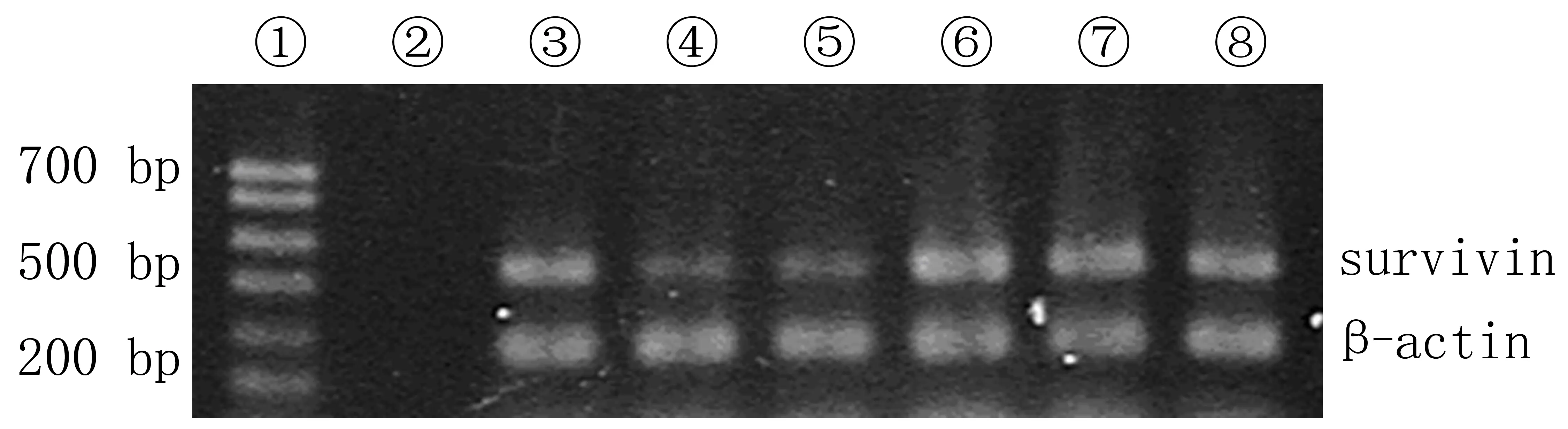
①Marker;②无酶水;③50 nmol/L VEGF siRNA组;④100 nmol/L VEGF siRNA组;⑤200 nmol/L VEGF siRNA组;⑥siRNASCR组;⑦脂质体对照组;⑧空白对照组。
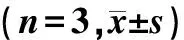
表2 各组survivin mRNA和蛋白表达比较
3 讨 论
VEGF是目前研究最多的血管生成促进因子,在正常成熟组织中较少表达,但在肿瘤组织中高度表达。已有文献报道,VEGF在诸如乳癌、膀胱癌及血液系肿瘤如白血病、淋巴瘤和多发性骨髓瘤等多种恶性肿瘤组织中均呈现高表达[1-3]。VEGF和位于肿瘤血管内皮细胞上的特异性酪氨酸蛋白激酶受体(VEGFR)结合后,能够促进血管内皮细胞增殖和分化,增强血管通透性,加速肿瘤新生血管的形成。FERRER等[4]研究显示,在前列腺癌细胞中,除了高表达VEGF外,VEGF的受体 FLT-1 和FLK-1 都有表达。MEISTER等[5]研究显示,人类神经母细胞瘤细胞株和神经母细胞瘤原位癌均有VEGF和受体FLK-1表达。其结果提示肿瘤细胞自身分泌的VEGF可以作用于细胞本身上的受体,通过一定的机制来对抗肿瘤细胞凋亡,促进肿瘤的发生发展。其机制可能是:VEGF与肿瘤细胞上的受体结合后,激活了某种信号途径,使一些原癌基因激活、抑癌基因失活,进而实现抗凋亡作用。
本文研究结果显示,靶向VEGF的siRNA转染入MCF-7细胞后能够引起细胞凋亡率的增加,并且有一定的剂量依赖性。本实验室前期研究结果已经证实,靶向VEGF的siRNA转染入细胞后首先沉默VEGF的表达[6],故可认为是VEGF表达的下调引起细胞凋亡率的增加,证实人乳癌MCF-7细胞中存在VEGF调控肿瘤细胞凋亡的自分泌机制。
为了进一步探讨VEGF下调引起MCF-7细胞凋亡的分子机制,本实验采用RT-PCR和细胞免疫组化技术,分别检测了VEGF siRNA转染MCF-7细胞以后,细胞凋亡相关基因survivin mRNA和蛋白表达水平的变化,以期在分子水平上寻找靶向VEGF的siRNA下调VEGF后引起MCF-7细胞凋亡的原因。 survivin又名生存素或存活素,是目前发现的最强的抗凋亡因子,正常情况下,发育成熟的组织(胸腺和生殖腺除外)中不表达survivin,仅在胚胎组织中有survivin的表达[7]。但是在包括乳癌在内的多种恶性肿瘤组织中都检测到survivin异常高表达。TANAKA等[8]研究结果显示,乳癌组织中survivin阳性表达率高达70.7%,但癌旁组织中阴性表达,提示survivin可能参与了乳癌的发生发展。survivin对抗细胞凋亡的主要机制是:①survivin是凋亡效应性蛋白酶caspase3和caspase7的直接抑制剂; ②survivin与细胞周期调节蛋白CDK4形成 survivin/CDK4复合物,阻断细胞凋亡信号传导通路[9];③survivin与纺锤体纤维结合,间接抑制凋亡酶caspase对纺锤体的水解作用。
已有研究结果显示,血管内皮细胞中VEGF对survivin的表达具有正向调控作用,即二者之间存在着正相关关系,VEGF能够对survivin的表达产生增强和诱导作用,而survivin的表达上调则是内皮细胞在血管生成过程中维持生存活力的必要条件[10]。ZHOU 等[11]研究显示,人卵巢癌中下调VEGF的表达可使癌细胞中survivin的表达下调。但是应用RNAi的方法下调VEGF后能否引起survivin表达相应下调尚未见报道。本研究结果显示,各浓度siRNA转染组survivin mRNA及蛋白表达水平均较空白对照组降低,证实应用RNAi下调VEGF后survivin的表达随之下调,并且达到一定干扰浓度之后会显著下调(100 nmol/L siRNA组)。推测在VEGF的信号传导通路中,survivin可能是其下游分子,沉默VEGF所致的细胞凋亡在一定程度上是通过下调survivin表达来实现。
综上所述,人乳癌MCF-7细胞存在VEGF及其受体的自分泌环路。靶向VEGF基因的siRNA转染MCF-7 后可诱导细胞凋亡,其分子机制与凋亡相关基因survivin表达有关。因此,以VEGF为靶点,应用 RNAi治疗乳癌具有双重效应,一方面通过抑制VEGF的自分泌途径,以达到诱导肿瘤细胞凋亡的目的;另一方面通过抑制VEGF的旁分泌途径,降低了肿瘤血管内皮细胞的增殖分化,通过减少肿瘤组织新生血管的生成来对抗肿瘤的发展。为肿瘤基因治疗提供了新的依据。
[1] TOI M, HOSHINA S, TAKAYANAGI T, et al. Association of vascular endothelial growth factor expression with tumor angiogenesis and with early relapse in primary breast cancer[J]. Japanese Journal of Cancer Research: Gann, 1994,85(10):1045-1049.
[2] CHOW N H, LIU H S, CHAN S H, et al. Expression of vascular endothelial growth factor in primary superficial bladder cancer[J]. Anticancer Research, 1999,19(5C):4593-4597.
[3] BELLAMY W T, RICHTER L, FRUTIGER Y, et al. Expression of vascular endothelial growth factor and its receptors in hematopoietic malignancies[J]. Cancer Research, 1999,59(3):728-733.
[4] FERRER F, MILLER L J, LINDQUIST R, et al. Expression of vascular endothelial growth factor receptors in human prostate cancer[J]. Urology, 1999,54(3):567-572.
[5] MEISTER B, GRÜNEBACH F, BAUTZ F, et al. Expression of vascular endothelial growth factor (VEGF) and its receptors in human neuroblastoma[J]. European Journal of Cancer, 1999,35(3):445-449.
[6] 张晓,徐文华,葛银林,等. VEGF基因特异性siRNA转染后对人乳腺癌细胞增殖和凋亡的影响[J]. 细胞与分子免疫学杂志, 2007,23(1):14-17.
[7] 李美玲,高美华,宋云峰,等. Survivin和Caspase-3在乳癌组织的表达及相关性[J]. 齐鲁医学杂志, 2009,24(5):378-379.
[8] TANAKA K, IWAMOTO S, GON G, et al. Expression of survivin and its relationship to loss of apoptosis in breast carcinomas[J]. Clinical Cancer Research: an Official Journal of the American Association for Cancer Research, 2000,6(1):127-134.
[9] 孙志清,项锋钢,王文华. 人脑星形细胞瘤组织Survivin与VEGF表达及意义[J]. 齐鲁医学杂志, 2008,23(6):486-488,491.
[10] MESRI M, MORALES-RUIZ M, ACKERMANN E J, et al. Suppression of vascular endothelial growth factor-mediated endothelial cell protection by survivin targeting[J]. The American Journal of Pathology, 2001,158(5): 1757-1765.
[11] ZHOU J S, GAN N Y, ZHANG W J, et al. Proliferation suppression and apoptosis of ovarian carcinoma cells induced by small interfering RNA against vascular endothelial growth factor[J]. The Journal of Obstetrics and Gynaecology Research, 2010,36(2): 232-238.
