CaCl2 和NaOH 复合分解锆英砂工艺研究
2013-12-23陈伟东闫国庆赵健翔张亚增闫淑芳
陈伟东,闫国庆,赵健翔,张亚增,闫淑芳
(1. 内蒙古工业大学,内蒙古 呼和浩特 010051)
(2. 浙江锆谷科技有限公司,浙江 湖州 313220)
1 前 言
氯氧化锆(ZrOCl2)是重要的锆盐基础化工产品,是制备锆系列化工产品的主要原料,广泛应用于陶瓷、纺织、机械、电子、能源等领域[1-4]。我国氯氧化锆的产能和产量占世界90%以上,是世界最大的氯氧化锆生产国,大量出口美国、日本、欧洲等地。制备氯氧化锆的主要原料是锆英砂(ZrSiO4),碱熔分解锆英砂除去SiO2是制备氯氧化锆的重要步骤[5]。目前成熟的氯氧化锆生产工艺有3 种,分别是碱熔法、沸腾氯化法和碳化氯化法,其中以碱熔法生产商品级氯氧化锆为主[6-8]。
我国氯氧化锆工业生产普遍采用氢氧化钠碱熔分解锆英砂工艺,在分解过程烧碱过量,存在烧碱用量大、能源消耗高、污水处理量大等问题。为降低锆英砂分解反应温度及碱熔分解过程中的烧碱用量,改善传统工艺的不足,提出了一种添加剂-烧碱复合分解锆英砂工艺,即在烧碱-锆英砂反应体系内加入第三方组分作为添加剂。本研究选取CaCl2做添加剂,考察CaCl2加入量对锆英砂碱熔分解工艺锆转化率的影响,并对CaCl2+NaOH 复合分解锆英砂产物的物相组成和反应过程中的热变化进行了分析。
2 实 验
2.1 实验原料
实验所用的锆英砂产自澳大利亚艾璐卡资源有限公司,其化学成分见表1。固体氢氧化钠、氯化钙等均为分析纯。

表1 锆英砂的化学成分(w/%)Table 1 Chemical composition of zircon sand
2.2 实验方法
将锆英砂和固体氢氧化钠按质量比1∶1.2 混合均匀,分别加入0.2%、0.4%、0.6%、0.8%、1%的GaCl2(以锆英砂的百分比计),然后置于坩埚中,在马弗炉中按设定的温度和时间进行高温烧结。实验采用的工艺参数见表2。高温烧结后称取一定量的烧结料,置于锥形三角瓶中,然后加入一定量的盐酸,加热溶解,用EDTA 络合滴定法测定烧结料中可溶性锆的含量(以ZrO2计)。
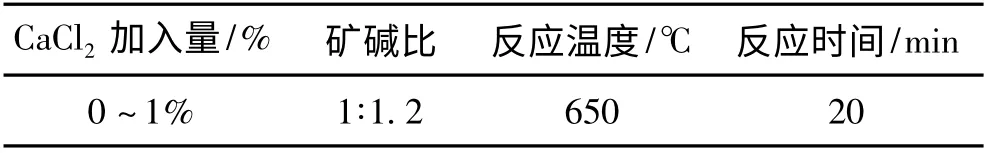
表2 烧结工艺参数Table 2 The parameters for sintering process
采用荷兰飞利浦APD-10 型全自动粉末衍射仪(参数:Cu 靶,电流35 mA,电压40 kV,步进扫描0.02°)对烧结料进行物相分析。采用德国耐驰公司STA 409PC Luxx 差热-热重同步分析仪对CaCl2-NaOH-ZrSiO4反应体系进行差热- 热重分析,加热温度从室温(25℃)升至1 000 ℃,升温速率10 ℃/min。
3 结果与讨论
3.1 CaCl2 加入量对锆英砂分解率的影响
图1 是在不同CaCl2添加剂加入量下,得到的烧结料中可溶性锆含量的曲线。从图1 中可以看到,在不添加CaCl2条件下,NaOH 单独分解锆英砂在所设定的实验条件下,所得烧结料中可溶性锆含量为29.9%。当在反应体系中加入CaCl2后,烧结料中可溶性锆含量有所增加,且随着CaCl2添加剂加入量的增加,烧结料中可溶性锆含量呈上升趋势。当CaCl2添加剂加入量为0.8%时,烧结料中可溶性锆含量达到最大值,为31.04%。而当CaCl2添加剂加入量继续增加至1%时,烧结料中可溶性锆含量略有降低。由此看出,CaCl2添加剂加入量的优选值为0.8%。

图1 CaCl2 加入量与烧结料中可溶性锆含量的关系曲线Fig.1 The cure of soluble zirconium amount under different CaCl2 additive content
3.2 烧结料的XRD 分析
为明确锆英砂经CaCl2和NaOH 碱熔分解后烧结料的物相组成,实验选取烧结料中可溶性锆含量最高的一组对其进行X 射线衍射分析。图2 为CaCl2添加剂量为0.8%时得到烧结料的XRD 图谱。从图2 中可以看出,锆英砂经CaCl2和NaOH 高温烧结后,烧结料中锆的存在形式主要是Na2ZrO3。烧结料中并未发现有锆酸钙的衍射峰出现,可能原因是由于所加入的CaCl2含量较低而难以检测出来。由此看来,CaCl2加入量低于1%时,并不影响锆英砂与NaOH 分解主反应的进行,锆英砂中ZrSiO4经CaCl2和NaOH 碱熔分解后主要以Na2ZrO3和硅酸盐的形式存在。

图2 烧结料的XRD 图谱Fig.2 XRD pattern of sintering material
3.3 反应体系差热-热重分析
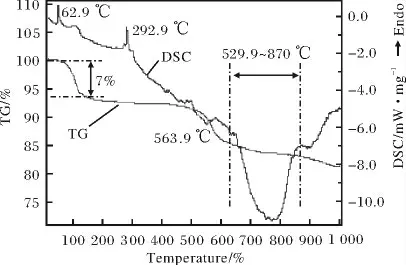
图3 CaCl2-NaOH-ZrSiO4 反应体系的TG-DSC 曲线Fig.3 TG-DSC cures of CaCl2-NaOH-ZrSiO4 system
图3 是CaCl2-NaOH-ZrSiO4反应体系的TG-DSC曲线。从图3 可以看出,在62.9 ℃时反应体系的DSC 曲线出现一个吸热峰,此时对应的TG 曲线开始下降。这是由于反应体系中各物质存在一定量的吸附水,该部分吸附水受热蒸发引起体系失重,同时伴随着吸热现象。当体系各物质包含的吸附水全部蒸发失去后,体系重量保持稳定状态。随着温度的继续升高,反应体系DSC 曲线在292.9 ℃时出现第二个吸热峰,此时体系重量没有发生明显变化。分析可知,该吸热峰是体系内NaOH 发生熔解所致。本实验实测温度与NaOH 的理论熔解温度(318.4 ℃),存在偏差,可能原因是所用的NaOH 试剂含有其他低熔点杂质所致。随着温度的继续升高,通过反应体系DSC 曲线可见,体系在563.9 ℃时出现放热峰,同时TG 曲线在放热峰温度范围内明显下降,随后反应体系在592.9 ~870 ℃温度范围内存在明显的放热反应,且在该温度范围内体系伴随着重量变化,重量持续减小。由此说明,CaCl2-NaOH-ZrSiO4反应体系在此温度范围内发生了化学反应,反应生成的水蒸气不断逸出,使得体系TG 曲线持续下降。通过对CaCl2-NaOH-ZrSiO4反应体系的TG-DSC 分析可知,CaCl2和NaOH 复合分解锆英砂的适宜温度范围为592 ~875 ℃,工业生产中以750 ℃为宜。
4 结 论
(1)以锆英砂和氢氧化钠为原料,CaCl2添加剂加入量为0.8%(以锆英砂的百分比计)时,烧结料中可溶性锆含量达到最大值31.04%。
(2)锆英砂经CaCl2和NaOH 高温烧结后,烧结料中不溶物的物相组成主要为Na2ZrO3。
(3)CaCl2和NaOH 复合分解锆英砂的最佳工艺条件为:矿碱比1 ∶1.2,CaCl2添加剂加入量为0.8%(以锆英砂的百分比计),分解温度750 ℃。
[1]熊炳昆,杨新民,罗方承,等. 锆铪及其化合物应用[M]. 北京:冶金工业出版社,2002. 147.
[2]熊炳昆,贾弘,逯福生,等. 我国金属锆铪及其制品的生产、应用及供求分析[J]. 稀有金属快报,2004,23(5):30 -32.
[3]罗方承,吕文广. 锆化合物材料应用现状及其展望[J].化学进展,2002,21(3):196 -199.
[4]吕瑞行,孙亚光,张庆杰,等. 锆化合物的生产、应用及发展[J]. 无机盐工业,1996 (5):19 -22.
[5]李中军,黄银霞,要红昌,等. 碳化锆碱熔制备氧氯化锆的研究[J]. 稀有金属,2006,30(3):415 -418.
[6]罗方承,吕文广,郑景宜,等. 氧氯化锆的生产及其在现代新能源中的应用[J]. 无机盐工业,2003,35(1):10-12.
[7]Abdelkader A M,Daher A,El -Kashef Emad . Novel decomposition method for zircon[J]. Journal of Alloys and Compounds,2008,460(1/2):577 -580.
[8]刘长河,王泽斌,王力军,等. 碱熔法氯化法制备氯氧化锆的技术经济比较[J]. 稀有金属快报,2007,26(1):97 -99.
