云南苍山火烧迹地不同恢复期地表蜘蛛群落多样性
2013-12-19马艳滟杨自忠
马艳滟,李 巧,冯 萍,杨自忠,2,*
(1.西南林业大学云南省森林灾害预警与控制重点实验室,昆明 650224;2.大理学院农学与生物科学学院,大理 671003)
大理苍山地处青藏高原的南缘,横断山脉中云岭山群的一部分,云南西部大理白族自治州境内,位于东经99°55'—100°12',北纬 25°34'—26°00'之间,是我国生物多样性最丰富的地区之一[1]。历史上由于用火不慎,引发过几次较大的山火,形成了不同恢复时期火烧迹地斑块,为研究生物多样性恢复和动植物群落演替提供了良好的天然基地。
蜘蛛是无脊椎动物较大的一个类群,隶属于节肢动物门Arthropoda蛛形纲Arachnida蜘蛛目Araneae,全世界已知111科3879属43244种[2],中国记述蜘蛛67科674属3714种[3]。蜘蛛是陆地生态系统最丰富的天敌资源类群,在控制害虫发生和维持生态系统平衡方面有重要作用[4-6]。土壤动物作为森林生态系统重要组成部分,在森林演替进程中具有重要的功能性作用[7]。地表蜘蛛是土壤动物组成中重要类群之一,由于易于采集,对森林采伐、干扰等环境变化敏感,在国外被广泛用于指示生物多样性和环境变化[8-11]。目前,国内对蜘蛛群落的研究主要集中于农田生态系统中蜘蛛群落的组成、结构、功能及演替与人为干扰活动(农药施用)的关系[12-14];对于天然林生态系统中蜘蛛群落的研究,国内学者也对湖南、江西、河北、四川、贵州等地的自然保护区蜘蛛群落多样性状况进行过报道[15-19]。针对天然林生态系统不同恢复期地表蜘蛛群落组成与多样性的静态和动态特征,以及不同恢复期蜘蛛群落间的相互关系的研究不多。本研究以“空间序列代替时间序列”的研究方法,调查苍山针阔混交林火烧迹地不同恢复期地表蜘蛛群落组成及多样性特点,考察火烧迹地不同恢复期地表蜘蛛相似性,初步探讨地表蜘蛛对火烧迹地不同恢复期生境变化的指示作用。研究结果将丰富国内火烧迹地蜘蛛群落研究,并对该地区生物多样性监测与保护具有一定的意义。
1 研究地区与研究方法
1.1 研究地区概况
研究区域设在云南苍山国家级自然保护区内,斜阳峰、应乐峰(均属于苍山19峰之一)阳坡的针阔混交林带,该林带分布在海拔2400—2900m范围内,属于中温带山地气候,年均气温8—12℃,最热月平均13—17℃,最冷月平均气温2—5℃。年降水量大于1100mm,土壤为为黄棕壤。植被丰富,乔木主要包括云南松Pinus yunnanensis、高山栎 Quercus aquifolioides、元江栲Castanopsis orthacantha等。灌木主要包括糙毛杜鹃Rhododendron trichocladum、矮杨梅Myrica nana、厚皮香 Ternstroemia gymnanthera等。草本主要包括大丁草Gerbera piloselloides、麦冬 Ophiopogon japonicus、拳参 Polygonum bistorta、兔儿风 Ainsliaea latifolia、蕨 pteridium aquilinum 等[1]。
1.2 样地设置
根据苍山火烧记录,运用“空间序列代替时间序列”的研究方法[20-21],于海拔2500—2700m间选择不同恢复期(恢复时间为火烧迹地形成年份距本文调查年份2009年的时间)的5块火烧迹地为调查样地,以没有火烧记录的为对照样地,样地概况见表1。
1.3 抽样方法及物种鉴定
样地约2hm2,每个样地内设置3个样方,各样方大小均为30m×20m每个样方间距200m以上;以口径80mm、高150mm的塑料杯作为陷阱;按五点取样法,在每个样方内布置25个陷阱(即25个样本),陷阱间距约为1m。以3%—5%甲醛溶液(80mL)作为陷阱溶液,大约每30d取出其陷阱内的蜘蛛,取出的蜘蛛用75%酒精保存[22]。调查时间为2009年1—12月份,共采集12次。
对采集到的成体蜘蛛,主要依据形态特征及生殖器特征进行鉴定到种;无法鉴定到种的标本,按形态种(morphospices)鉴定到属,进行种类估计和数量统计[23-24]。幼体蛛也尽可能根据可识别特征鉴定到科或属,但文中不参与数据分析。

表1 苍山不同恢复期针阔混交林调查样地概况Table 1 Conditions of the six sample site in different restorations post-fire forest,Cangshan Mountain
1.4 数据分析
抽样充分性判断利用EstimateS(Version8.2.0)软件计算物种累积曲线(species accumulation curves),并通过Excel进行曲线的绘制[25];应用MMMeans(Michaelis-Menten means)方法对各样地地表蜘蛛物种丰富度进行估计,比较物种丰富度S值(物种数实际值)与MMMeans值(物种数估计值)的相对大小。根据曲线的特征结合S值与MMMeans值的比值(百分率)进行抽样充分性判断[26-27]。
物种组成和相对多度根据蜘蛛种类鉴定结果整理出物种科级组成名录,采用物种在样方中的个体数量百分比表示蜘蛛相对多度,相对多度大于10%即优势类群[21]。
物种多样性采用地表蜘蛛多度(即个体数量)、物种丰富度S值及MMMeans估计值,利用EstimateS软件完成各项指数的计算[28]。利用 SPSS16.0 中的 One-way ANOVA 进行方差分析和多重比较[29-31],分析前对数据进行标准化处理,个体数量进行平方根转换,MMMeans和物种数进行对数转换,使之符合正态分布;差异显著性检验方法为LSD法。
群落相似性 运用R语言中的vegan软件包进行主坐标分析(PCoA,Principal Coordinate Analysis)[32-33],对各样地蜘蛛群落的实际物种组成进行相似性比较。
指示值分析和指示物种确定利用R语言中的labdsv软件包计算各物种的IndVal值[34],参考相关研究以IndVal值大于等于 0.7 作为标准确定指示物种[31,35]。
2 结果与分析
2.1 抽样充分性分析
以样本数量为横坐标,实际物种数S值为纵坐标绘制样方和样地物种累积曲线(图1)。图1显示出6个样地曲线及样方曲线均为平滑的渐进线。利用MMMeans进行物种丰富度估计,6个样地的物种丰富度MMMeans估计值分别为62.08、93.20、96.00、87.67、71.42 和 72.60,物种数 S 值与 MMMeans值的比值分别为 93.43%、92.27%、81.25%、85.55%、86.81%和 89.53%,各样地抽样较充分。
2.2 物种组成及相对多度
经过一年的采集,在苍山针阔混交林火烧迹地中共采集地表蜘蛛成体标本13308头,隶属28科66属158个种(表2)。其中72种蜘蛛(占总物种数45.57%)个体数少于5,59种蜘蛛(占总物种数37.34%)仅在1个样地中发现。28个科中漏斗蛛科Agelenidae个体数最丰富,占总个体数的38.74%。皿蛛科Linyphiidae种类最大,占总物种数的20.89%;漏斗蛛科次之,占12.03%,跳蛛科 Salticidae,占10.76%;球蛛科 Theridiidae、蟹蛛科Thomisidae、园蛛科Araneidae种类在5%—10%之间,其余科均低于5%。在各个样地中漏斗蛛科和皿蛛科的物种数均高于其他科。

图1 苍山不同恢复期针阔混交林地表蜘蛛基于样本的物种累积曲线Fig.1 Sample-based accumulation curves in different restorations post-fire forest,Cangshan Mountain
比较不同恢复期主要优势类群(>10%)(图2):不同恢复期地表蜘蛛群落优势类群组成具有一定差异。样地Ⅰ、Ⅲ、Ⅳ、Ⅴ和Ⅵ均有不同的明显优势类群;不同恢复期随恢复时间的增加优势类群更替趋势明显,特别是,平腹蛛科Gnaphosidae、狼蛛科Lycosidae和跳蛛科Salticidae随恢复时间的增加相对多度明显减少;弱蛛科Leptonetidae仅出现在对照样地(即没有火烧记录的林地)。漏斗蛛科蜘蛛在火烧迹地不同恢复期均为优势类群,特别是在样地IV、V和VI中占绝对优势(>50%),其中隙蛛亚科蜘蛛占漏斗蛛科蜘蛛的92.16%。

表2 苍山不同恢复期针阔混交林地表蜘蛛群落组成Table 2 Composition of ground-dwelling spider community in different restorations post-fire forest,Cangshan Mountain
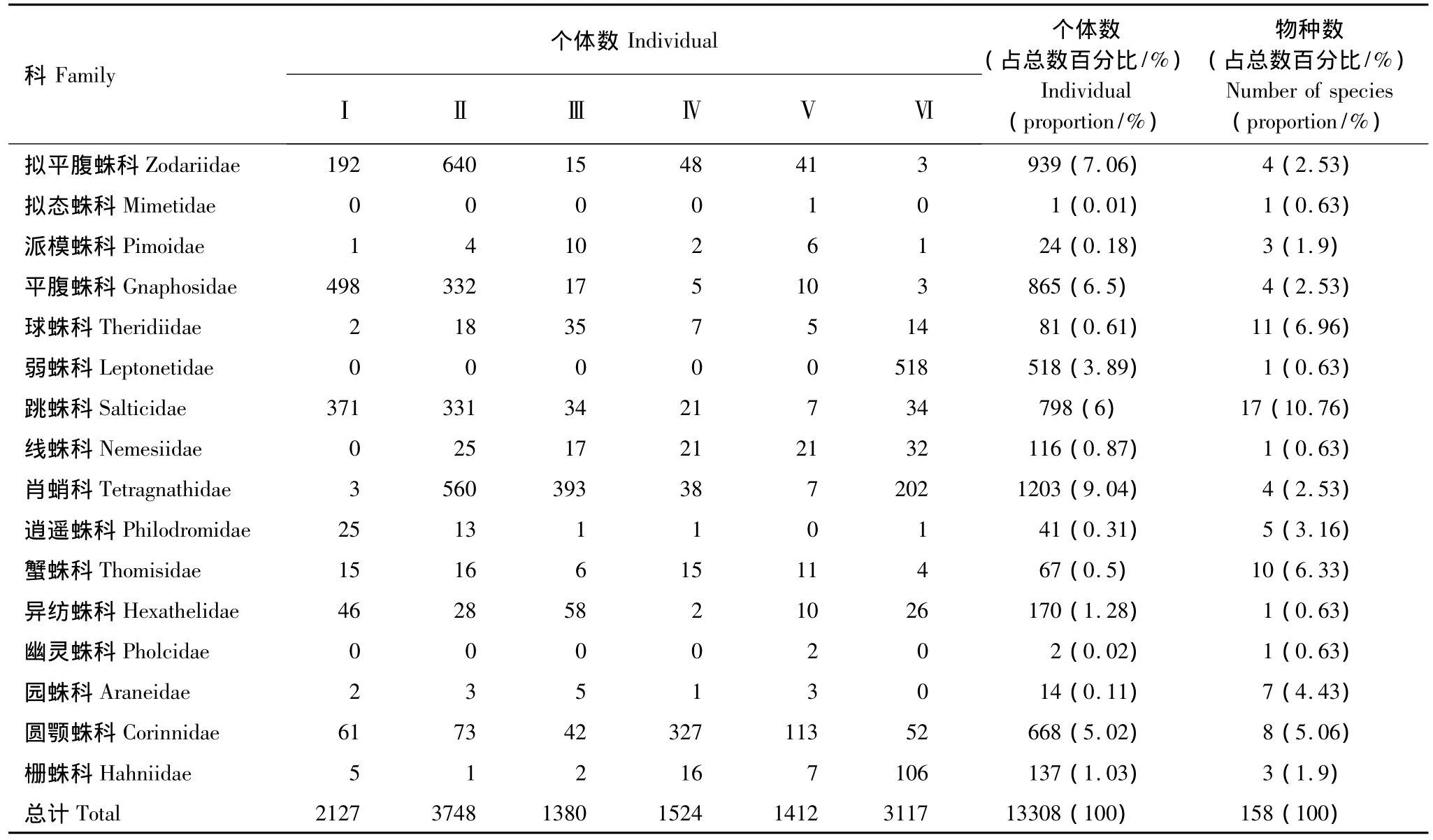
续表
2.3 多样性比较
方差分析和多重比较结果(表3)显示,各样地地表蜘蛛多度存在一定差异,样地Ⅱ最大,对照样地次之,样地Ⅰ与对照比较接近,在样地Ⅲ、Ⅳ、Ⅴ的地表蜘蛛多度较小,显著小于样地Ⅱ和对照;物种丰富度 S值在3.61—3.95之间,各样地间无显著差异,物种丰富度MMMeans估计值也没有显著的差异。该结果显示,火干扰发生后,地表蜘蛛多度降低,经过10余年恢复后多度增加,但随着恢复的继续进行,多度会下降并趋于稳定;而恢复时间对于物种丰富度没有显著影响。
2.4 群落相似性分析
相似性分析结果显示,6块样地在主坐标图(图3)上划分成了4块明显的区域。样地Ⅰ的3个样方彼此接近,样地Ⅱ的样方距离较近,这两个样地相互靠近;样地Ⅲ、Ⅳ和Ⅴ的各样方彼此混合,而样地Ⅵ的3个样方彼此接近,与其他样地相距较远。显然,恢复期较短的样地地表蜘蛛群落物种组成相似,其与恢复期较长的样地相比地表蜘蛛群落结构不同;遭受过火干扰的样地,其地表蜘蛛群落组成与未受火干扰的样地不相似。根据PCoA分析结果,将不同恢复期的地表蜘蛛群落发展过程分为3个阶段:火烧后2a的样地Ⅰ(阶段1)、火烧后10a的样地Ⅱ(阶段2),火烧后18—33a的样地Ⅲ、Ⅳ和Ⅴ(阶段3)。

图2 苍山不同恢复期针阔混交林地表蜘蛛优势类群组成及相对多度Fig.2 Composition and relative abundance of dominant spider community in different restorations post-fire forest,Cangshan Mountain
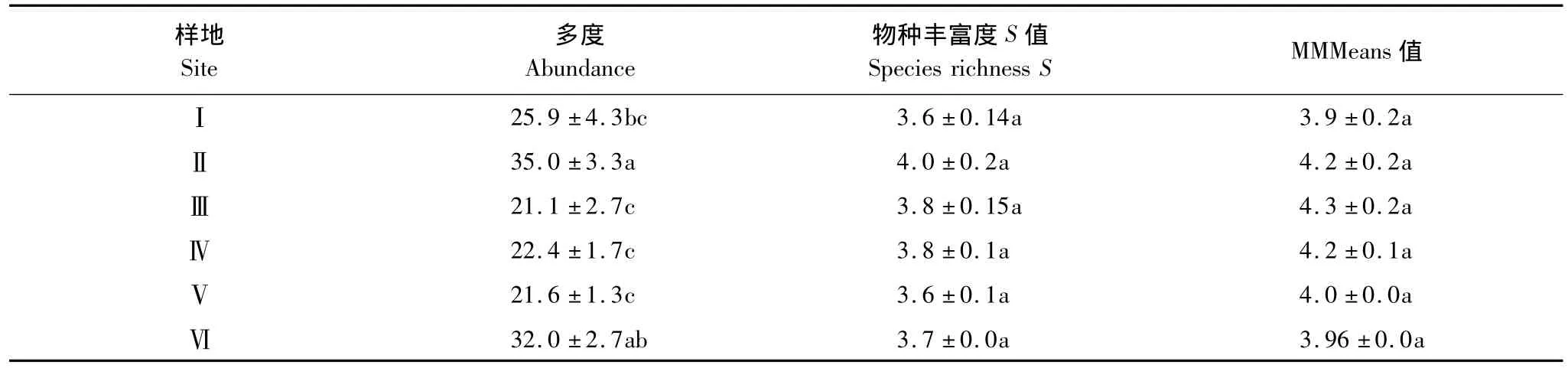
表3 苍山不同恢复期针阔混交林地表蜘蛛多样性比较Table 3 Comparison ground-dwelling spider community biodiversity in different restorations post-fire forest,Cangshan Mountain
2.5 指示物种及指示值分析
指示值分析(表4)显示,在各样地中有53个种的指示值在统计学上差异显著,其中15个种分别与各样地存在显著相关性(IndVal>0.7)。阶段1的指示物种为西菱头蛛Sibianor sp.1、光先隙蛛Coelotes guangxian和细丘皿蛛Agyneta subtilis;阶段2的指示物种为昆明阿斯蛛Asceua kunming、褶蛛Microneta sp.1和格氏狼蛛Lycosa grahami;阶段3的指示物种为花蟹蛛Xysticus sp.2和漏斗蛛Agelenus sp.4;对照样地的指示物种为弱蛛 Leptoneta sp.1、锐 蛛 Asthenargus sp.1、龙 隙 蛛Draconarius sp.2、隙蛛 Coelotes sp.12、卡氏方胸蛛Thiania.cavaleriei、额角蛛 Gnathonarium sp.1 和伽马蛛Gamasomorpha sp.1,其中弱蛛 Leptoneta sp.1 仅在对照中发现。
3 讨论与结论
3.1 不同恢复期地表蜘蛛群落组成
火干扰后,土壤节肢动物即进入恢复过程[36]。随恢复时间的增加,土壤温度、湿度、光照等小气候因子发生了变化及植被类型结构发生了更替[7],进而导致不同恢复期地表蜘蛛群落组成发生改变(图2)。主要表现在火干扰后2a的优势类群为偏好于比较开放、干燥、温热、简单的生境栖息的平腹蛛科、狼蛛科和跳蛛科;随着恢复时间的增加这些在火干扰后快速建群的类群逐渐减少。该结果与国内外相关研究基本一致:Niwa&Peck[37]在美国俄勒冈州针叶林研究规定用火对蜘蛛和步甲群落的影响发现,狼蛛科和平腹蛛蜘蛛在火烧迹地数量比在未被火干扰的样地中更多。Koponen[38]调查了芬兰北方针叶林森林火灾后地表蜘蛛群落的早期演替,结果显示狼蛛科个体数量在火烧迹地中占优势。Hore&Uniyal[39]研究了印度台拉河草地规定用火对蜘蛛群落的影响,发现狼蛛科和平腹蛛蜘蛛是火干扰的主要受益类群。跳蛛科蜘蛛也是滩涂、草地、农田等与火烧迹地相似生境的优势类群[40-41]。此外,恢复阶段相近的样地,物种组成相似或相近,且随恢复时间的增加优势类群更替趋势明显。该结果印证了森林演替对节肢动物群落的物种更替影响极大[42],不同演替阶段有不同适应种[43-44]的结论。
与国内其他地区地表蜘蛛群落组成相比较[30,41,45-48],大理苍山针阔混交林地表蜘蛛群落有鲜明的特点,即漏斗蛛科蜘蛛具有极高的多度和丰富度。这可能与蜘蛛地理分布区系差异有关,因为漏斗蛛科蜘蛛最大的亚科——隙蛛亚科Coelotinae主要分布于中国及周边的北亚热带和温带地区[2,49],特别是在滇西横断山区为优势类群[50]。该类群在苍山针阔混交林火烧迹地恢复过程也扮演重要角色,即在不同恢复期一直是优势类群(>10%),并且其优势度随恢复时间的增加而增加。这可能是由于森林火灾燃料燃烧不均匀性[51],以及石块下、木头下及树根表面的空隙使许多这些物种能够幸存[52-55]。除此之外,邻近未被火干扰地方提供着丰富的建群者也是一个重要的原因[56]。

图3 苍山不同恢复期针阔混交林地表蜘蛛群落主坐标分析(PCoA)Fig.3 Principal coordinate analysis for ground-dwelling spider community in different restorations post-fire forest,Cangshan Mountain
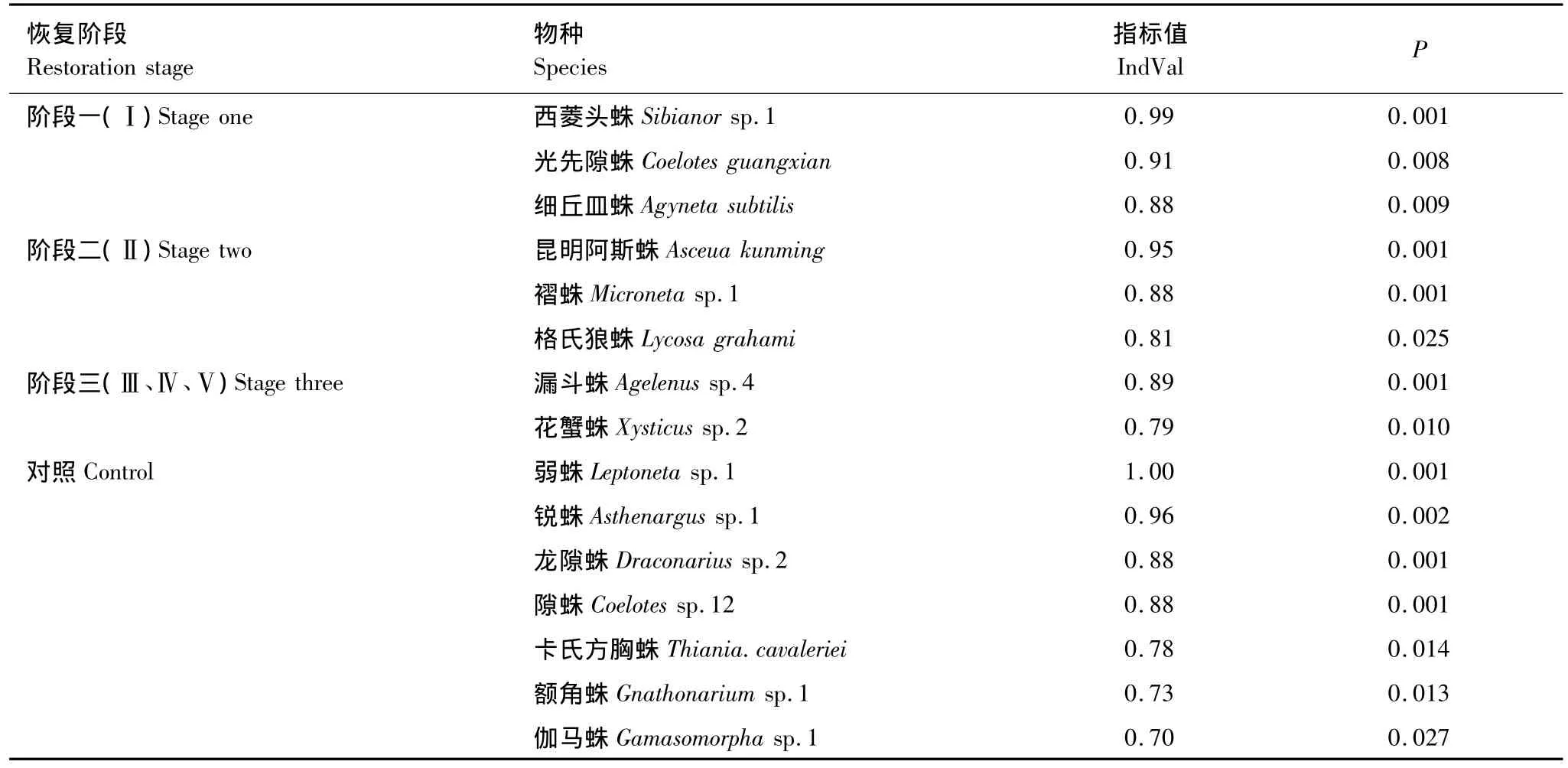
表4 基于PCoA结果对苍山不同恢复期针阔混交林地表蜘蛛群落进行的指示值分析Table 4 IndVal(Indicator value)analysis of ground-dwelling spider communities of different post-fire age in Cangshan Mountain,the data were based on PCoA results
3.2 不同恢复期地表蜘蛛多样性
研究显示,恢复10余年的火烧地地表蜘蛛多度最高,丰富度也较高。该结果与张雪萍等[57]对大兴安岭火烧迹地土壤动物生态地理分析结果相似,轻度火烧后6—7a是土壤动物发展的盛期,土壤动物种类和数量能超过未受火烧影响的地区。与余广彬和杨效东[58]对不同演替阶段热带森林地表凋落物和土壤节肢动物群落特征研究结果也有类似之处,即3个林地土壤节肢动物个体数和多样性存在差异,其最高值并没有出现在顶级阶段的季节雨林。这种多样性变化现象可以依据生境结构异质性增加来解释[21]。火烧迹地恢复早期,稀疏植被和密集植被的特征元素极其靠近,使生境有较高的结构异质性,这种异质性为地表提供了一个丰富多样的小气候条件,增加了小生境的物种容纳量[39];也为地表蜘蛛提供了大量的食物资源[59]。因此,火烧迹地地表蜘蛛多样性能在10a内弹性恢复。国外一些研究也表明很多地表食肉类无脊椎动物对火干扰都有较高的弹性恢复力[60-64]。
结合苍山不同恢复期针阔混交林地表蜘蛛群落物种组成及相对多度、多样性和相似性分析,将地表蜘蛛群落发展的3个阶段归纳为:先锋物种阶段(阶段1),物种最少,个体数量丰富,有明显先锋优势类群;弹性恢复阶段(阶段2),地表蜘蛛物种丰富,没有明显优势类群,群落多度弹性恢复达到所有恢复阶段最高;稳定发展阶段(阶段3),历时时间较长,物种丰富,个体数量较少,有明显优势类群,群落趋于稳定。
研究样地在物种组成上没有与对照样地相似或相近的,而且优势类群弱蛛科蜘蛛弱蛛Leptoneta sp.1仅在未被火干扰过的样地中发现,说明各恢复期地表蜘蛛群落物种组成还没有恢复,未受火干扰群落一旦破坏就很难恢复到原状。项凤武[65]对大兴安岭森林土壤生物火烧后的恢复状况进行了调查,表明土壤小动物、微生物种类和数量已基本恢复到火干扰前水平,认为火烧迹地8a后对土壤生物影响已结束。本研究显示火干扰后10a地表蜘蛛种类和数量虽已恢复到火干扰前水平,但物种组成相差较大。即使恢复期长达30余年与未受火干扰的群落(物种和个体数量比较丰富,有明显优势类群及专一性的优势类群,群落稳定)相比,地表蜘蛛群落组成仍未完全恢复。显然,火干扰改变了针阔混交林原有的蜘蛛群落组成;随着恢复或演替的继续进行,这些受到火干扰的针阔混交林是否能完全恢复,需要多少时间才能完全恢复,值得关注。
4.3 不同恢复期指示物种的指示作用
由于蜘蛛具有重要的生态地位、对生态环境变化敏感、易于采集等特点,在国外已经被广泛用于指示环境变化[11,66-67]。本文也证实了地表蜘蛛对生境变化有较强的敏感性,指示物种对生境的选择能够反映出不同恢复阶段地表环境变化。先锋物种阶段的指示物种西菱头蛛Sibianor sp.1属于跳蛛科西菱头蛛属Sibianor蜘蛛,该属蜘蛛通常在受人为干扰较大的稻田中为优势类群[68]。弹性恢复阶段的指示物种昆明阿斯蛛Asceua kunming和格氏狼蛛Lycosa graham分别属于拟平腹蛛科马利蛛属Mallinella和狼蛛科狼蛛属Lycosa蜘蛛,均属于典型的地面种类,常栖息于石下或穴道内[6]。稳定发展阶段的指示物种花蟹蛛Xysticus sp.2属于蟹蛛科花蟹蛛属Xysticus蜘蛛,该属蜘蛛生活于低矮植物、石下或落叶层中[6]。而弱蛛科Leptonetidae个体较小,一般1mm左右,多数种类生活于洞穴里或荫蔽处,对生境温湿度及环境的稳定性要求较高[69];卵形蛛科蜘蛛,偏好生活于多缝隙的土壤结构或松软的土壤环境中[48],而未受火干扰群落的地表小气候条件比较稳定,能够满足它们的需要。
综上所述,火干扰改变了云南苍山针阔混交林原有的地表蜘蛛群落多样性;恢复过程中地表蜘蛛群落多样性变化主要表现在物种组成及多度随恢复时间的增加变化明显;地表蜘蛛群落指示物种对生境的选择能够反映出不同恢复阶段地表环境变化;5个不同恢复时期火烧迹地中恢复最久的火烧迹地地表蜘蛛群落仍没有完成恢复,说明云南苍山火迹地地表蜘蛛的恢复需要30a以上,其多样性变化过程及其他演替特征值得我们继续关注。
致谢:大理学院黄荣、黄素珍、张有良、潘永圣、李云春、徐德鹏、杨振兴等同学参加标本野外采集工作,标本鉴定工作得到河北大学张锋博士、西南大学的张志升博士的帮助,大理学院冯建孟博士对写作给予帮助,特此致谢。
[1] Sun M.General records of Cangshan Mountain.Kunming:The Nationalities Publishing House of Yunnan,2008.
[2] Platnick N I.The world spider catalog,version 13.0.Museum of Natural History.http://research.Amnh.org/iz/spiders/catalog,2012.
[3] Li S Q,Wang X P.Endemic spiders in China.http://www.amaurobiidae.com/araneae,2012.
[4] Nyffeler M,Benz G.Spiders in natural pest control:a review.Applied Entomology,1987,103:321-339.
[5] Nyffeler M,Ecological impact of spider predation:a critical assessment of Bristowes and Turnbulls estimates.Bulletin of the British Arachnological Society,2000,11:367-373.
[6] Song D X,Zhu M S,Chen J.The fauna of Hebei,China.Shijiazhuang:Hebei Sinence and Technology Publishing House,2001.
[7] Yang X D.Comparison of the communities structure and seasonal changes in diversity of soil arthropod in tropical secondary forest,dry-rice land and fired remains.Acta Ecology sinca,2003,23(5):883-891.
[8] Uetz G W.Habitat structure and spider foraging//Hibitat Structure:The Physical Arrangement of Objects in Space.London:Chapman and Hall,1991,325-348.
[9] Bultman T L,Uetz G W.Abundance and community structure of forest floor spiders fllowing litter manipulation.Oecologia,1982,(55):34-41.
[10] Churchill T B.Spiders as ecological indicators:an overview for Australia.Memoirs of Museum Victoria,1997,(56):331-337.
[11] Wheater C P,Cullen W R,Bell J R.Spider communities as tools in monitoring reclaimed limestone quarry landforms.Landscape Ecology,2000,15(5):401-406.
[12] Li D Q,Zhao J Z.The spider community and its diversity in cotton fields.Acta Ecology Sinica,1993,13(3):205-213.
[13] Yin C M.The survey of ecological study of Chinese spider.Acta Arachnologica Sinica,1999,8(2):122-127.
[14] Wang H Q.Studies on the community structure and function of paddy field spiders in China.Changsha:Hunan Normal University Press,2006.
[15] Song D X,Yan H M,Zhu M S.On the structure and diversity of spider communities in mount Fanjing Guizhou Province and Zhangjiajie area,Hunan Provice,China.Acta Arachnologica Sinica,1992,1(1):45-57.
[16] Chen L S,Yuan F F,Rao J,Yan H M.Studies on diversity of spider community in Matoushan natural reserve in Jiangxi Province.Acta Agriculturae Universitatis Jiangxiensis,2005,27(3):429-434.
[17] Zhu L M,Zhang F,Zhang L R,Zhu M S.Study of spider community structure and diversity of Damao Mountain national forest park,China.Acta Arachnologica Sinica,2007,16(2):112-115.
[18] Zhang Z S,Wei G,Liu Z H,Zhang Y F,Zhang Y G.Study on the diversity of the spider community of the Changning national nature reserve for the Bamboo forest sea of Sichuan,China.Sichuan Journal of Zoology,2010,29(3):492-495.
[19] Li Z,Wang L Y,Li Z X,Zhang Z S.Analysis on community diversity of spiders from Chishui national nature reserve for spinulose tree fern,Guizhou province.Sichuan Journal of Zoology,2011,30(6):972-976.
[20] Pickett S T A.Space-for-time substitution as an alternative to long-term studies//Long-term studies in ecology:approaches and alternatives.New York:Springer-Verlag,1989.
[21] Moretti M.Effects of winter fire on spiders.European Arachnology,2000.Aarhus//Toft S.,Scharff N,eds.Aarhus University Press,2002.183-190.
[22] Yu G H,Chen J.Sampling using Pitfall traps in ecological research on spider.Acta Arachnological Sinica,2001,10(1):52-56.
[23] Oliver I,Beattie A J.A possible method for the rapid assessment of biodiversity.Conservation Biology,1993,7(3):562-568.
[24] Krell F.Parataxonomy vs.taxonomy in biodiversity studies-pitfalls and applicability of morpho-species sorting.Biodiversity Conservation,2004,13:795-812.
[25] Colwell R K,Coddington J A.Estimating terrestrial biodiversity through extrapolation.Philosophical Transactions of the Royal Society of London,1994,345:101-118.
[26] Toti D S,Coyle F A,Miller J A.A structured inventory of appalachian grass bald and heath bald spider assemblages and a test of species richness estimator performance.The Journal of Arachnology 2000,28:329-345
[27] Li Q,Chen Y L,Gao C J,Bei R T,Yin L H,Xiong Z P.Community diversity comparisons of spiders among plantation forests in Yuanmou dryhot valley.Journal of Yunnan Agricultural University,2008,23(6):731-735.
[28] Colwell R K,Estimate S.Statistical estimation of species richness and shared species from samples.Version 7.5.http://purl.oclc.org/estimates,2009.
[29] Scharff N,Coddington J A,Griswold C E,Hormiga G,Bjørn P de P.When to quit?Estimating spider species richness in a northern European deciduous forest.The Journal of Arachnology,2003,31:246-273.
[30] Li Q.Species accumulation curves and its application.Chinese Journal of Applied Entomology,2011,48(6):1882-1888.
[31] Chen Y Q,Li Q,Chen Y L,Lu Z X,Zhou X Y.Ant diversity and bio-indicators in land management of lac insect agroecosystem in Southwestern China.Biodiversity Conservation,2011,20(13):3017-3038.
[32] Roberts D W.labdsv:ordination and multivariate analysis for ecology.R package version 1.3-1.http://ecology.msu.montana.edu/labdsv/R,2007.
[33] R Development Core Team.R:a language and environment for statistical computing.http://www.R-project.org,2009.
[34] Dufrêne M,Legendre P.Species assemblages and indicator species:the need for a flexible asymasymmetrical approach.Ecologe Monogr,1997,67:345-366.
[35] Haddad C R,Honiball A S,Dippenaar-Schoeman A S,Slotow R,Rensburg B J.Spiders as potential indicators of elephant-induced habitat changes in endemic sand forest,Maputaland,South Africa.African Journal of Ecology,2009,48:446-460.
[36] Yue X Q,Zhou D W,Sun G.Microclimate changes in plant community following a Hulunbeier grassland burning.Journal of Northeast Normal University,1999,(1):91-96.
[37] Niwa C G,Peck R W.Influence of Prescribed Fire on Carabid Beetle(Carabidae)and Spider(Araneae)Assemblages in Forest Litter in Southwestern Oregon.Environmental Entomology,2002,31(5):785-796.
[38] Koponen S.Early Succession of a boreal Spider Community after Forest Fire.Journal Arachnology,2005,33:230-235.
[39] Hore U,Uniyal V P.Effect of prescribed fire on spider assemblage in Terai grasslands,India.Turk Journal Arachnology,2008,1(1):15-36.
[40] Liu J W,Wang G X,Liu K Y,Yang Q R.Studies on the structure of spider community in Tianhe Airport.Journal of Central China Normal University,2001,35(1):68-71.
[41] Zhu L M,Zhang F,Zhu M S.Spider community structure in typical habitats of Xiaowutai Mountain,China.Journal of Hebei University(Natural Science Edition),2008,28(01):88-91.
[42] Li X J,Liu Y A,Li C H,Diao C Q.Effect of Forest Succession on Arthropod Diversity in Jinyun Mountain,Chongqing.Journal of Northeast Forestry University,2009,37(10):35-39.
[43] Ricklefs R E.The economy of nature.New York:Chiron Press Freeman(fifth edition),2001.
[44] Langlands P R,Brennan K E C,Framenau V W,Main B Y.Predicting the post-fire responses of animal assemblages:testing a trait-based approach using spiders.Animal Ecology,2011,80(3):558-568.
[45] Yan H M,Yin C M,Wang H Q.Studies on Diversity of spider community in the area of mount Wuling,the southwest of China.Journal of Natural Science of Hunan Normal University,1994,17(3):65-71.
[46] Wang Y Z,Chen F Y,Lu Y C,Nie X Z.Preliminary research on soil spider community in the forests of Jiuhua Mountains,Anhui Province.Acta Ecologica Sinica,1997,17(1):71-77.
[47] Lie W L,Zhu M S,Song D X.Studies on the structure and diversity of soil spider communities in zhangjiakou area,Hebei Province,China.Acta Arachnologica Sinica,1999,8(1):49-54.
[48] Zheng G,Yang X D,Li S Q.Biodiversity of ground-dwelling spider in six forest types in Xishuangbanna,S.W.China.Acta Entomologica Sinica,2009,52(8):875-884.
[49] Li Z X,Wu C Q,Zhang Z S.The analysis of species diversity of Chinese spiders.Acta Arachnologica Sinica,2011,20(1):46-51.
[50] Yang Z Z,Mao B Y,Xu J S,Su Z F.Analysis of fauna and researching resource of spiders in Hengduan Mountains,west Yunnan Province.Journal of Dali University,2006,5(2):20-31.
[51] Marxer P,Conedera M.Experimental fire in Switzerland.Final report of the PROMETHEUS project.Swiss Federal Research Institute WSL -Sottostazione Suddelle Alpi Bellinzona,2000.
[52] Huhta,V.Succession in the spider communities of the forest floor after clear-cutting and prescribed burning.Annales Zoologici Fennici,1971,8:483-542.
[53] Merrett P.Changes in the ground-living spider fauna after heathland fires in Dorset.Bulletin of the British Arachnological Society,1976,3:214-221.
[54] Yang X D,Tang Y,Tang J W.Change on the Composition and Distribution of Soil Arthropod Community before and after Burning in the Secondary Forest of Xishuangbanna.Chinese Journal of Ecology,2001,20(5):32-35.
[55] Underwood E C,Quinn J F.Response of ant and spiders to prescribed fire in oak woodlands of California.Insect Conservation,2010,14:359-366.
[56] Antunes S C,Curado N,Castro B B,Gonçalves F.Short-term recovery of soil functional parameters and edaphic macro-arthropod community after a forest fire.Soils Sediments,2009,9:267-278.
[57] Zhang X P,Zhang S H,Li J K.Eco-geographical analysis of soil animals in burned forest areas in Greater Hinggan Mountains.Geographical Research,2006,25(2):327-334.
[58] Yu G B,Yang X D.Characteristics of litter and soil arthropod communities at different successional stages of tropical forests.Biodiversity Science,2007,15(2):188-198.
[59] Moretti M,Duelli P,Obrist M K.Biodiversity and resilience of arthropod communities after fire disturbance in temperate forests.Oecologia,2006,149:312-327.
[60] Moretti M,Conederaet M,Duelli P,Edwards P J.The effects of wildfire on ground-active spiders(Arthropoda:Araneae)in deciduous forests on the southern slope of the Alps.Ecological Applications,2002,39:321-336.
[61] Moretti M,Obrist M K,Duelli P.Arthopod biodiversity after forest fire:winner and losers in the winter fire regime of the southern Alps.Ecography,2004,27:173-186.
[62] Wikars L O.Immediate effects of fire-severity on soil invertebrates in cut and uncut pine forests.Forest Ecology Manage,2001,141:189-200.
[63] Hanula J L,Wade D D.Influence of long-term dormant season burning and fire exclusion on ground-dwelling arthropod populations in longleaf pine flat woods ecosystems.Forest Ecology Manage,2003,175:163-184.
[64] Parr C L,Robertson H G,Biggs H C,Chown S L.Response of African savanna ants to long-term fire regimes of African savanna ants to long-term fire regimes.Ecological Applications,2004,41:630-642.
[65] Xiang F W.Recovering Investigation of soil edaphon after forest fire.Journal of Jilin forestry University,1998,14(2):99-102.
[66] Bell J R,Shaw E M,Wheater P.Dose stochasticity in emergent pioneer communities reduce the value of indicator species analysis?European Arachnology,2004,143-150.
[67] Buchholz S.Ground spider assemblage as indicator for habitat structure in inland sand ecosystems.Biodiversity Conservation,2010,19:2565-2595.
[68] Wang H Q,Shi G B.Studies on the dominant species and the contributing factors of paddy field spiders in China.Acta Arachnologica Sinica,2002,11(2):85-92.
[69] Ba J W,Li D H.Diversity of the cave-dwelling spider and thire adaptation to the cave environment in China.Acta Zootaxonomica Sinica,2009,34(1):98-105.
参考文献:
[1] 孙明.苍山志.昆明:云南民族出版社,2008.
[3] 李枢强,王新平.中国蜘蛛特有物种网.http://www.amaurobiidae.com/araneae.2012.
[6] 宋大祥,朱明生,陈军.河北动物志-蜘蛛类.石家庄:河北科技出版社,2001.
[7] 杨效东.热带次生林、早稻种植地和火烧迹地土壤节肢动物群落结构特征及季节变化.生态学报,2003,23(5):883-891.
[12] 李代芹,赵敬钊.棉田蜘蛛群落及其多样性研究.生态学报,1993,13(3):205-213.
[13] 尹长民.中国蜘蛛生态学研究概况.蛛形学报,1999,8(2):122-127.
[14] 王洪全.中国稻区蜘蛛群落结构和功能的研究.长沙:湖南科学技术出版社,2006.
[15] 宋大祥,颜亨梅,朱明生.梵净山和张家界地区蜘蛛群落结构及多样性研究.蛛形学报,1992,1(1):45-57.
[16] 陈连水,袁凤辉,饶军.江西马头山自然保护区蜘蛛群落多样性研究.江西农业大学学报,2005,27(3):429-434.
[17] 朱立敏,张峰,张丽荣,朱明生.大茂山国家森林公园蜘蛛群落结构及多样性研究.蛛形学报,2007,16(2):112-115.
[18] 张志升,魏国,刘钟华,张玉富,张耀光.四川省长宁竹海自然保护区蜘蛛群落多样性研究.四川动物,2010,29(3):492-495.
[19] 李仲,王露雨,李宗煦,张志升.贵州赤水桫椤自然保护区蜘蛛群落多样性分析.四川动物,2011,30(6):972-976.
[22] 喻国辉,陈建.使用陷阱采样在蜘蛛生态学研究中的应用.蛛形学报,2001,10(1):52-56.
[27] 李巧.物种累积曲线及其应用.应用昆虫学报,2011,48(6):1882-1888.
[30] 李巧,陈彦林,高成杰,贝荣塔,尹立红,熊忠平.元谋干热河谷人工林蜘蛛群落多样性比较研究.云南农业大学学报,2008,23(6):731-735
[36] 岳秀泉,周道玮,孙刚.草原火烧后群落小气候的变化.东北师大学报,1999,(1):91-96.
[40] 刘家武,王国秀,刘凯于,杨其仁.天河机场蜘蛛群落结构研究.华中师范大学学报(自然科学版),2001,35(1):68-71.
[41] 朱立敏,张锋,朱明生.小五台山典型生境的蜘蛛群落结构.河北大学学报(自然科学版),2008,28(01):88-91.
[42] 李晓晶,刘玉安,李春辉,刁绍起.缙云山森林演替对节肢动物多样性的影响.东北林业大学学报,2009,37(10):35-39.
[45] 颜亨梅,尹长民,王洪全.武陵山地区蜘蛛群落多样性的研究.湖南师范大学学报(自然科学版),1994,17(3):65-71.
[46] 王宗英,陈发扬,路有成,聂献忠.九华山森林土壤蜘蛛群落的初步研究.生态学报,1997,17(1):71-77.
[47] 劣旺禄,朱明生,宋大祥.张家口土壤蜘蛛群落结构及多样性研究.蛛形学报,1999,8(1):49-54.
[48] 郑国,杨效东,李枢强.西双版纳地区六种林型地表蜘蛛多样性比较研究.昆虫学报,2009,52(8):875-884.
[49] 李宗煦,吴成琼,张志升.中国蜘蛛物种多样性分析.蛛形学报,2011,20(1):46-51.
[50] 杨自忠,毛本勇,徐吉山,苏子峰.滇西横断山区蜘蛛资源及区系分析.大理学院学报,2006,5(2):20-31.
[54] 杨效东,唐勇,唐建纬.热带次生林火烧前后土壤节肢动物群落组成和分布特征的变化.生态学杂志,2001,20(5):32-35.
[57] 张雪萍,张淑花,李景科.大兴安岭火烧遗迹地土壤动物生态地理分析.地理研究,2006,25(2):327-334.
[58] 余广彬,杨效东.不同演替阶段热带森林地表凋落物和土壤节肢动物群落特征.生物多样性,2007,15(2):188-198.
[65] 项凤武.森林土壤生物火烧后恢复情况调查研究.吉林林学院学报,1998,14(2):99-102.
[68] 王洪全,石光波.中国稻田蜘蛛优势种及其成因探讨.蛛形学报,2002,11(2):85-92.
[69] 巴家文,黎道洪.中国洞穴蜘蛛多样性及其对洞穴环境的适应.动物分类学报,2009,34(1):98-105.
