温度、投饵频次对白色霞水母无性繁殖与螅状体生长的影响
2013-12-16李玉龙
孙 明,董 婧,柴 雨,李玉龙
(辽宁省海洋水产科学研究院,辽宁省海洋生物资源与生态学重点实验室,大连 116023)
近年来,全球性水母暴发事件引起了世界各沿海国家政府和科研工作者的高度关注,有关大型水母种群数量变动及暴发成因的相关研究已成为海洋生态学研究的热点之一[1-7]。自20世纪90年代中后期起,我国渤海辽东湾、东海北部和黄海南部海域也相继出现了大型水母暴发现象,因之而起的网具暴破、网眼堵塞、传统渔场无法生产等情况已严重影响了海洋渔业生产,给渔业经济带来巨大损失[8-11]。由于大型水母大量捕食浮游动物,同许多鱼类存在摄食竞争,其暴发性增殖会导致鱼类的饵料生物量急剧下降[12],而且还占据了经济鱼类的生存空间,使渔业资源锐减,严重破坏海洋生态系统平衡,因此,水母暴发性增殖被称为继赤潮之后又一场海洋生态灾害。
白色霞水母(Cyanea nozakii Kishinouye)是我国沿海致灾水母的主要优势种类[9-11],生活史由有性繁殖的浮游水母体和无性繁殖的底栖螅状体行世代交替组成[13-14],螅状体通过无性繁殖扩增螅状体种群数量和碟状幼体数量,进而决定着成体水母种群数量基数。白色霞水母的无性繁殖包括螅状体足囊、囊胞繁殖和横裂生殖,其中,足囊繁殖是螅状体形成足囊后移位至新的附着点,留下的足囊萌发成新的螅状体,此方式留下的足囊痕迹在螅状体的一侧呈线性排列;囊胞繁殖是螅状体长出匍匐茎形成囊胞,匍匐茎断开后囊胞萌发出新的螅状体,此方式留下的囊胞痕迹在螅状体的四周无序排列[13-14]。
大型水母的无性繁殖受外界环境因子(温度、盐度、光照及营养条件等)影响较大[15-16],因此,研究环境条件对水母无性繁殖的影响是探索水母种群数量变化规律的主要方向,也是揭示水母暴发机制的重要科学依据。目前,针对环境因子对大型水母无性繁殖的影响研究,国外对海月水母的研究较详细[17-25],国内主要集中在海蜇的研究[26-34],而对其他大型水母生态学方面的研究甚少。作者曾研究了光照强度、盐度对白色霞水母无性繁殖的影响[35-37],在此基础上,本文初步研究了温度和投饵频次对白色霞水母无性繁殖和螅状体生长的影响,为人工繁殖白色霞水母和自然种群数量调查预报奠定理论基础,为进一步探索大型水母暴发的生态环境机理提供基础科学依据。
1 材料与方法
1.1 试验材料
试验用螅状体为2004年9月在辽东湾捕获白色霞水母亲体进行人工繁殖所得,螅状体附着在30 cm×40 cm的聚乙烯波纹板上,培养于120 cm×60 cm×50 cm的水母专用玻璃缸中。培养用水取自大连市黑石礁海岸,经黑暗沉淀并沙滤后使用,盐度30—32,pH值8.1—8.3,溶解氧大于5 mg/L,水温随室温自然波动(10—25℃),试验开始前一周螅状体的培养水温约为15℃。投喂的饵料是人工孵化的卤虫(Artemia salina)无节幼体,体长约300μm。
1.2 试验方法
将上述波纹板附着有白色霞水母螅状体的区域剪切成约3 cm×5 cm的小片,每片上螅状体个数为3—12个,多数螅状体旁已生成足囊或囊胞。选取螅状体总数量为15个的两个小片设为一个试验组,其中一个小片附着有螅状体的凹面朝下,另一个小片附着有螅状体的凹面朝上,置于300 mL的密封塑料盒中(2片/盒),用画图兼拍照的方法将每盒中的螅状体按所处波纹板的位置进行编号,用以试验观察,并统计每个螅状体旁已生成的足囊、囊胞数量,用以足囊、囊胞萌发观察。
温度试验设6个梯度,即7.5、11、14.5、18、21.5℃和25℃,每2 d充分投喂1次;投饵频次试验设3个梯度(分别在14.5℃、18℃和21.5℃进行),即每2 d充分投喂1次(1次/2d)、每8 d充分投喂1次(1次/8 d)和每16d充分投喂1次(1次/16d),各组均设3个平行。试验在智能光照培养箱(GXZ—280B;GXZ—280C)中进行,各试验组起始温度均为15℃,每隔2 d升温或降温1℃直至达到各试验组所需温度,此期间不进行投喂,但每2 d换水1次(螅状体可正常存活)。
因实验室所用沙滤后的自然海水盐度有波动,参考以往海水盐度对白色霞水母螅状体影响的研究结果[37],用暴晒24 h的自来水将海水盐度调至28作为试验海水盐度,盐度计型号为PAL-06S。试验期间,螅状体每次均进行充分投喂,即用吸满卤虫的吸管对准螅状体喂食,保证每个螅状体都达到食饱状态,投喂2 h后换水。投饵频次为1次/8 d和1次/16 d的试验组每2 d换水1次。每天用解剖镜(Olympus SZX9)观察螅状体的无性繁殖行为,每10d测量1次螅状体的柄径值,连续观察40 d。
1.3 指标测定与数据统计分析
以螅状体柄径增长量作为生长指标,螅状体柄径长:口面观圆周最大水平面的直径大小,当口面观不为圆形时,取几何图形最大径与最小径的平均值[38]。

式中,No为试验开始时的螅状体亲体个数,Nt为试验结束时存活的螅状体亲体个数,Nx为试验结束时螅状体的总数,Ny为试验结束时横裂出的碟状幼体总数,Do、Dt分别为试验开始和结束时螅状体的柄径长(mm),t为试验天数(d),NS为发生横裂生殖的螅状体个数,Pt为试验结束时萌发的足囊个数,Po为试验开始时已有的足囊个数和试验期间形成的足囊个数的总和。
试验数据用平均数±标准差(Mean±SD)表示,用Excel 2003和SPSS 19.0软件对数据进行统计分析,采用Duncan′s多重比较检验组间差异。
2 结果与分析
2.1 温度对白色霞水母无性繁殖的影响
2.1.1 温度对白色霞水母螅状体足囊繁殖的影响
试验过程中,多数螅状体进行的是足囊繁殖,囊胞繁殖仅出现在25℃组,且出现比例较低。针对足囊繁殖,仅18—25℃各组中螅状体有足囊生成现象,且形成足囊的螅状体比例和平均每个螅状体形成的足囊数随温度的升高而增加(表1),经检验组间差异显著(P<0.05,n=45)。低温组(7.5—14.5℃)没有足囊生成。试验期间,温度7.5—18℃各组中的足囊和少数囊胞均未萌发,只有21.5℃和25℃组中有足囊萌发出螅状体,25℃组的足囊萌发率略高于21.5℃组,但组间差异不显著(P>0.05,n=3)。综上,本试验认为,白色霞水母足囊繁殖的适宜温度为18—25℃。

表1 温度对白色霞水母螅状体足囊繁殖和横裂生殖的影响Table 1 Effect of different temperature on podocyst reproduction and strobilation of Cyanea nozakii
2.1.2 温度对白色霞水母横裂生殖的影响
(1)温度对白色霞水母横裂生殖发生时间和横裂率的影响
横裂生殖是白色霞水母螅状体向水母体变态的唯一途径。试验结果显示,温度7.5—18℃各组中的螅状体均没有横裂生殖现象,仅21.5℃和25℃组的螅状体出现横裂生殖,且横裂率(发生横裂生殖的螅状体比例)随温度的升高而增加(表1)。试验在第18天时25℃组中的螅状体最先出现横裂生殖,由图1可知,25℃组螅状体发生横裂时间相对较早,且横裂率始终高于21.5℃组。经检验,温度对螅状体横裂率影响显著(P <0.05,n=45)。
(2)温度对白色霞水母螅状体重复横裂的影响
白色霞水母螅状体横裂为典型的单碟型横裂,螅状体在每次结束横裂生殖后经短暂恢复可继续进行第2次横裂,释放下一个碟状体[13-14]。试验观察到白色霞水母螅状体重复横裂次数随温度的升高而增加,重复横裂间隔时间随温度的升高而缩短。21.5℃组的螅状体最多横裂3次,平均为1.14次,重复横裂生殖的最短时间间隔为5 d,多数时间间隔为10 d—14 d,平均为11 d。25℃组的螅状体最多横裂8次,平均为3.27次(表1)。重复横裂生殖的最短时间间隔为2 d,多数时间间隔为5 d—10 d,平均为8.5 d。此外,发生重复横裂生殖的螅状体比例也随温度的升高而增加,21.5℃组平均为18.79%,25℃组平均为74.88%。
综上,本试验认为,温度越高,白色霞水母发生横裂生殖的时间越早,横裂生殖速度越快,重复横裂次数越多,释放出的碟状体数量越多。
2.2 温度、投饵频次对白色霞水母无性繁殖的联合影响
2.2.1 温度、投饵频次对白色霞水母螅状体足囊繁殖的联合影响
不同温度、投饵频次下白色霞水母的螅状体足囊繁殖指标见表2。14.5℃条件下各投饵频次组中的螅状体均没有无性繁殖现象,21.5℃ 1次/2 d组平均每个螅状体形成的足囊数和形成足囊的螅状体比例最大。18℃和21.5℃条件下,每个螅状体形成的足囊数和形成足囊的螅状体比例随投饵频次的增加而增加,单因素方差分析和多重比较结果表明,各温度、投饵频次组间差异显著,白色霞水母螅状体的各足囊繁殖指标随温度和投饵频次的增加而增加。经双因素方差分析显示(表3),温度和投饵频次单因素影响以及温度与投饵频次的交互作用对白色霞水母螅状体足囊繁殖指标的影响均达到极显著水平(P<0.01,n=45)。

图1 不同温度下白色霞水母横裂率随时间的变化Fig.1 Changes of strobilation rate of C.nozakii at different temperature

表2 不同温度下投饵频次对白色霞水母螅状体足囊繁殖和横裂生殖的影响Table 2 Effect of different feeding frequency on podocyst reproduction and strobilation of C.nozakii at different temperature

表3 螅状体足囊繁殖指标的方差分析Table 3 Analysis results of polyps podocyst reproduction indices
2.2.2 温度、投饵频次对白色霞水母横裂生殖的联合影响
14.5℃和18℃条件下各投饵频次组中的螅状体均未发生横裂生殖(表2)。21.5℃与1次/2 d组螅状体的横裂率和横裂次数最多,21.5℃与1次/8 d组中仅有一个螅状体横裂了一个碟状体,横裂率和横裂次数随投饵频次的增加而递增,但组间差异不显著(P>0.05,n=45)。经双因素方差分析显示(表4),温度单因素作用以及温度与投饵频次的交互作用对白色霞水母螅状体横裂率的影响显著(P<0.05,n=45),温度对白色霞水母螅状体横裂次数的影响显著(P<0.05,n=45)。
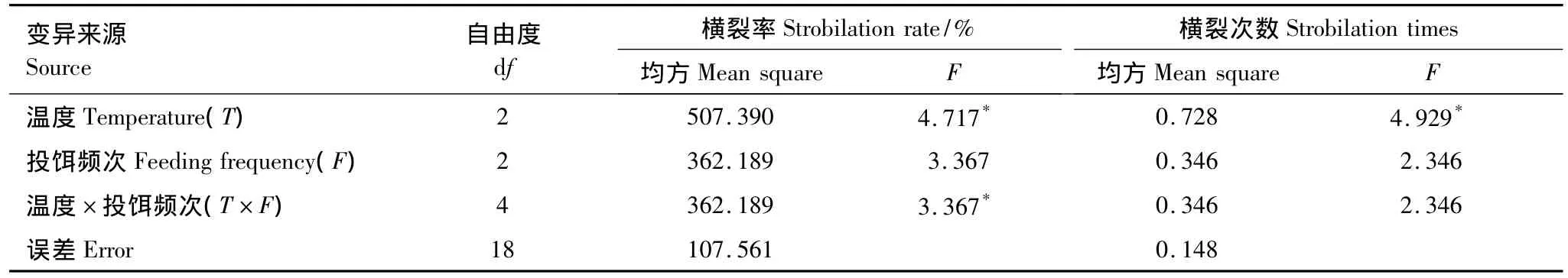
表4 横裂生殖指标的方差分析Table 4 Analysis results of strobilation indices
2.3 温度对白色霞水母螅状体生长的影响
试验期间各组螅状体成活率均为100%,螅状体初始柄径范围为0.30—2.00 mm,平均为0.97 mm。试验在进行至第18天时温度25℃组螅状体最先出现横裂现象,由于螅状体在发生横裂生殖后体积会缩小,所以当各组螅状体出现横裂生殖时生长试验结束,此时螅状体的柄径范围为0.40—2.50 mm,平均为1.32 mm。各组螅状体的相对增长率和特定生长率可直观反映螅状体的生长情况(图2,图3)。试验结果显示,温度7.5℃组各生长指标值最小,各生长指标随温度升高而增加。试验中,仅21.5℃和25℃组的螅状体发生横裂生殖。取试验第10天时各组的生长指标建立相对增长率和特定生长率与温度关系的散点图(图4,图5),发现螅状体相对增长率和特定生长率与温度呈线性相关,相对增长率与温度的关系为y=1.6469x-8.6845(n=6,r=0.9917,P <0.01),特定生长率与温度的关系为 y=0.1348x-0.6221(n=6,r=0.9926,P <0.01)。方差分析结果表明,温度对螅状体各生长指标影响极显著(P<0.01,n=45)。综上,本试验认为,白色霞水母螅状体在7.5—25℃范围内可正常存活生长,其生长速度随温度的升高而增加。
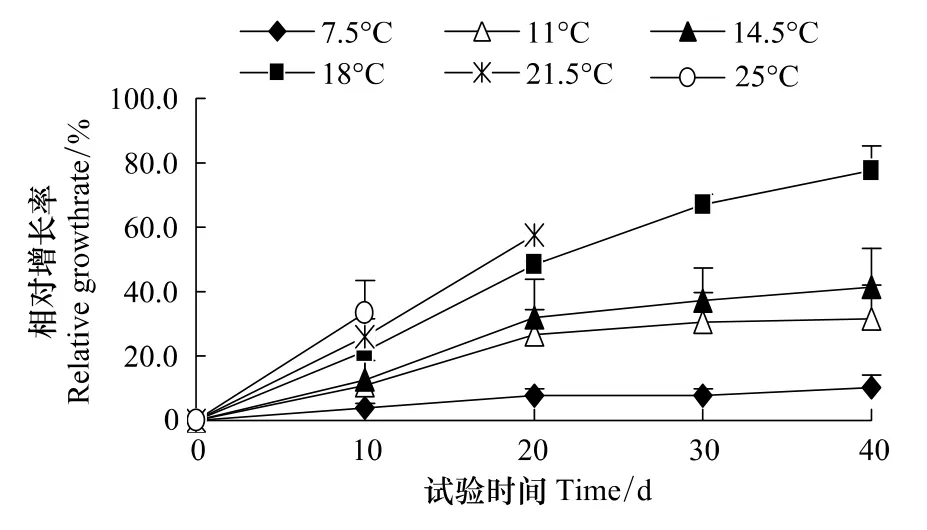
图2 不同温度下白色霞水母螅状体相对增长率随时间的变化Fig.2 Changes of relative growth rate of C.nozakii polyps at different temperature

图3 不同温度下白色霞水母螅状体特定生长率随时间的变化Fig.3 Changes of specific growth rate of C.nozakii polyps at different temperature
2.4 温度、投饵频次对白色霞水母螅状体生长的联合影响
试验期间各组螅状体成活率均为100%。各组中仅21.5℃与1次/2 d组的螅状体于试验第25天出现横裂生殖,其他各组中的螅状体均没有出现横裂生殖,因此取第20天时各组中螅状体的柄径值来分析其生长情况。不同温度、投饵频次下螅状体的各生长指标见表5。其中21.5℃与1次/2 d组的相对增长率和特定生长率最大,14.5℃与1次/16 d组最小,单因素方差分析和多重比较结果表明,各温度、投饵频次组间差异显著,白色霞水母螅状体的生长速度随温度和投饵频次的增加而增加。经双因素方差分析显示(表6),温度和投饵频次单因素影响以及温度与投饵频次的交互作用对白色霞水母螅状体各生长指标的影响均达到极显著水平(P <0.01,n=45)。

图4 温度对白色霞水母螅状体相对增长率的影响Fig.4 Effect of temperature on relative growth rate of C.nozakii polyps

图5 温度对白色霞水母螅状体特定生长率的影响Fig.5 Effect of temperature on specific growth rate of C.nozakii polyps
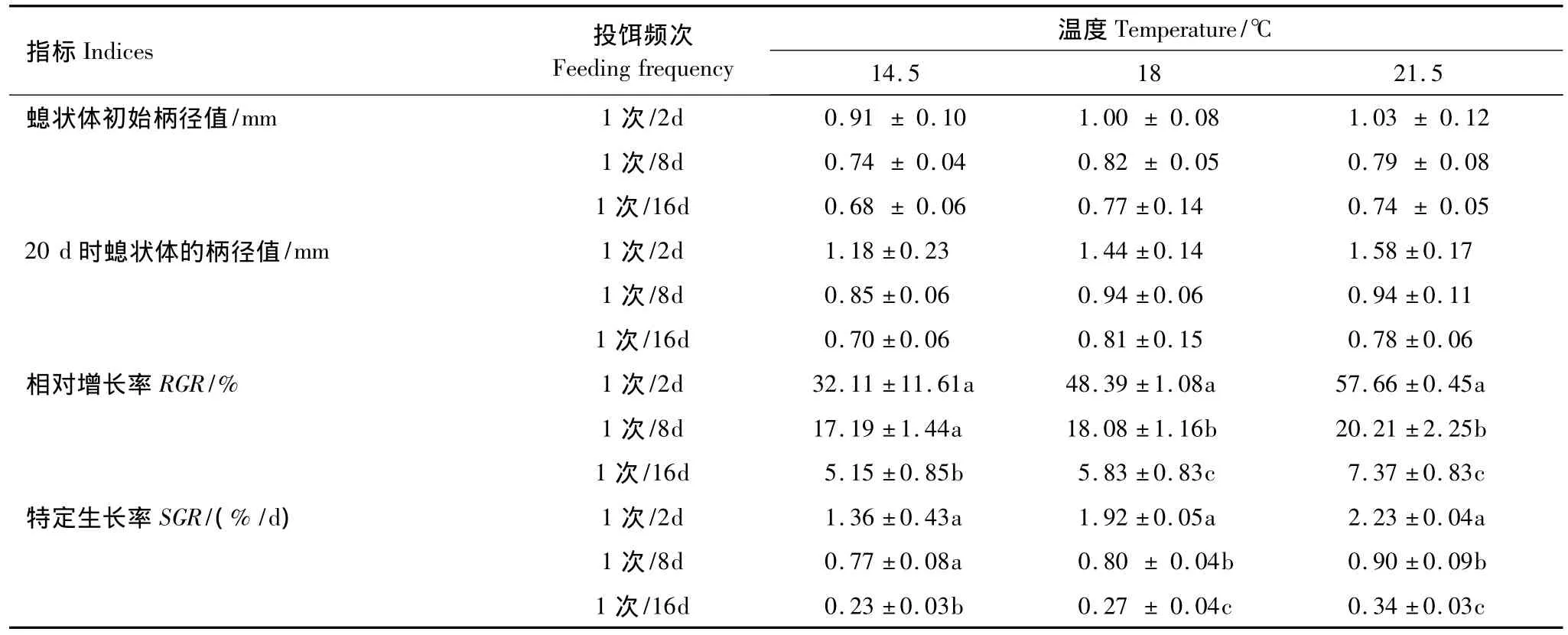
表5 不同温度、投饵频次下白色霞水母螅状体的相对增长率和特定生长率Table 5 The relative growth rate and specific growth rate of C.nozakii polyps at different temperature and feeding frequency

表6 生长指标的方差分析Table 6 Analysis results of growth indices
2.5 白色霞水母螅状体横裂前柄径大小与横裂次数、初生碟状幼体伞径的关系
试验观察发现,较大的螅状体更容易发生多次横裂,根据对螅状体在第一次横裂前的柄径与试验结束时的横裂次数观测结果,建立螅状体柄径与横裂次数关系的散点图,经线性拟合,发现二者具有良好的线性关系(图6)。表明螅状体大小与其横裂次数密切相关,螅状体的横裂次数随柄径增大而递增。这可能是由于个体较大的螅状体更易于提供多次横裂生殖所消耗的能量。
试验中观察到同样为刚初生的1日龄碟状幼体其伞径大小可相差近2倍,最大为6.5 mm,最小为2.2 mm。根据对螅状体每次横裂前的柄径大小与初生1日龄碟状幼体伞径大小的观测结果,建立螅状体柄径与初生碟状体伞径关系的散点图,经线性拟合,发现二者具有良好的线性关系(图7)。表明螅状体大小与其横裂出的碟状幼体大小密切相关,初生碟状幼体伞径随螅状体柄径增大而递增。
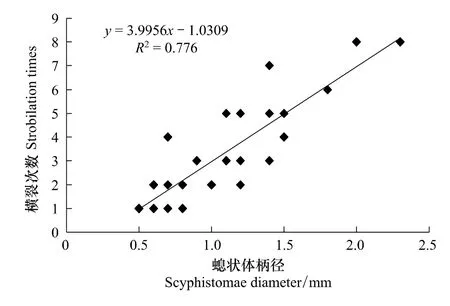
图6 螅状体柄径与横裂次数关系Fig.6 Relationship between diametre and strobilation times of C.nozakii polyps

图7 螅状体柄径与初生碟状体伞径关系Fig.7 Relationship between polyps diameter and ephyrae primary diameter of C.nozakii
3 讨论
3.1 白色霞水母的足囊繁殖需要有足够的营养作为基础
足囊繁殖是一些钵水母类螅状体无性繁殖新螅状体的一种重要方式,其发生所需要的环境条件因种类不同而各有差异。通常认为不良的环境条件是诱导足囊生成的起始条件[39-40],因为足囊可以长期经受不利条件后重新萌发出新螅状体,例如旗口水母目的海月水母(Aurelia aurita s.l.)螅状体在低饵料供应量和高温条件下易生成足囊[38],饵料匮乏是海月水母螅状体生成足囊的诱导条件[38,40]。五卷须金黄水母(Chrysaora quinquecirrha)螅状体在缺氧、快速降温到4℃以下、慢速升温到34—36℃之间、盐度升高到30以上或降到5以下4种不良环境条件时生成足囊[39]。相反,根口水母目的海蜇(Rhopilema esculentum)螅状体进行足囊繁殖需要有足够的营养作为基础[30],在水温低于10℃时不形成足囊,15—30℃范围内,足囊繁殖随温度的升高而增加[29]。在本试验中,白色霞水母螅状体的足囊繁殖随温度(18—25℃)和饵料频次的增加而增加,说明白色霞水母的足囊繁殖与海蜇类似,需要有足够的营养作为基础,无需不良环境因子诱导。温度和营养水平是决定白色霞水母足囊繁殖的关键因素。
根据试验结果,本试验认为白色霞水母足囊繁殖的适宜温度为18—25℃,此结论较粗略,应进一步确认14.5—18℃之间的温度是否适宜白色霞水母进行足囊繁殖。对温度和投饵频次的交互试验也应增加试验组数量才能更充分说明问题。此外,试验中多数螅状体进行的是足囊繁殖,囊胞繁殖仅出现在25℃组,且出现比例非常小,原因可能与温度所设范围及试验时间不够长有关,还应考虑盐度、光照等其他环境条件,今后有待对白色霞水母囊胞繁殖的适宜环境条件进行详细的研究。
3.2 温度和营养条件是白色霞水母发生横裂生殖的关键因素
横裂生殖是大多数钵水母从螅状体变态发育成水母体所必须经历的一个过程。在众多影响钵水母横裂生殖的环境条件(温度、营养、盐度、光照、溶氧、碘和碘化钾、pH值和共生生物等)中,温度和营养水平被认为是最重要的影响因素[15,26,28,38,41]。国内有关温度和营养条件对海蜇横裂生殖影响的研究较多,陈介康[26]最先报道了升温或降温可以有效地诱导或抑制海蜇螅状体发生横裂生殖。长期饥饿的海蜇螅状体若不改善营养条件,则不能诱发横裂生殖,足够的营养储备是海蜇横裂生殖的基础[28]。张鑫磊[31]指出温度是影响海蜇横裂生殖的主要因素。游奎[33]研究发现,短期低温处理可诱导海蜇螅状体较整齐地进行横裂生殖。长期低温保育可以有效地保持和恢复海蜇的横裂生殖能力[34]。国外有关海月水母横裂生殖的研究较多,因海月水母广泛分布于全球许多海域,对环境的适应能力较强,其无性繁殖的生态特性十分复杂,研究结果差异较大,但多数研究表明,横裂生殖的产生主要归因于水温变化、饵料供应及光照条件[15]。本研究中,白色霞水母的横裂率随投饵频次的增加而递增,说明足够的营养储备是白色霞水母发生横裂生殖的必备条件。温度与投饵频次的交互作用对白色霞水母螅状体横裂率的影响显著(P<0.05,n=45),说明温度和营养水平互为条件共同影响白色霞水母的横裂生殖。这与上述研究结果基本相符。已有研究表明,温度可决定横裂生殖的发生时间,温度每降低5℃,五卷须金黄水母(Chrysaora quinquecirrha)发生横裂生殖的时间就延迟1周[41]。高温可加速海月水母的横裂生殖,增加日横裂碟状体量[17]。温度越高,海蜇的横裂高峰越早,释放碟状体的数量越多[42]。本研究表明,温度越高,白色霞水母发生横裂生殖的时间越早,螅状体发生重复横裂生殖的次数越多,印证了上述温度决定横裂生殖发生时间的观点。
以往的试验研究表明,白色霞水母发生横裂生殖的温度为17℃[36],在日常培养过程中,曾发现白色霞水母螅状体有在15℃条件下发生横裂生殖的现象,这与本试验研究结果有所差异,原因可能归咎于变温与恒温对水母横裂生殖影响的差异。许多研究表明,环境变化是产生横裂生殖的诱导条件[20,26-28,33-34,42-43],所以试验起始温度的差异对横裂生殖结果的影响是必须考虑的因素,本文研究的是不同恒定温度对白色霞水母横裂生殖的影响,试验开始前螅状体的暂养温度是15℃,这与自然海区螅状体的越冬温度和实际经历的变温过程截然不同,而模拟自然海区各生态环境变化条件对白色霞水母横裂生殖影响的研究也是今后应深入研究的主要内容。
试验未观察到白色霞水母螅状体因横裂生殖而死亡的现象,说明自然海区中白色霞水母螅状体在良好的环境下可能会一直存活于海底,螅状体死亡的原因应主要考虑低温、食物供应不足或敌害生物等原因,而与横裂生殖关系不大。
3.3 白色霞水母螅状体在横裂前的个体大小可影响水母种群数量
本研究表明,白色霞水母螅状体在7.5—25℃范围内可正常存活生长,其生长速度随温度和投饵频次的增加而增加,这与海月水母不同,海月水母螅状体生长速度随饵料供应量增加而增加,却随温度的增加而减小[20,38]。已有研究表明,螅状体个体大小与其横裂出的碟状体数量密切相关,海月水母螅状体个体越大,横裂生殖所释放的碟状体数量越多[38,44-45],海蜇螅状体长度与其形成的碟状幼体数量呈直线相关[26]。本研究表明,白色霞水母螅状体的横裂次数、初生碟状幼体伞径随螅状体横裂前柄径的增大而递增,说明螅状体在发生横裂生殖前个体越大,体内所储备的供横裂生殖的能量越多,横裂出的碟状幼体数量越多。螅状体前期自身大小的生长阶段是其随后进行无性繁殖的“储能期”,温度、营养水平等环境条件对这一时期的作用结果可直接影响到螅状体种群数量、横裂次数和碟状幼体的大小,间接影响着年际同期水母种群密度和生物量大小。
3.4 温度和营养条件对白色霞水母无性繁殖的影响是其种群数量变动的主要原因之一
在白色霞水母无性繁殖过程中,螅状体生成的足囊、囊胞数量和足囊、囊胞萌发率决定着新补充的螅状体数量,螅状体的横裂率和横裂次数决定着释放的碟状体数量。在本试验中,25℃与1次/2 d组的螅状体繁殖倍数(1.433)和无性繁殖倍数(4.245)最大,21.5℃与1次/8d组的无性繁殖倍数最小(0.014),两组最终释放的碟状体数量相差293倍,有力地说明温度和饵料供应条件对水母数量的显著影响。因试验时间的限制未观察到有第3代螅状体生成,此无性繁殖过程仅为倍数增长,而在自然水域中,螅状体可通过足囊、囊胞繁殖出许多代子螅状体,这些螅状体亦可以再进行足囊、囊胞繁殖,最终进行横裂生殖时所释放出的碟状体数量则是指数增长。在自然水域中,如果水母种群在某种最优环境条件下出现这种连续的指数增长,其数量在短时间内大大超过水母种群的正常波动范围,就形成了水母数量暴发。目前研究表明,大型水母种群数量暴发成因绝不是某单一环境因子决定的,各环境因子对水母复杂生活史各阶段的综合影响是探索大型水母暴发的生态环境机理的主要内容,而环境因子对水母无性繁殖指数增长影响的研究则应该是揭示水母数量暴发原因的核心内容。白色霞水母的无性繁殖受光照[35-36]、盐度[37]的影响,也可能还与其他一些环境因子有关,例如栖息地环境、底栖生物的空间竞争、食物链上级捕食者的下行控制等。但本研究结果至少可得出的结论是,温度、投饵频次即营养条件可显著影响白色霞水母的种群数量,海水水温上升、富营养化或渔业资源锐减导致的浮游动物量增加均可能诱发白色霞水母暴发性增殖现象。
[1] Kawahara M,Uye S,Ohtsu K,Iizumi H.Unusual population explosion of the giant jellyfish Nemopilema nomurai(Scyphozoa:Rhizostomeae)in East Asian waters.Marine Ecology Progress Series,2006,307:161-173.
[2] Purcell J E,Uye S,Lo W T.Anthropogenic causes of jellyfish blooms and their direct consequences for humans:a review.Marine Ecology Progress Series,2007,350:153-174.
[3] Uye S,Ueta U.Recent increase of jellyfish populations and their nuisance to fisheries in the inland sea of Japan.Bulletin of the Japanese Society of Fisheries Oceanography,2004,68(1):9-19.
[4] Mills C E.Medusae,siphonophores,and ctenophores as planktivorous predators in changing global ecosystems.ICES Journal of Marine Science,1995,52(3/4):575-581.
[5] Brodeur R D,Mills C E,Overland J E,Walters G E,Schumacher J D.Evidence for a substantial increase in gelatinous zooplankton in the Bering Sea,with possible links to climate change.Fisheries Oceanography,1999,8(4):296-306.
[6] Mills C E.Jellyfish blooms:are populations increasing globally in response to changing ocean conditions?Hydrobiologia,2001,451(1/3):55-68.
[7] Nagai T.Recovery of fish stocks in the Seto Inland Sea.Marine Pollution Bulletin,2003,47(1/6):126-131.
[8] Ding F Y,Chen J H.Dynamic distribution of Stomolophus meleagris in the East China Sea Region.Journal of Fishery Sciences of China,2007,14(1):83-89.
[9] Cheng J H,Ding F Y,Li S F,Yan L P,Lin J Z,Li J S,Liu Y.A study on the quantity distribution of macro-jellyfish and its relationship to seawater temperature and salinity in the East China Sea Region.Acta Ecologica Sinica,2005,25(3):440-445.
[10] Zhong X M,Tang J H,Liu P T.A study on the relationship between Cyanea nozakii Kisninouye breaking out and ocean ecosystem.Modern Fisheries Information,2004,19(3):16-18.
[11] Dong J,Liu C Y,Li W Q,Yu H B,Wang B,Wang Y Q.The Morphology and Structure of Jellyfish(Cyanea nozakii Kishinouye).Fisheries Science,2005,24(2):22-23.
[12] Greve W.The 1989 German Bight invasion of Muggiaea atlantica.ICES Journal of Marine Science,1994,51(4):355-358.
[13] Dong J,Wang B,Liu C Y.Morphology of Cyanea nozakii in different developmental stages.Journal of Fisheries of China,2006,30(6):761-766.
[14] Dong J,Liu C Y,Wang Y Q,Wang B.Laboratory observations on the life cycle of Cyanea nozakii(Semeostomida,Scyphozoa).Acta Zoologica Sinica,2006,52(2):389-395.
[15] Lucas C H.Reproduction and life history strategies of the common jellyfish,Aurelia aurita,in relation to its ambient environment.Hydrobiologia,2001,451(1/3):229-246.
[16] Purcell J E.Environmental effects on asexual reproduction rates of the scyphozoan,Aurelia labiata.Marine Ecology Progress Series,2007,348:183-196.
[17] Liu W C,Lo W T,Purcell J E,Chang H H.Effects of temperature and light intensity on asexual reproduction of the scyphozoan,Aurelia aurita(L.)in Taiwan.Hydrobiologia,2009,616(1):247-258.
[18] Purcell J E.Environmental effects on asexual reproduction rates of the scyphozoan Aurelia labiata.Marine Ecology Progress Series,2007,348:183-196.
[19] Purcell J E,Hoover R A,Schwarck N T.Interannual variation of strobilation by the scyphozoan Aurelia labiata in relation to polyp density,temperature,salinity,and light conditions in situ.Marine Ecology Progress Series,2009,375:139-149.
[20] Willcox S,Moltschaniwskyj N A,Crawford C.Asexual reproduction in scyphistomae of Aurelia sp.:effects of temperature and salinity in an experimental study.Journal of Experimental Marine Biology and Ecology,2007,353(1):107-114.
[21] Ishii H,Ohba T,Kobayashi T.Effects of low dissolved oxygen on planula settlement,polyp growth and asexual reproduction of Aurelia aurita.Plankton and Benthos Research,2008,3(Suppl):107-113.
[22] Ishii H,Watanabe T.Experimental study of growth and asexual reproduction in Aurelia aurita polyps.Sessile Organisms,2003,20(2):69-73.
[23] Keen S L,Gong A J.Genotype and feeding frequency affect clone formation in a marine cnidarian(Aurelia aurita Lamarck 1816).Functional Ecology,1989,3(6):735-745.
[24] Custance D R N.Light as an inhibitor of strobilation in Aurelia aurita.Nature,1964,204(4964):1219-1220.
[25] Ishii H,Shioi H.The effects of environmental light condition on strobilation in Aurelia aurita polyps.Sessile Organisms,2003,20(2):51-54.
[26] Chen J K,Ding G W.Effect of temperature on the strobilation of jellyfish(Rhopilema esculenta Kishinouye-Scyphozoa,Rhizostomeae).Acta Zoologica Sinica,1983,29(3):l95-206.
[27] Chen J K,Ding G W,Liu C Y.Effect of light on the strobilation of edible medusa,Rhopilema esculenta Kishinouye(Cnidaria,Scyphozoa).Oceanologia Et Limnologia Sinica,1984,15(4):310-315.
[28] Chen J K,Ding G W,Liu C Y.Effect of nutritional conditions on the strobilation of edible medusa,Rhopilema esculenta Kishinouye.Journal of Fisheries of China,1985,9(4):321-329.
[29] Lu N,Jiang S,Chen J K.Effect of temperature,salinity and light on the podocyst generation of Rhopilema esculenta Kishinouye.Fisheries Science,1997,16(1):3-8.
[30] Guo P.Effect of nutritional condition on the formation and germination of the podocyst of scyphistomae of Rhopilema esculenta Kishinouye.Journal of Fisheries of China,1990,14(3):206-211.
[31] Zhang X L,Cheng Y X,Chen S Q,Chen Y C,Zhang Y.The effect of temperature on strobilation and early stage growth of jellyfish,Rhopilema esculenta.Journal of Shanghai Fisheries University,2006,15(2):182-185.
[32] Yu S T Liu Q X.Effect of environmental factors on podocyst propagation and strobilation of jellyfish.Shandong Fisheries,2008,25(1):4-8.
[33] You K,Ma C H,Wang S J,Gao T X,Yao Z H,Wang X W.The effect of short term low temperature on strobilation of jellyfish,Rhopilema esculenta Kishinouye.Acta Hydrobiologica Sinica,2010,34(6):1223-1227.
[34] You K,Wang S J,Ma C H,Gao T X,Wang Y Z,Yang C H.Long-term low temperature effect on jellyfish strobilation.Advances in Marine Science,2011,29(2):215-220.
[35] Sun M,Dong J,Liu C Y,Wang B.Effect of illumination on growth of scyphistoma in jellyfish Cyanea nozakii.Fisheries Science,2009,28(7):399-401.
[36] Sun M,Dong J,Wang A Y.Effects of light intensity on asexual reproduction of the syphozoan,Cyanea nozakii Kishinouye.Oceanologia Et Limnomologia Sinica,2012,43(3):562-567.
[37] Dong J,Sun M,Wang B.Effects of salinity on growth and strobilation of scyphistoma and ephyae in jellyfish,Cyanea nozakii Kishinouye.Oceanologia Et Limnomologia Sinica,2012,43(3):556-561.
[38] Han C H,Uye S.Combined effects of food supply and temperature on asexual reproduction and somatic growth of polyps of the common jellyfish Aurelia aurita s.l..Plankton and Benthos Research,2010,5(3):98-105.
[39] Cargo D G,Schultz L P.Notes on the biology of the sea nettle,Chrysaora quinquecirrha,in Chesapeake Bay.Chesapeake Science,1966,7(2):95-100.
[40] Chapman D M.Further observations on podocyst formation.Journal of the Marine Biological Association of the United Kingdom,1970,50(1):107-111.
[41] Purcell J E,White J R,Nemazie D A,Wright D A.Temperature,salinity and food effects on asexual reproduction and abundance of the scyphozoan Chrysaora quinquecirrha.Marine Ecology Progress Series,1999,180:187-196.
[42] Wu Y,Li S F,Yan L P,Jiang Y Z,Cheng J H.Effects of temperature and salinity on asexual reproduction of Rhopilema esculenta.Journal of Anhui Agricultural Sciences,2009,37(24):11414-11418.
[43] Chen J K,Ding G W.On the seasonal regularity of strobilation of edible medusa.Journal of Fisheries of China,1984,8(1):55-67.
[44] Spangenberg D B.New observations on Aurelia.Transactions of the American Microscopical Society,1964,83(4):448-455.
[45] Gong A J.Allocations to Clonal Replication in a Marine Scyphozoan(Aurelia)[D].California:University of California,2001.
[45] Gong A J.Allocations to Clonal Replication in a Marine Scyphozoan(Aurelia)[D].California:University of California,2001.
参考文献:
[8] 丁峰元,程家骅.东海区沙海蜇的动态分布.中国水产科学,2007,14(1):83-89.
[9] 程家骅,丁峰元,李圣法,严利平,凌建忠,李建生,刘勇.东海区大型水母数量分布特征及其与温盐度的关系.生态学报,2005,25(3):440-445.
[10] 仲霞铭,汤建华,刘培廷.霞水母(Cyanea nozakii Kisninouye)暴发与海洋生态之关联性探讨.现代渔业信息,2004,19(3):16-18.
[11] 董婧,刘春洋,李文泉,于洪彬,王彬,王燕青.白色霞水母的形态与结构.水产科学,2005,24(2):22-23.
[13] 董婧,王彬,刘春洋.白色霞水母各发育阶段的形态.水产学报,2006,30(6):761-766.
[26] 陈介康,丁耕芜.温度对海蜇横裂生殖的影响.动物学报,1983,29(3):195-206.
[27] 陈介康,丁耕芜,刘春洋.光对海蜇横裂生殖的影响.海洋与湖沼,1984,15(4):310-315.
[28] 陈介康,丁耕芜,刘春洋.营养条件对海蜇横裂生殖的影响.水产学报,1985,9(4):321-329.
[29] 鲁男,蒋双,陈介康.温度、盐度和光照对海蜇足囊繁殖的影响.水产科学,1997,16(1):3-8.
[30] 郭平.营养条件对海蜇螅状体形成足囊及足囊萌发的影响.水产学报,1990,14(3):206-211.
[31] 张鑫磊,成永旭,陈四清,陈艳翠,张岩.温度对海蜇横裂生殖和早期生长的影响.上海水产大学学报,2006,15(2):182-185.
[32] 于守团,刘清信.不同环境对海蜇螅状幼体足囊繁殖和横裂生殖影响的研究.齐鲁渔业,2008,25(1):4-7.
[33] 游奎,马彩华,王绍军,高天翔,姚振华,王晓雯.短期低温条件对海蜇横裂生殖的影响.水生生物学报,2010,34(6):1223-1227.
[34] 游奎,王绍军,马彩华,高天翔,王云中,杨翠华.长期低温条件对海蜇横裂生殖的影响.海洋科学进展,2011,29(2):215-220.
[35] 孙明,董婧,刘春洋,王彬.光照对白色霞水母螅状体生长的影响.水产科学,2009,28(7):399-401.
[36] 孙明,董婧,王爱勇.光照强度对白色霞水母(Cyanea nozakii Kishinouye)无性繁殖的影响.海洋与湖沼,2012,43(3):562-567.
[37] 董婧,孙明,王彬.盐度对白色霞水母(Cyanea nozakii Kishinouye)生长和横裂生殖的影响.海洋与湖沼,2012,43(3):556-561.
[42] 吴颖,李圣法,严利平,姜亚洲,程家骅.温度·盐度对海蜇无性生殖的影响.安徽农业科学,2009,37(24):11414-11418.
[43] 陈介康,丁耕芜.海蜇横裂生殖的季节规律.水产学报,1984,8(1):55-67.
