植物病原菌拮抗性野生艾蒿内生菌的分离、筛选和鉴定
2013-12-16徐亚军赵龙飞蒋晓瑞韦革宏
徐亚军,赵龙飞,*,陈 普,蒋晓瑞,韦革宏
(1.商丘师范学院生命科学学院,河南省高校植物与微生物互作重点实验室,河南省高校生物质降解与气化工程技术研究中心,商丘 476000;2.西北农林科技大学生命科学学院,旱区作物逆境生物学国家重点实验室,杨凌 712100)
野生艾蒿(Artemisia argyi Levl.et Vant)是一种菊科(Asteraceae)多年生半灌木状草本药用植物,在我国的东北、华北、华东、华南、西南以及陕西及甘肃等地区都有广泛的分布。在干旱、半干旱的高温条件下,由于艾蒿类植物有很强的适应性,尤其具有耐风蚀、耐高温、抗严寒,加之具有较高的生物量、根系粗壮、木质化、水平根系发达等特点,是一种优良的水土保持植物,对生态环境的保护和恢复起到非常重要的作用。
艾蒿中主要化学成分为挥发油类、黄酮类、桉叶烷类和三萜类等化合物,对其活性研究表明,艾蒿中的黄酮类化合物具有抗氧化、清除自由基、抗癌和抑菌等多种生物活性[1]。对野生艾蒿资源开发已有许多研究,孙天竹[2]对野生艾蒿的色素提取方法、稳定性测试及提高色素稳定性进行了研究;顾小卫[3]研究了野生艾蒿中如何提取挥发油,张玲春[4]等测定了艾蒿粗提物对甜菜夜蛾的胃毒作用,以及与其它药剂及几种增效剂的联合作用;艾蒿茎、叶的水浸提液对冰草和披碱草幼苗芽长和根长具有显著的化感作用[5]。利用水浸提法制得的艾蒿提取液对大肠杆菌[6]、金黄色葡萄球菌[7]进行试验,结果表明对两种病原细菌都有很好的抑制活性。
植物内生菌(Endophyte)是指在其生活史的一定阶段或全部阶段生活于植物的各种组织和器官的细胞间隙或细胞内的微生物,是一种重要的微生物资源,也是新型天然活性物质的重要来源之一。目前,已报道在各种农作物及经济作物中发现的植物内生细菌有革兰氏阳性菌和革兰氏阴性杆菌,分属于54个属的129种,除根瘤菌外,大多为土壤微生物种类,其中假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、类芽孢杆菌属(Paenibacillus)、肠杆菌属(Enterobacter)以及土壤杆菌属(Agrobacterium)、泛菌属(Pantoea)、固氮菌属(Diazotrophicus)等最为常见,这些内生菌几乎存在植物的所有组织中。植物内生菌侵入寄主植物后,不易受环境条件的影响,具有稳定的生存空间,可在其中定殖和运转。其中,一些植物内生菌是很好的生防资源,它们的防病机理主要表现在通过产生抗生素类、水解酶类、植物生长调节剂和生物碱类物质,与病原菌竞争营养物质或空间,增强宿主植物的抵抗力以及诱导植物产生系统抗性等途径抑制病原菌生长[8]。
在特定的环境和生理条件下,内生菌不仅能胁迫促进寄主植物体内次生代谢产物的形成和累积,而且自身也可产生与宿主相同或不同的生理活性物质[9]。然而,目前国内外对药用植物艾蒿的研究多集中在生物学特性上[10],但对该植物内生细菌资源的研究相对较少。由于内生菌和宿主经长期的协同进化形成了互惠互利的关系,二者在代谢和理化方面存在密切的合作。其内生菌的抑菌能力是否因为受到植物特殊营养成分刺激而加强,目前相关报道还很有限,因此系统地研究艾蒿内生菌资源,探索其对当地植物病原真菌的拮抗作用,筛选有抑菌活性的内生菌,为进一步研发生物接菌剂、生物防治剂和维持生态平衡提供理论基础。
1 材料与方法
1.1 材料
野生艾蒿于2012年5月份采自河南省商丘市梁园区西部郊区荒地。植株处于营养生长期,植株周围有杂草生长。采样地地理坐标为:N34°25—36'、E115°37—40',海拔52m,地势平坦,排水状况良好,土壤干燥,系沙壤土,pH7.8。
植物病原菌:棉花枯萎病菌FO101(Fusarium oxysporum)、稻瘟病菌MG102(Magnaporthe grisea)、烟草赤星病菌AA103(Alternaria alternata)由西北农林科技大学生命科学学院微生物学教研室惠赠,以菌核的形式保藏在-70℃冰箱中,传代培养采用马铃薯葡萄糖琼脂培养基(PDA),28℃培养2d。
1.2 方法
1.2.1 野生艾蒿内生菌的分离、纯化
组织表面消毒参考文献[11-12],内生菌分离和纯化采用平板涂布法,平板上长出的单菌落经染色、镜检,保藏于试管斜面中备用。
1.2.2 抑菌活性测定
对内生菌抑菌活性的初筛、复筛采用对峙法[13]。抑菌率按照公式计算,抑菌率=[(对照菌落直径-处理菌落直径)/对照菌落直径]×100%。初筛出优良菌株进行复筛,过程如初筛,每个处理3个重复。
1.2.3 微生物生理生化特性、菌落特征和细胞形态特征的测定
按照东秀珠[14]方法对所分离的菌株进行生理生化特性、形态特征、革兰氏染色、芽孢染色和菌体大小等指标的测试。
1.2.4 16S rDNA序列测定及系统发育分析
采用细菌基因组DNA试剂盒OSR-M502(天根生化科技有限公司生产)提取细菌基因组DNA,并以之为模板,进行16S rDNA的扩增。所用引物、扩僧体系、反应条件见参考文献[13],扩增产物送上海生物工程技术服务公司测序,根据测序结果,将扩增得到的序列在GenBank中进行BLAST分析,用DNAMAN6.0进行序列相似性分析,通过Clustal-X1.81和TREECONW软件(version 1.3b),以Neighbor-joining方法构建系统发育树,用Bootstrap(1000次重复)进行检验。
1.2.5 病原菌菌丝的显微观察
把菌落直接放置于倒置显微镜的载物台,观察处理菌株和对照菌株菌丝体的形态变化,记录并拍照。
2 结果与分析
2.1 初筛实验结果分析
从根、茎、叶中分离到的内生菌,分别对棉花枯萎病菌、稻瘟病菌、烟草赤星病菌进行抑菌试验,初筛结果(表1)表明:对3种植物病原菌具有抑制作用的内生菌的数量分布上差别不大,而野生艾蒿内生菌中对不同病原真菌有抑制作用的数量存在差异。由此可见,对不同植物病菌来说,同一种植物内有抑菌作用的内生菌的抑菌广谱性方面存在差异。
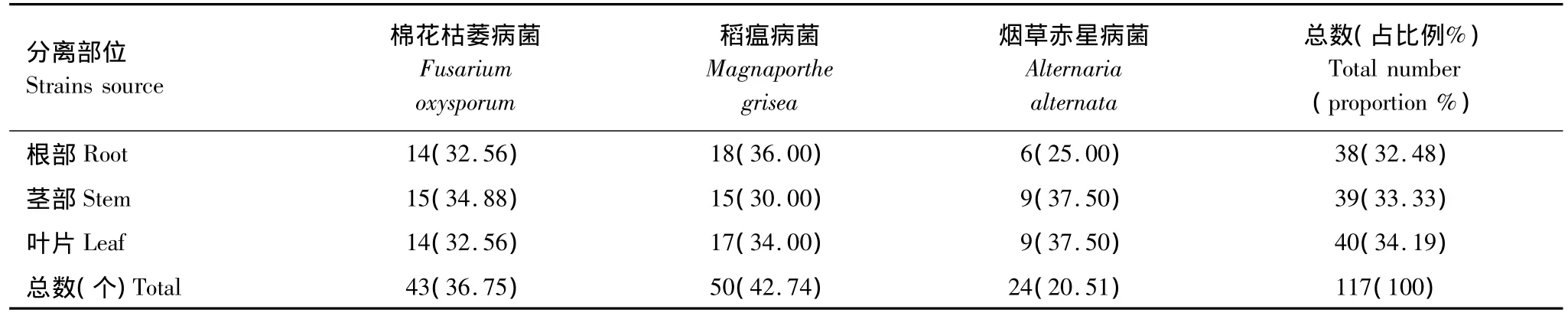
表1 根茎叶部位对植物病原菌有抑菌作用内生菌的数量及所占比例Table 1 The number and percent of inhibiting endophytes from different parts of plant to pathogenic bacteria
2.2 复筛实验结果分析

图1 分离菌株R6对棉花枯萎病菌FO101的抑制作用(左图为对照)Fig.1 Fusarium oxysporum FO101 inhibited by endophyte R6(Left:control)

图2 分离菌株S11对烟草赤星病菌AA103的抑制作用(左图为对照)Fig.2 Alternaria alternata AA103 inhibited by endophyte S11(Left:control)
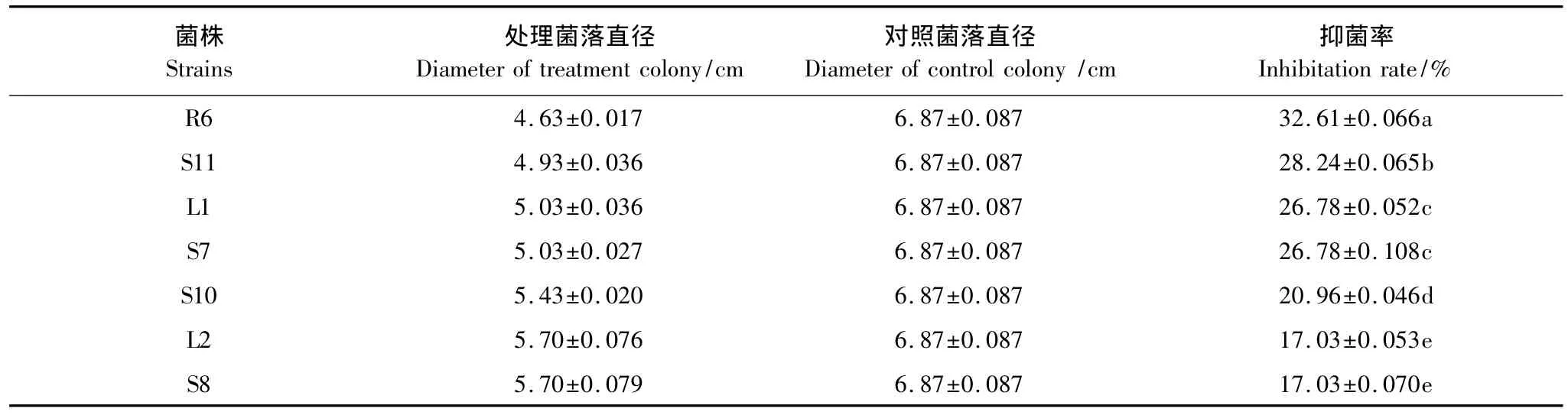
表2 内生菌对棉花枯萎病菌的抑菌效果Table 2 Inhibition effect of endophytes to Fusarium oxysporum
分别筛选出抑菌现象明显(抑菌率达20%以上)(图1、图2)的菌株进行复筛。每个平板做3个重复,培养72h后分别测定菌落直径大小,取3个重复的平均值,代入抑菌率计算公式,计算抑菌率的大小(表2、表3和表4)。来自于茎部的内生菌有4株,对棉花枯萎病有明显的抑制作用,抑菌率均达到17%以上,最大抑菌率为28.24%;叶片分离的内生菌有2株,对棉花枯萎有明显的抑制作用,最大达26.78%;根部分离的内生菌有1株,对棉花枯萎的抑制作用最为明显,抑菌率达到32.61%。对比分离自根部、茎部和叶片的内生菌对棉花枯萎病菌的抑菌率发现,在P<0.05水平上存在明显的差异。由此可见,不同部位内生菌对棉花枯萎病的抑菌效果表现为:根部>茎部>叶片。
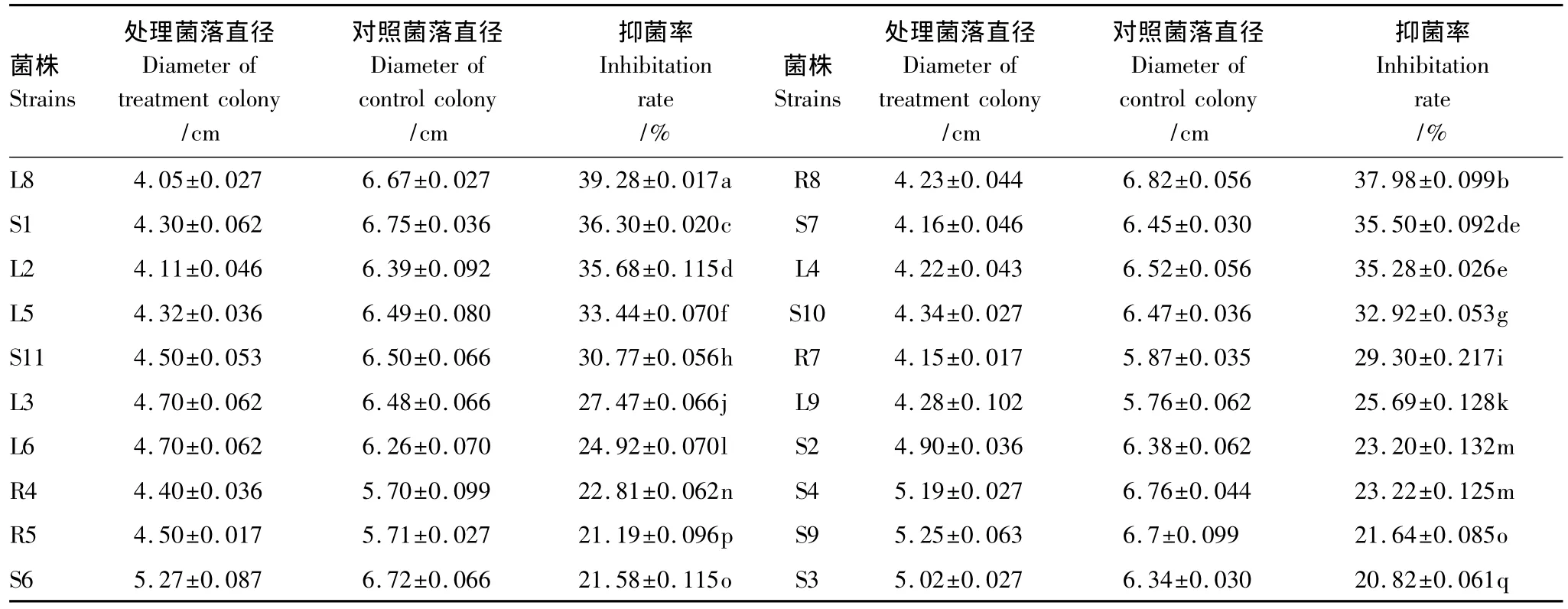
表3 内生菌对稻瘟病菌的抑菌效果Table 3 Inhibition effect of endophytes to Magnaporthe grisea
来自于茎部的内生菌有9株,对稻瘟病有明显的抑制作用,抑菌率均达到20%以上,最大抑菌率为36.30%;叶片分离的内生菌有7株对稻瘟病有明显的抑制作用,抑菌率达到24%以上,最大抑菌率为39.28%;根部分离的内生菌有4株,对稻瘟病有明显的抑制作用,抑菌率达到21%以上,最大抑菌率为37.98%。对比分离自根部、茎部和叶片的内生菌对稻瘟病的抑菌率发现,在P<0.05水平上存在明显的差异。由此可见,不同部位内生菌对稻瘟病的抑菌效果表现为:叶片>根部>茎部。
来自于茎部的内生菌有4株,对烟草赤星有明显的抑制作用,抑菌率均达到25%以上,最大抑菌率为32.10%;叶片分离的内生菌有2株,对烟草赤星有明显的抑制作用,抑菌率达到27%以上,最大抑菌率为31.20%;根部分离的内生菌有1株,对烟草赤星有明显的抑制作用,最大抑菌率为25.04%。对比根部、茎部和叶片的内生菌对稻瘟病的抑菌率发现,在P<0.05水平上存在明显的差异。由此可见,不同部位内生菌对烟草赤星的抑菌效果表现为:茎部>叶片>根部。
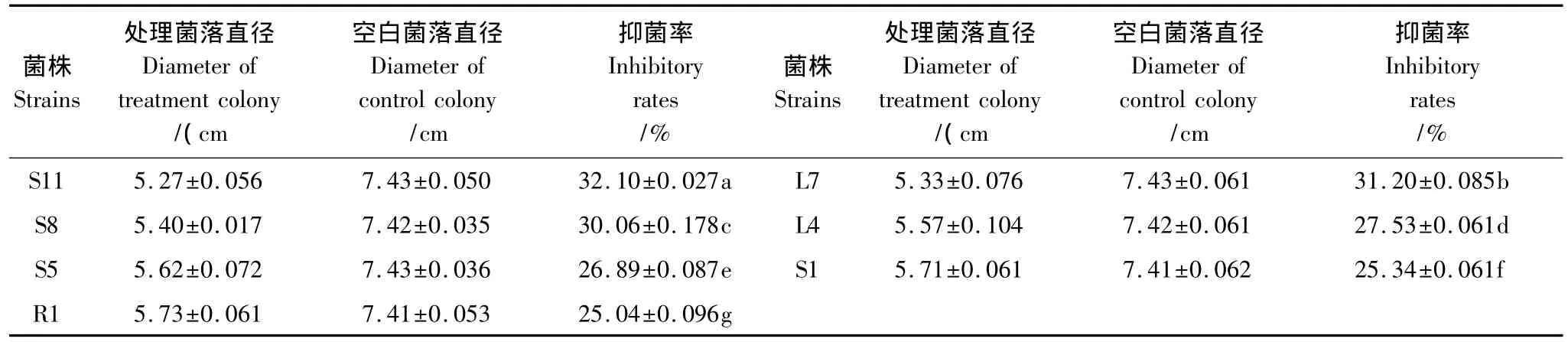
表4 内生菌对烟草赤星的抑菌作用结果Table 4 Inhibition effect of endophytes to Alternaria alternate
对棉花枯萎病抑菌效果最为明显的是来自根部的菌株R6(其抑制率为32.61%),对稻瘟病抑菌效果最为明显的为分离自叶片的菌株L8(其抑制率为39.28%),对烟草赤星抑菌效果最为明显的是分离自茎部的菌株S11(其抑制率为32.10%)。可见,分离自野生艾蒿的内生菌对不同植物病原菌的抑菌效果存在差异,稻瘟病>棉花枯萎病>烟草赤星。
2.3 菌株的初步鉴定
复筛中对3种病原菌抑制作用较强的菌株R6、L8和S11进行平板培养,经2d培养,平板菌落特征为:菌落均湿润、不透明、易挑起、生长速度快,菌落正反面颜色一致,菌落边缘不整齐或呈缺刻状。其中,菌株R6和L8菌落外观呈扁平状,乳白色、表面有光泽;菌株S11外观平坦,白色、表面无光泽。3株菌的菌落直径各异(R6:2.5mm、L8:3.0mm、S11:2.0mm)。根据细胞形态特征和生理生化特性试验结果(表5),结合东秀珠等编的《常见细菌系统和鉴定手册》[14],菌株R6、L8和S11均初步鉴定为芽孢杆菌属(Bacillus)菌株。
表5 菌株R6、L8、S11的生理生化试验结果和细胞特征Table 5 Physiological and biochemical test results and cell characteristics of strain R6,L8 and S11
2.4 菌株16S rDNA序列扩增及系统发育学分析
筛选出3株菌的16S rDNA序列经PCR扩增表明,扩增产物长度大约为1.5kb。其在GenBank中的序列登记号为KC245140-KC245142。将菌株的序列与模式菌种序列进行比对,结果表明,菌株L8与枯草芽孢杆菌(Bacillus subtilis)菌株 NRRL NRS-744T的序列 EU138520相似率最大,达98.7%,该菌株与菌株 Bacillus subtilis NRRL NRS-744T位于同一系统发育分支上,结合其生理生化特性和培养特征,该菌株属于芽孢杆菌属的枯草芽孢杆菌。菌株S11与模式菌株Bacillus cereus ATCC14579T(AF290547)位于同一发育分支上,二者具有最大的相似率,达99.3%;菌株R6与模式菌株Paenibacillus polymyxa IAM13419T(D16276)同一发育分支上,且二者间相似率最大,达99.1%(图3)。结合菌株S11和R6的生理生化特征以及培养特征,这两个菌株分别属于蜡状芽孢杆菌(Bacillus cereus)和多粘类芽孢杆菌(Paenibacillus polymyxa)。

表6 测序菌株的分类鉴定结果Table 6 Classification and Identification of the tested strains

图3 筛选菌株的16S rDNA序列的系统发育树(系统发育树分支上的数值表示大于50%的自举值,括号里是GenBank登陆号,粗体是待测菌株,标尺指核苷酸替代数)Fig.3 Phylogenetic tree generated by the neighbor-joining method based on 16S rDNA sequences of selected strains.Bootstrap values(1000 replicates)are indicated above the branches.Strains obtained are labeled in bold.Bar:0.02 sequence divergence
2.5 病原菌菌丝的被抑制作用
内生菌与病原菌的拮抗培养中,两菌的菌落从未接触,而病原菌靠近内生菌的菌落边缘部分不但有萎缩现象,而且出现黑色坏死部分,镜检结果显示,正常生长的植物病原菌菌丝粗细均匀一致、粗壮、光滑,生长端菌丝舒展(图4A,D)。棉花枯萎病菌的受作用菌丝(图4B,C)可以看出:有的菌丝发生波浪形扭曲、畸变(图4B-g),有的菌丝打结(图4C-h)。可能是内生菌R6通过分泌某种活性物质对菌丝发挥作用,一方面溶解病原菌的细胞壁;一方面抑制病原菌的正常生长、代谢以致萎缩、畸变。烟草赤星病原菌的受作用菌丝生长端分枝明显增多、分枝间隔变短(图4F),菌丝扭曲(图4F-c),生长边缘呈珊瑚状枝(图4F-d),并且有的菌丝断裂,在断裂处出现了明显的球状膨大现象(图4E-b;图4F-e);有的菌丝因细胞壁被消解而变得透明(图4E-a),还有些菌丝变细、变暗,原生质浓缩(图4F-f)
3 结论和讨论
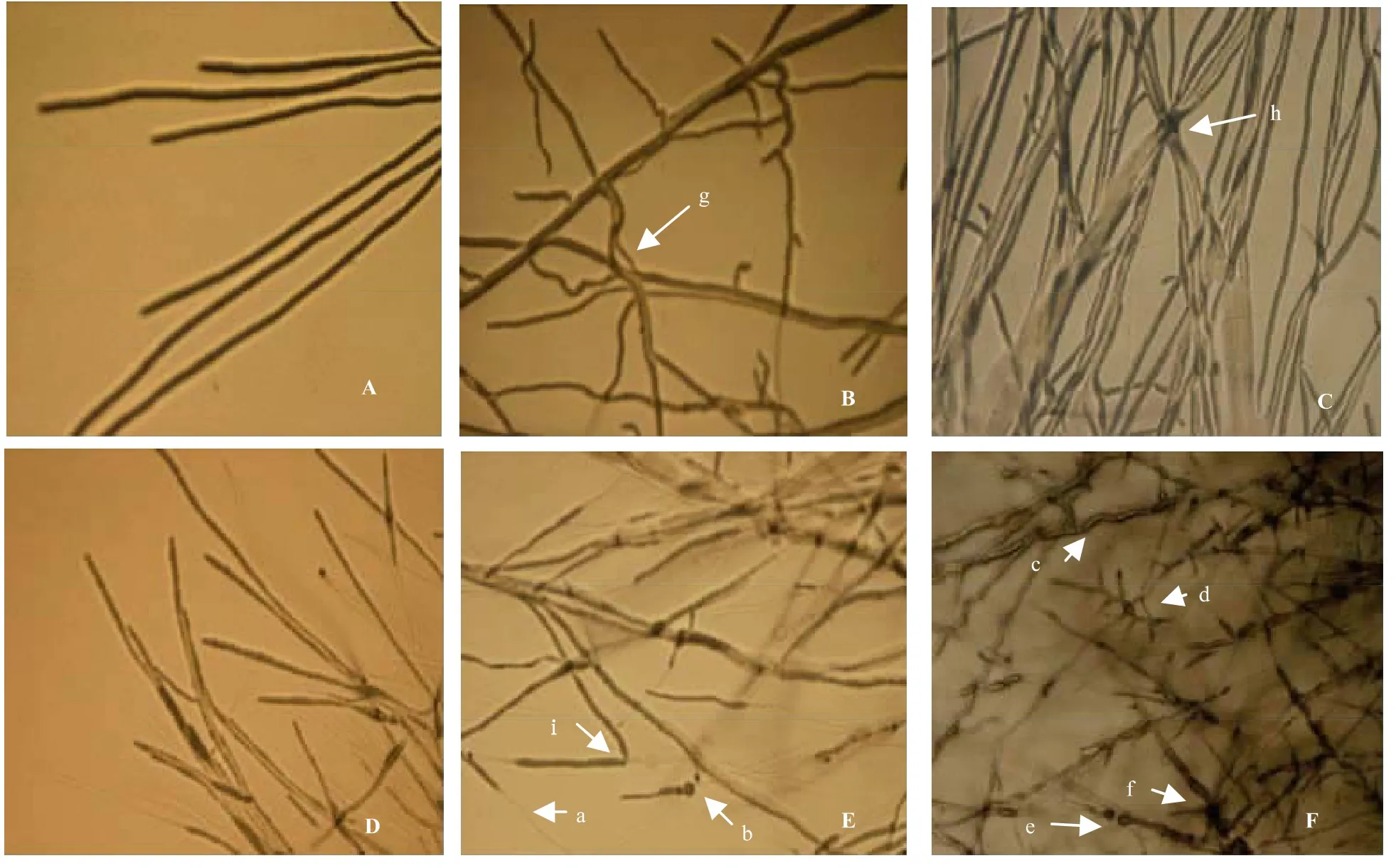
图4 艾蒿内生菌R6、S11对植物病原菌发生抑制作用时菌丝的变化(A.棉花枯萎病菌FO101的正常菌丝;B,C.棉花枯萎病菌FO101菌丝的畸形、弯曲打结菌丝;D.烟草赤星病菌AA103的正常菌丝;E F.烟草赤星病菌AA103菌丝的自溶、断裂萎缩)Fig.4 Mycelia change of plant pathogenic fungi under inhibition of Artemisia argyi endophytes A.Normal mycelia of Fusarium oxysporum FO101;B,C.Deformity,bending knot mycelia of Fusarium oxysporum FO101;D.Normal mycelia of Alternaria alternate AA103;E、F.Autolysis,fracture and atrophy of Alternaria alternate AA103
3.1 通过显微观察发现,不同菌株对病原菌的抑制情形各异。稻瘟病菌和烟草赤星病菌受到抑制后有明显的抑菌区域,但内生菌和病原菌均未接触,可能是由于内生菌的生长速度快,占据营养空间,对病原菌形成营养上的竞争,使病原真菌因缺乏营养而萎缩、畸变[15];也可能是在培养的过程中内生菌产生的水解酶类[15](细胞壁水解酶、几丁质酶、蛋白酶等)降解了病原真菌细胞壁,或产生了其他致病因子如毒素等,对病原真菌发挥作用的结果[16]。棉花枯萎病受到抑制后菌丝发生扭曲和贴壁现象(图4B,C),可能是在培养的过程中内生菌产生了化感物质[15],如螯合型铁载体、抗生素、杀菌性挥发物、溶菌酶和解毒酶等。如果产生铁载体可夺取生长于同一培养基上病原菌生长必需的铁元素,有效阻碍了病原菌菌丝的正常生长和发育;也许是内生菌产生抗生素类物质[15]如寡霉素A、卡那霉素水解物、双效菌素A等对病原菌菌丝发生抑制作用、导致菌丝畸形发展,前端变得萎缩、基部多呈珊瑚状分枝(图4F);若是产生溶菌酶如胞外几丁质酶和昆布糖酶对病原菌丝消化、溶解,导致菌丝外壁因部分溶解而发生打折、透明(图4E-i,a),抑制病菌的正常生长[17]。易龙等[18]研究支持了这个解释,烟草内生细菌Itb162对烟草赤星病原菌菌丝生长有明显的抑制作用,主要是拮抗菌使病原菌菌丝形成膨胀泡,破裂、消解,致使菌丝停止生长。蛋白酶和其他生物控制特性也参与对菌核病以及灰霉病菌生长的抑制作用[19]。类芽孢杆菌也可产生的β-1,3-葡聚糖酶可酶解枯萎病菌的细胞壁,导致菌丝自溶、断裂[20];也可能是多种机制的结合。但具体抑制机理仍在进一步研究之中。
3.2 本研究中从艾蒿植株不同部位分离的对病原菌具有较强抑制活性的3株内生菌,结合生理生化特性和培养特征,经16S rRNA基因测序、比对,菌株L8、S11、R6分别属于枯草芽孢杆菌(Bacillus subtilis)、蜡状芽孢杆菌(Bacillus cereus)和多粘类芽孢杆菌(Paenibacillus polymyxa)。芽孢杆菌属菌株是最普遍被报道的植物生长促生根际细菌(PGPR),芽孢杆菌属的一些种能够产生次生代谢产物(如多肽类物质),对植物病原菌(细菌、真菌、线虫等)具有较强的抑菌活性[17],可用于生物防治。如多粘类芽孢杆菌在厌氧条件下,大多数菌株能固定氮气,对人和动植物没有致病性,是重要的生防微生物,越来越多的拮抗性多粘类芽孢杆菌被分离筛选出来,能够产生抗菌素、抗菌蛋白、多粘菌素羊毛硫抗生素、多肽类gavaserin和saltavalin等多种生物活性物质[21],以及产生多种水解酶类(如β-1,3-葡聚糖酶、几丁质酶)对病原真菌表现出较好的抑菌活性。已有试验表明,多粘类芽孢杆菌对小麦全蚀病、由真菌尖孢镰刀菌引起的植物枯萎病都表现出很好的抑制效果,并且,也能对芝麻出苗前后易出现的立枯病、丝核菌引起的大豆碳腐病也有控制效果。显微镜研究表明,对病原菌的控制效应主要表现在对菌丝的腐蚀、溶解,抑制孢子萌发和产生分子量4517Da的抗真菌蛋白[22]。枯草芽孢杆菌也是一种重要的内生细菌,用其来防治真菌病害已有很多报道。如利用枯草芽孢杆菌防治立枯丝核菌、腐霉菌、镰刀菌等引起的病害,对水稻纹枯病、白叶枯病、条斑病、稻瘟病和恶苗病均有显著的防治效果[23]。由于芽孢杆菌属菌株具有芽孢特性,对外界有害因子抵抗力强,把枯草芽孢杆菌和其他芽孢杆菌属的菌株用于种子包衣来防治植物疾病的发生,用于生物肥料和生物菌剂均具特殊的稳定性。因此,利用野生艾蒿植株的内生芽孢杆菌开发生物防治剂,抑制植物病原菌、维持生态平衡具很大的应用潜力。
3.3 植物内生菌由于长期与植物共生,相互间存在密切的联系。野生艾蒿浸提物对病原菌如金黄色葡萄球菌、大肠杆菌[5]的抑制作用得以证实,但对不同植物病原真菌来说,艾蒿内生菌所产生的抑菌作用广谱性和抑菌效果方面存在差异,此外,分离自野生艾蒿不同部位的内生菌对不同植物病原菌的抑制效果间也存在差异。这可能与药用植物艾蒿不同组织部位的内含化学成分[2](挥发油、黄酮、桉叶烷和三萜类化合物等)的含量有关,植株不同部位的内生菌受其内含成分的影响,内生菌产生的次生代谢产物的量和种类可能存在差异。但具体的机制有待进一步的研究。
致谢:感谢商丘师范学院赖心河博士和张富强博士对写作给予的帮助。
[1] Sun F,Zhang K C.Study on total content and antioxidation property of flavone in agrestal Artemisia argy.Chinese Wild Plant Resources,2009,28(3):58-61.
[2] Sun T Z,Bai R X,Hai H.The extraction and the stability of natural pigment from Mugwort.Journal of Dalian Nationalities University,2004,6(5):43-45.
[3] Gu X W,Lv Z Y,Guo P,Xu W.Analysis of the chemical constituents of the volatile oil of Artemisia Argyi Levl.et Vant in Jiangsu.Journal of Beijing Union University(Natural Sciences),2010,24(2):35-39.
[4] Zhang L C,Li G Q,Liu Z W.The influence of extracts from Artemisia argyi Levl.et Vent on the oviposition of Spodoptera exigua Hübner.Journal of Nanjing Agricultural University,2002,25(4):110-112.
[5] Liu G X,Wang J,Wang Q Q,Ma Y Y.Allelopathic effects of Artemisia argyi water extracts on the seed germination and seedling growth of Agropyron cristatum and Elymus dahuricus.Journal of Hebei University(Natural Science Edition),2012,32(1):81-86.
[6] Xu Y J,Zhao L F.Study on inhibitory activities of the extract from field Artemisia argyi to Escherichia coli.Jiangsu Agricultural Sciences,2012,40(4):306-308.
[7] Zhao LF.Study on inhibitory activities of the extract from field Artemisia Argyi to Staphylococcus Aureus.The Food Industry,2011,32(6):7-8.
[8] Shi J Y,Chen W X,Liu A Y.Advances in the study of endophytes and their effects on control of plant diseases.Acta Ecologica Sinica,2006,26(7):2395-2401.
[9] Liu J H,Wu L F,Zhang H W.Isolation and preliminary identification of endophytes from Artemisia Annua Linn.Amino Acids& Biotic Resources,2011,33(4):27-3.
[10] Wang H,Xie YS,Yang YL,Chuai JF.Allelopathic effect of extracts from Artemisia sacrorum leaf and stem on four dominant plants of enclosed grassland on Yunwu Mountain.Acta Ecologica Sinica,2011,31(20):6013-6021.
[11] Ma Ying,Mani Rajkumar,Yong ML,Helena Freitas.Inoculation of endophytic bacteria on host and non-host plants Effects on plant growth and Ni uptake.Journal of Hazardous Materials,2011,195:30-237.
[12] Miller K I,Chen Q,Man-Yuen S D,Roufogalis B D,Neilan B A.Culturable endophytes of medicinal plants and the genetic basis for their bioactivity.Microbial Ecology,2012,64(2):431-449.
[13] Zhao L F,Xu Y J,Sun R,Deng Z S,Yang W Q,Wei G H.Identification and characterization of the endophytic plant growth prompter Bacillus cereus strain MQ23 isolated from Sophora alopecuroides root nodules.Brazilian Journal of Microbiology,2011,42(2):567-575.
[14] Dong X Z,Cai M Y.Manual of systematic determination of common bacteria.Beijing:Science Press,2001.
[15] Compant S,Duffy B,Nowak J,Clement C,Barka E A.Use of plant growth-promoting bacteria for biocontrol of plant diseases:principles,mechanisms of action,and future prospects.Applied and Environmental Microbiology,2005,71(9):4951-4959.
[16] Velazhahan R,Samiyappan R.Relationship between antagonistic activities of Pseudomonas fluorescens islates against Rhizoctonia solani and their production of lyric enzymes.Journal of Plant Diseases and Protection,1999,106(3):244-250.
[17] Lim H S,Kim Y S and Kim S D.Pseudomonas stutzeri YPL-1 genetic transformation and antifungal mechanism against Fusarium solanian agent of plant root rot.Applied and Environmental Microbiology,1991,57(2):510-516.
[18] Yi L,Xiao C G,Ma G H,Wang W N,Long L K.Inhibition and screening of beneficial endophytic bacteria to control tobacco brown spot.Acta Microbiologica Sinica,2004,4(1):19-22.
[19] Kamensky M,M Ovadis,Chet I,and Chernin L.Soil-borne strain IC14 of Serratia plymuthica with multiple mechanisms of antifungal activity provides biocontrol of Botrytis cinerea and Sclerotinia sclerotiorum diseases.Soil Biology& Biochemistry,2003,35(2):323-331.
[20] Singh P P,Shin Y C,Park C S,and Chung Y R.Biological control of Fusarium wilt of cucumber by chitinolytic bacteria.Phytopathology,1999,89(1):92-99.
[21] Lai K P,Chen S H,Hu M Y,Hu Q B,Geng P,Weng Q F,Jia J W.Control of postharvest green mold of citrus fruit by application of endophytic Paenibacillus polymyxa strain SG-6.Postharvest Biology and Technology,2012,69(7):40-48.
[22] Dinesh K Maheshwari.Plant growth and health promoting bacteria.Berlin:Springer Press,2010.
[23] Gao L L,Chen X L,Jiang T,Jiang W N,Huang Q.Isolation and identification of endophytic nitrogen-fixing bacteria in rice with antipathogenic functions.Journal of Huazhong Agricultural University,2012,31(5):553-557.
参考文献:
[1] 孙锋,张宽朝.野生艾草黄酮的含量及抗氧化性研究.中国野生植物资源,2009,28(3):58-61.
[2] 孙天竹,白日霞,海华.艾蒿色素的提取方法及其稳定性研究.大连民族学院学报,2004,6(5):43-45.
[3] 顾小卫,吕宗友,郭鹏,徐伟.江苏野生艾叶挥发油成分的分析.北京联合大学学报:自然科学版,2010,24(2):35-39.
[4] 张玲春,李国清,刘泽文.艾蒿抽提物对甜菜夜蛾产卵的影响.南京农业大学学报,2002,25(4):110-112.
[5] 刘桂霞,王静,王谦谦,马妍妍.艾蒿水浸提液对冰草和披碱草种子萌发及幼苗生长的化感作用.河北大学学报:自然科学版,2012,32(1):81-86.
[6] 徐亚军,赵龙飞.野生艾蒿浸提物对大肠杆菌的抑制作用.江苏农业科学,2012,40(4):306-308.
[7] 赵龙飞.野生艾蒿浸提物对金黄色葡萄球菌的抑制作用.食品工业,2011,32(6):7-8.
[8] 石晶盈,陈维信,刘爱媛.植物内生菌及其防治植物病害的研究进展.生态学报,2006,26(7):2395-2401.
[9] 刘金花,吴玲芳,章华伟.黄花蒿内生菌的分离与初步鉴定.氨基酸和生物资源,2011,33(4):27-30.
[10] 王辉,谢永生,杨亚利,揣峻峰.云雾山铁杆蒿茎叶浸提液对封育草地四种优势植物的化感效应.生态学报,2011,31(20):6013-6021.
[14] 东秀珠,蔡妙英.常见细菌系统和鉴定手册(第一版).北京:科学出版社,2001.
[18] 易龙,肖崇岗,马冠华,王万能,龙良鲲.防治烟草赤星病有益内生细菌的筛选及抑菌作用.微生物学报,2004,4(1):19-22.
[23] 高玲玲,陈小龙,蒋涛,姜伟娜,黄琼.具有拮抗作用的水稻内生固氮菌的分离与鉴定.华中农业大学学报,2012,31(5):553-557.
