狗牙根与牛鞭草在三峡库区消落带水淹结束后的抗氧化酶活力
2013-12-16李兆佳熊高明邓龙强谢宗强樊大勇
李兆佳,熊高明,邓龙强,谢宗强,樊大勇,*
(1.中国科学院植物研究所植被与环境变化国家重点实验室,北京 100093;2.中国科学院大学,北京 100049;3.湖北神农架国家级自然保护区管理局,湖北神农架 442400)
三峡水库运行后,在库区沿岸海拔145—175 m之间形成落差高达30 m的消落带,原来的陆生生态系统演变为季节性湿地生态系统。生长环境的巨大变化和反季节水淹的频繁干扰导致原有的大部分植物种类因不适应而逐渐消亡[1]。三峡水库消落带将面临生物多样性减少,污染加剧,生态系统更为脆弱等问题[2]。因此,三峡水库消落带植被的生态治理对维持三峡库区生态环境的稳定具有十分重要的意义[3]。
对三峡水库消落带植被的生态治理首先需要研究的问题就是消落带适宜植物的水淹耐受机理。对水淹胁迫耐受能力的强弱直接决定了植物是否适宜在消落带环境生长。淹没条件下,植物通过增加通气组织、伸长生长、调节叶片形态结构等方式增强水下气体交换和水下光合[4]。克隆植物特有的克隆整合机制并有助于整个克隆片段抵御水淹胁迫[5]。此外,水淹前的碳水化合物储存能力[6]、水淹过程中对碳水化合物的分配[7-8]以及水淹过后积极恢复的能力[9]被认为是构成植物水淹耐受能力的重要组分。
水淹结束后积极恢复的能力有利于消落带的多年生植物占据空间生态位,在出露周期内迅速恢复生长很可能使植株在水淹周期前储存更多碳水化合物。多年野外调查结果发现,三峡库区消落带形成后狗牙根和牛鞭草是适合当地生境的多年生草本植物[1,10]。长期模拟水淹研究结果表明狗牙根和牛鞭草能够在水淹结束后迅速恢复生长[11]。6个月水淹处理后狗牙根在15 d以内开始恢复生长,且盖度迅速增加[12]。Luo等[13]经过30 d模拟水淹处理显示,牛鞭草在水淹结束后10—20 d就开始恢复生长,且光合生理恢复领先于生长恢复。然而,目前是何种生理生态过程决定了恢复过程的快慢仍需要进一步的研究。
长期水淹胁迫导致无氧呼吸替代有氧呼吸、细胞内还原势增加等一系列细胞生理状态变化[14]。消落带适宜物种要重新适应水淹结束后正常的生长条件,其中一个问题是水淹过后植物与空气的重新接触可能会导致其受到的氧化胁迫程度明显增高[15],即使植物可以忍耐长期的水淹胁迫,但在恢复期内却可能因为不耐受高水平氧化胁迫而死亡[16],这可能是河岸带和消落带植物分布的重要限制因子[17]。大量研究表明植物体内抵御氧化胁迫的体系非常完备,其中超氧化歧化酶(SOD,EC 1.15.1.1)、抗坏血酸过氧化物酶(APX,EC 1.11.1.11)、过氧化氢酶(CAT,EC1.11.1.6)是清除活性氧(ROS)、降低氧化胁迫的关键酶[18-19]。因此,水淹后的恢复阶段,狗牙根和牛鞭草的恢复动态是否会与其体内清除ROS的SOD、APX、CAT的活性动态相关?
目前,有关三峡消落带适宜植物的水淹耐受机理的研究大部分采用模拟水淹方式[11,13,20]。由于模拟水淹实验不能完全对应自然状况(自然状况下水压、水深、光照等条件与模拟淹水实验条件差别很大),采用野外采样、对比测定的手段,研究了三峡库区消落带生长的狗牙根和牛鞭草的根系在水淹后恢复过程中清除ROS的关键酶的活性动态,以期回答上述科学问题,并为消落带人工植被恢复重建提供理论依据。
1 材料与方法
1.1 实验地点
实验地位于重庆市忠县石宝镇共和村三峡水库消落带(30°24′22″N,108°24′26″E)。属暖湿亚热带山地气候,温热寒凉,四季分明,雨量充沛,日照充足。
1.2 实验材料
狗牙根,Cynodon dactylon(L.)Pars,禾本科多年生草本植物,具根状茎或匍匐茎,匍匐茎节上生根及分枝;对Cu、Cd、Sb等重金属具有较强富集能力①陶星星,两个典型矿区植物积累重金属调查与研究(硕士论文).2008,湖南农业大学.,可作为牧草或草坪草;在国内分布于华南、黄河流域及以南地区、长江流域及以南地区和新疆等地。
牛鞭草,Hemarthria altissima,禾本科多年生草本,有长而横走的根茎。牛鞭草在我国分布较广,东北、华北、华中、华南、西南各地皆有存在,多生于田地、水沟、河滩等湿润处,常用作牧草。
两者均具有克隆习性,能较快扩张占领生境,在长江中上游地区牛鞭草常与狗牙根等相伴而生[21]。
1.3 实验设计
2008年3—6月划定5 m×30 m样地4块,其中2块位于海拔158 m,作为水淹及恢复处理组;另外2块样地位于海拔175 m,作为对照组。每个海拔的样地按照20 cm×30 cm株行距分别移栽当地种源的狗牙根和牛鞭草,移栽后只作简单的除杂草维护。
2009年春三峡水库水位下降,158 m样地出露前一天(第0天)进行第1次取样,此后每8d②本研究取样间隔根据参考文献以及实地观察结果确定:检测水淹(或缺氧)条件下抗氧化酶活力的取样间隔根据处理时间长短从数十分钟到数天不等;水淹处理长达数个月的文献报道表明植株在水淹结束后3—10d内开始恢复生长;据实地观察,三峡库区消落带冬季水淹结束后,植株在1周内基本开始复苏,在1个月内生长至正常水平取样一次:分别在4块样地上各挖取植株,每块样地取4棵作为重复,迅速洗净根系,吸干水分后称取0.5—1.0 g(鲜重)根部组织放入液氮中保存,用于检测SOD、APX、CAT酶活力。为尽力保证植物样品一致性,减少因日间光照、温度、水分的日变化引起的生理状态差异,每次取样均在清晨5:00—8:00之间进行。
根据长江水文网(http://www.cjh.com.cn)的三峡水库忠县水位记录,实验期间海拔175 m样地水淹共0 d,海拔158 m样地水淹共195 d。
1.4 根系取样与粗酶提取
取样时,把植株完整挖出,轻柔洗净根上的土,并用蒸馏水冲洗3遍。称取根系0.5—1 g,立即置于液氮中急冻,并于-70℃下保存,用于酶活力检测。酶提取与活力检测方法在Jiang和Zhang[22]基础上作修改[23]:在预冷的研钵中放入剪碎的根系样本,加入液氮,将样本研磨至粉末,加入适量粗酶提取液,匀浆液4℃下以15000 g离心20 min,上清液为粗酶液。
1.5 SOD(EC 1.15.1.1)活力检测
在盛有3 mL SOD反应混合液(预热至25℃)的试管中,加入100 μL粗酶液。终浓度分别为50 mmol/L磷酸钾缓冲液(pH值7.8),13 mmol/L甲硫氨酸,75 μmol/L氮蓝四唑(NBT),2 μmol/L 核黄素,0.1 mmol/L EDTA-Na2。混合后放在单排透明试管架上,在光照培养箱(25℃,12000lx)内照光10 min,迅速测定OD560。以加粗酶液但不照光的反应液为空白、蒸馏水代替粗酶液的照光管做对照。以抑制反应50%的酶量为一个SOD酶活力单位。
1.6 APX(EC 1.11.1.11)活力检测
2.5 mL APX反应混合液(预热至20℃)中依次加入100 μL粗酶液、0.4 mL H2O2稀释液(预热至20℃)。终浓度分别为50 mmol/L磷酸钾缓冲液(pH值7.0),0.1 mmol/L EDTA-Na2,0.03 mmol/L AsA(抗坏血酸,ascorbate),0.06 mmol/L H2O2。加入H2O2后立即测定0—5 min内的OD290值变化,每30 s记录1次读数,计算单位时间内AsA减少量(AsA比吸光系数2.8 mmol·L-1·cm-1)并计算酶活性(1个酶活定义为1U=1μmol AsA/s减少量)。蒸馏水作空白,对照用蒸馏水代替酶液。
1.7 CAT(EC 1.11.1.6)活力检测
2.8 mL反应液(预热至20℃)中加入200 μL粗酶液,终浓度分别为50 mmol/L磷酸钾缓冲液(pH值7.0),10 mmol/L H2O2。混合后立即测定0—2 min内的OD240值变化,每30 s记录1次读数,计算单位时间内H2O2减少量(H2O2比吸光系数39.4 mmol·L-1·cm-1)及酶活性(1个酶活定义为1U=1 μmol H2O2/s减少量)。蒸馏水作空白,对照用蒸馏水代替酶液。
1.8 统计分析方法
数据的统计分析使用SPSS 16.0,采用t检验分析海拔175 m与158 m之间对应指标的差异显著性;用二元相关分析方法确定指标之间的相关关系。用Origin 8.0作图。
2 结果
长期水淹胁迫(图1,海拔158 m,第0天)条件下,狗牙根和牛鞭草根部SOD、APX酶活力均高于对照(图1,海拔175 m,第0天)且大部分呈显著差异,与此相反,处理组CAT均显著低于对照。
水淹结束后(图1,第8天,第16天),SOD、APX酶活性均维持或上升到较高水平。狗牙根CAT稍低于对照而牛鞭草CAT上升幅度较大,但差异不显著。
酶活力的变化反映了物种间的差异。牛鞭草SOD、APX、CAT酶活力相对值(处理/对照)均在8—16 d达最高,分别为对照的3.9倍、9.3倍、3.6倍,而狗牙根3个酶活力的变化逐渐趋向于对照值(图1)。
尽管起始特征、恢复期变化动态各有特点,但恢复阶段后期(第24天)两个物种所有酶活力均与对照水平相近,没有显著差异。
相关分析表明,实验观察过程中3个酶活力两两正相关。这种相关性在很大程度上与受胁迫然后逐渐恢复的植株有关,因为若按照海拔划分数据,相关显著性完全集中于158 m处理组;不同物种之间则以牛鞭草根系各酶活力之间的相关性为主,狗牙根根系只有SOD-APX之间显著相关(图2)。
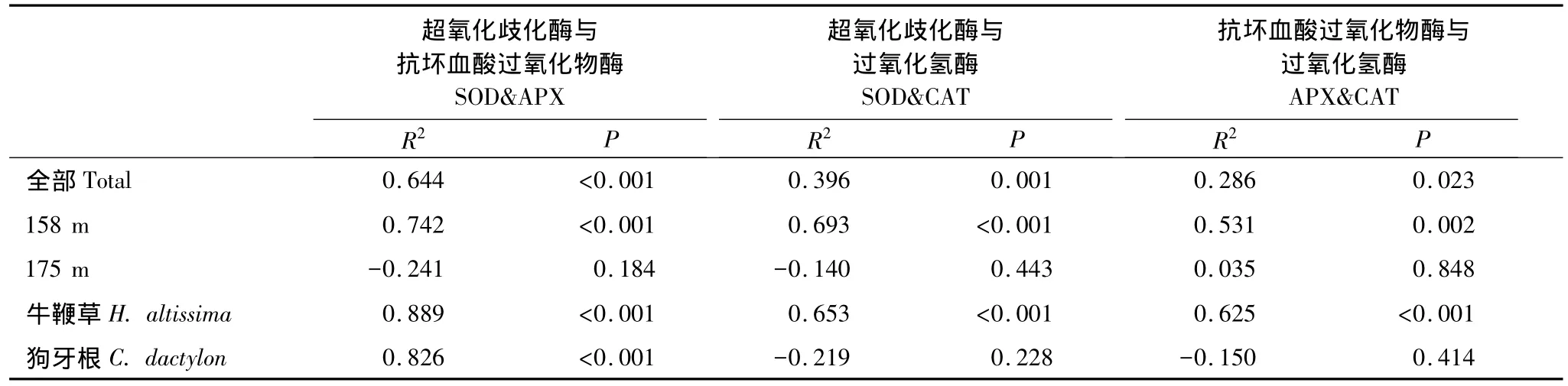
表1 基于检测个体数据的SOD、APX、CAT酶活力Pearson相关系数及p值Table 1 Pearson correlation coefficient and p value of correlation analysis among antioxidant enzyme activities based on plant individuals
3 讨论
3.1 长期水淹胁迫导致SOD、APX酶活力增强而CAT酶活力降低
长期水淹胁迫导致细胞内ROS过度积累:细胞缺氧引起的高还原势条件下NAD(P)H/NAD(P)+循环受阻、线粒体电子传递链饱和,电子在传递过程中泄漏并还原氧分子[14,24]。植物体可以通过提高ROS清除酶的活力以清除过度积累的ROS,降低氧化胁迫程度[25]。长期水淹胁迫后(图1,第0天)狗牙根、牛鞭草的根部SOD、APX活力普遍显著高于对照。这与一些研究报道相近:复氧阶段羽扇豆(Lupinus luteus L.,cv.Juno)根系SOD、CAT活力上升,但POD只受到轻微影响[26];黄菖蒲(Iris pseudacorus L.)与德国鸢尾(Iris germanica L.)在缺氧处理和恢复阶段的SOD酶活性均高于对照,且耐受性越高其增加幅度越大[27];缺氧增加了小麦根系SOD在非变性凝胶电泳中的条带数量,导致SOD总活力上升并持续至复氧阶段[28]。而狗牙根与牛鞭草的根部CAT起始活力均低于对照(图1),这可能是受到对CAT活力的抑制作用影响。这种作用在体外实验中得到证实,因而CAT在体内条件下很可能也受影响[29]。
3.2 水淹结束后恢复期间清除ROS的关键酶活性发生了动态变化

图1 狗牙根与牛鞭草根系SOD、APX和CAT酶活力动态Fig.1 Activity dynamics of SOD,APX and CAT from roots of C.dactylon and H.altissima
Unger等[30]对土壤化学特性的研究显示,水淹结束后土壤孔隙的O2浓度与水淹期间相比存在显著跃升。植物体与空气重新接触,水淹胁迫导致的处于过还原状态的根际和细胞环境将O2还原为[31],这将会诱导或者加重(水淹胁迫引起的)氧化胁迫[32],并诱导清除ROS的关键酶的活性上升[33]。研究结果表明:相对于对照,这两个物种在恢复阶段的SOD和APX均保持了较高水平(图1,第8天,第16天),说明恢复阶段确实出现了较高水平的氧化胁迫。
水淹结束一段时间后,植物根部受胁迫诱导的无氧呼吸途径关键酶活力下降[34]。可以认为呼吸代谢逐渐恢复到正常的有氧代谢模式,O2重新作为电子最终受体,因而植物细胞内ROS生产水平较恢复起始阶段下降,ROS清除酶活力也可能因此随之下降(图1,第24天)。结果表明:狗牙根和牛鞭草根部的酶活力在24 d左右完全回复至对照水平,可以认为细胞内的ROS代谢已经趋于稳定平衡,植株已基本处于未受氧化胁迫的状态。这个结果与长期模拟水淹实验的结果[12-13,20]吻合,说明恢复期内氧化胁迫水平与恢复生长状态紧密相关。
3.3 恢复过程中两个物种酶活力动态并不一致

图2 基于植株个体数据的SOD、APX和CAT酶活力相关分析Fig.2 Activity-correlation between SOD,APX and CAT based on plant individuals
本实验中,狗牙根CAT活力迅速恢复到对照水平,而牛鞭草CAT活力迅速增至较高水平,只因波动较大而与对照未形成显著差异(图1)。这个差别可能源于两个物种细胞中ROS调节途径的不同响应。在功能上,CAT、AsA-GSH循环(抗坏血酸-谷胱甘肽循环)以及GPX(谷胱甘肽过氧化物酶)均能催化分解H2O2,在维持细胞氧化还原状态稳定方面,三者在一定程度上互为冗余、互相补充[35-37],因此,可能两个物种在催化分解H2O2途径上存在差异。此外,牛鞭草在恢复过程中3-个酶与对照组的相对活性均有不同程度的增加,而狗牙根3个酶的相对活性基本维持不变。这可能说明牛鞭草在恢复阶段处于更高水平的氧化胁迫下;或其它机制也参与了对狗牙根的ROS清除过程。
3.4 消落带位点恢复过程中3个酶的活性显著正相关
海拔158 m位点的植物在恢复过程中抗氧化酶活力之间出现显著相关(图2),可能是植物细胞维持ROS代谢内稳态的体现。SOD分布于所有细胞器内,能够催化超氧阴离子自由基()发生歧化反应,产生H2O2及O2[18],而APX和CAT则进一步清除H2O2[19]。研究报道显示,对细胞有潜在毒性的ROS同时也具有信号传导作用[38-39],低浓度下,H2O2作为信号分子参与出发各种胁迫响应[40],高浓度下则发出细胞程序性死亡[41]。因此,恢复期植物可以通过调节酶活力以及加强各关键酶的协作作用(相关关系)[32],最大能力清除过量积累的ROS,以避免细胞遭受不可逆转的损伤。而对照组3个抗氧化酶活力之间没有显著相关性,原因可能是非氧化胁迫状态下其他代谢途径与ROS代谢的相互作用加强,ROS代谢过程可能不是制约植物生存生长的唯一关键生理生态过程。
总之,我们采用野外采样、对比测定的方法研究了三峡库区消落带生长的狗牙根和牛鞭草的根系在水淹后恢复过程中的ROS清除的关键酶的活性动态。发现:长期水淹胁迫导致SOD、APX酶活增强而CAT酶活降低;淹水后恢复期,清除ROS的关键酶活性发生了动态变化,这可能与水淹过后的积极恢复生长能力有密切关系;恢复过程中两个物种酶活动态并不一致;恢复过程中3个酶的活性呈显著相关。尽管有关ROS代谢与恢复生长之间的关系还需要进一步的直接证据,本文的研究结果有助于揭示消落带植物适应的生理生态机制,也为消落带生态恢复治理实践提供了重要的理论基础。
致谢:感谢重庆大学郭劲松教授、夏玉仙教授和曾德玉老师提供检测设备支持。
[1] Lu Z J,Li L F,Huang H D,Tao M,Zhang Q F,Jiang M X.Preliminary effects of impounding on vegetation in drawdown zone of the Three Gorges Reservoir region.Journal of Wuhan Botanical Research,2010,28(3):303-314.
[2] Tan S D,Wang Y,Zhang Q F.Environmental challenges and countermeasures of the water-level-fluctuation zone(WLFZ)of the Three Gorges Reservoir.Resources and Environment in the Yangtze Basin,2008,17(S1):101-105.
[3] Su W C.Main ecological and environmental problems of water-level-fluctuation zone(WLFZ)in Three Gorges reservoir and their controlling measures.Journal of Yangtze River Scientific Research Institute,2004,21(2):32-34.
[4] Voesenek L A C J,Colmer T D,Pierik R,Millenaar F F,Peeters A J M.How plants cope with complete submergence.New Phytologist,2006,170(2):213-226.
[5] Zhang X Y,Fan D Y,Xie Z Q,Xiong G M,Li Z J.Clonal integration enhances performance of Cynodon dactylon subjected to submergence.Chinese Journal of Plant Ecology,2010,34(9):1075-1083.
[6] Sarkar R K.Saccharide content and growth parameters in relation with flooding tolerance in rice.Biologia Plantarum,1997,40(4):597-603.
[7] Angelov M N,Sung S J S,Doong R L,Harms W R,Kormanik P P,Black C C.Long-and short-term flooding effects on survival and sink-source relationships of swamp-adapted tree species.Tree Physiology,1996,16(5):477-484.
[8] Islam M A,Macdonald S E.Ecophysiological adaptations of black spruce(Picea mariana)and tamarack(Larix laricina)seedlings to flooding.Trees-Structure and Function,2004,18(1):35-42.
[9] Gibbs J,Greenway H.Mechanisms of anoxia tolerance in plants.I.Growth,survival and anaerobic catabolism.Functional Plant Biology,2003,30(1):1-47.
[10] Wang J C,Zhu B,Wang T.Characteristics of restoration of natural herbaceous vegetation of typical water-level fluctuation zone after flooding in the Three gorges Reservoir area.Resources and Environment in the Yangtze Basin,2011,20(5):603-610.
[11] Wang H F,Zeng B,Li Y,Qiao P,Ye X Q,Luo F L.Effects of long-term submergence on survival and recovery growth of four riparian plant species in Three Gorges Reservoir region,China.Journal of Plant Ecology,2008,32(5):977-984.
[12] Liu Y F,Liu Z X.Adaptability test of Cynodon dactylon(L.)Pers.in the ebb and flow zone of the Three Gorges Reservoir under extreme conditions.Journal of Southwest Agricultural University:Natural Science,2005,27(5):661-663.
[13] Luo F L,Nagel K A,Zeng B,Schurr U,Matsubara S.Photosynthetic acclimation is important for post-submergence recovery of photosynthesis and growth in two riparian species.Annals of Botany,2009,104(7):1435-1444.
[14] Blokhina O,Virolainen E,Fagerstedt K V.Antioxidants,oxidative damage and oxygen deprivation stress:a review.Annals of Botany,2003,91(2):179-194.
[15] Crawford R M M,Braendle R.Oxygen deprivation stress in a changing environment.Journal of Experimental Botany,1996,47(2):145-159.
[16] Nabben R H M,Blom C W P M,Voesenek L A C J.Resistance to complete submergence in Rumex species with different life histories:the influence of plant size and light.New Phytologist,1999,144(2):313-321.
[17] Yi Y H,Fan D Y,Xie Z Q,Chen F Q.The effects of waterlogging on photosynthesis-related eco-physiological processes in the seedlings of Quercus variabilis and Taxodium ascendens.Acta Ecologica Sinica,2008,28(12):6025-6033.
[18] Bowler C,Vanmontagu M,Inze D.Superoxide-dismutase and stress tolerance.Annual Review of Plant Physiology and Plant Molecular Biology,1992,43:83-116.
[19] May M,Vernoux T,Leaver C,Van Montagu M,Inze D.Glutathione homeostasis in plants:implications for environmental sensing and plant development.Journal of Experimental Botany,1998,49(321):649-667.
[20] Tan S D,Zhang S J,Zhang K R,Dang H S,Li M,Zhang Q F.Effect of long-time and deep submergence on recovery growth and photosynthesis of three grass species in Three Gorges Reservoir area.Journal of Wuhan Botanical Research,2009,27(4):391-396.
[21] Yang C H,Zhang X Q,Li X L,Du Y,Wu Y Q.Hemarthria germplasm resources and breeding.Acta Prataculturae Sinica,2004,13(2):7-12.
[22] Jiang M,Zhang J.Water stress-induced abscisic acid accumulation triggers the increased generation of reactive oxygen species and up-regulates the activities of antioxidant enzymes in maize leaves.Journal of Experimental Botany,2002,53(379):2401-2410.
[23] Li Z J,Yu J,Fan D Y,Xie Z Q,Xiong G M,Zhang X Y.Clonal integration enhances the ability to scavenge reactive oxygen species in root of Cynodon dactylon subjected to submergence.Acta Ecologica Sinica,2011,31(17):4992-4999.
[24] Mittler R.Oxidative stress,antioxidants and stress tolerance.Trends in Plant Science,2002,7(9):405-410.
[25] Monk L S,Fagerstedt K V,Crawford R M M.Oxygen-toxicity and superoxide-dismutase as an antioxidant in physiological stress.Physiologia Plantarum,1989,76(3):456-459.
[26] Garnczarska M,Bednarski W.Effect of a short-term hypoxic treatment followed by re-aeration on free radicals level and antioxidative enzymes in lupine roots.Plant Physiology and Biochemistry,2004,42(3):233-240.
[27] Monk L S,Fagerstedt K V,Crawford R M M.Superoxide dismutase as an anaerobic polypeptide:a key factor in recovery from oxygen deprivation in iris pseudacorus?Plant Physiology,1987,85(4):1016-1020.
[28] Biemelt S,Keetman U,Mock H P,Grimm B.Expression and activity of isoenzymes of superoxide dismutase in wheat roots in response to hypoxia and anoxia.Plant,Cell and Environment,2000,23(2):135-144.
[29] Kono Y,Fridovich I.Superoxide radical inhibits catalase.Journal of Biological Chemistry,1982,257(10):5751-5754.
[30] Unger I M,Motavalli P P,Muzika R M.Changes in soil chemical properties with flooding:a field laboratory approach.Agriculture,Ecosystems and Environment,2009,131(1/2):105-110.
[31] Sairam R K,Kumutha D,Ezhilmathi K,Deshmukh P,Srivastava G.Physiology and biochemistry of waterlogging tolerance in plants.Biologia Plantarum,2008,52(3):401-412.
[32] Hossain Z,López-Climent M F,Arbona V,Pérez-Clemente R M,Gómez-Cadenas A.Modulation of the antioxidant system in citrus under waterlogging and subsequent drainage.Journal of Plant Physiology,2009,166(13):1391-1404.
[33] Veselova T V,Veselovsky V A,Turovetsky V B,Galchuk S V,Vanyushin V F,Aleksandrushkina N I,Rubin A B.Post-hypoxic oxidative stress after radicle protrusion as a possible cause for the production of abnormal seedlings in pea.Seed Science and Technology,2004,32(2):283-296.
[34] Dubey H,Grover A.Respiratory pathway enzymes are differentially altered in flood tolerant and sensitive rice types during O2deprivation stress and post-stress recovery phase.Plant Science,2003,164(5):815-821.
[35] Willekens H,Chamnongpol S,Davey M,Schraudner M,Langebartels C,Van Montagu M,Inze D,Van Camp W.Catalase is a sink for H2O2and is indispensable for stress defence in C3plants.The EMBO Journal,1997,16(16):4806-4816.
[36] Vanderauwera S,Zimmermann P,Rombauts S,Vandenabeele S,Langebartels C,Gruissem W,Inzé D,Van Breusegem F.Genome-wide analysis of hydrogen peroxide-regulated gene expression in Arabidopsis reveals a high light-induced transcriptional cluster involved in anthocyanin biosynthesis.Plant Physiology,2005,139(2):806-821.
[37] Mhamdi A,Hager J,Chaouch S,Queval G,Han Y,Taconnat L,Saindrenan P,Gouia H,Issakidis-Bourguet E,Renou J P,Noctor G.Arabidopsis glutathione reductase1 plays a crucial role in leaf responses to intracellular hydrogen peroxide and in ensuring appropriate gene expression through both salicylic acid and jasmonic acid signaling pathways.Plant Physiology,2010,153(3):1144-1160.
[38] Jabs T,Dietrich R A,Dangl J L.Initiation of runaway cell death in an Arabidopsis mutant by extracellular superoxide.Science,1996,273(5283):1853-1856.
[39] Foreman J,Demidchik V,Bothwell J H F,Mylona P,Miedema H,Torres M A,Linstead P,Costa S,Brownlee C,Jones J D G,Davies J M,Dolan L.Reactive oxygen species produced by NADPH oxidase regulate plant cell growth.Nature,2003,422(6930):442-446.
[40] Mittler R,Vanderauwera S,Gollery M,Van Breusegem F.Reactive oxygen gene network of plants.Trends in Plant Science,2004,9(10):490-498.
[41] Dat J,Vandenabeele S,Vranová E,Van Montagu M,Inzé D,Van Breusegem F.Dual action of the active oxygen species during plant stress responses.Cellular and Molecular Life Sciences,2000,57(5):779-795.
参考文献:
[1] 卢志军,李连发,黄汉东,陶敏,张全发,江明喜.三峡水库蓄水对消涨带植被的初步影响.武汉植物学研究,2010,28(3):303-314.
[2] 谭淑端,王勇,张全发.三峡水库消落带生态环境问题及综合防治.长江流域资源与环境,2008,17(S1):101-105.
[3] 苏维词.三峡库区消落带的生态环境问题及其调控.长江学院院报,2004,21(2):32-34.
[5] 张想英,樊大勇,谢宗强,熊高明,李兆佳.克隆整合有助于狗牙根抵御水淹.植物生态学报,2010,34(9):1075-1083.
[10] 王建超,朱波,汪涛.三峡库区典型消落带淹水后草本植被的自然恢复特征.长江流域资源与环境,2011,20(5):603-610.
[11] 王海锋,曾波,李娅,乔普,叶小齐,罗芳丽.长期完全水淹对4种三峡库区岸生植物存活及恢复生长的影响.植物生态学报,2008,32(5):977-984.
[12] 刘云峰,刘正学.三峡水库消落区极限条件下狗牙根适生性试验.西南农业大学学报:自然科学版,2005,27(5):661-663.
[17] 衣英华,樊大勇,谢宗强,陈芳清.模拟淹水对池杉和栓皮栎光合生理生态过程的影响.生态学报,2008,28(12):6025-6033.
[20] 谭淑端,张守君,张克荣,党海山,黎明,张全发.长期深淹对三峡库区三种草本植物的恢复生长及光合特性的影响.武汉植物学研究,2009,27(4):391-396.
[21] 杨春华,张新全,李向林,杜逸,吴彦奇.牛鞭草属种质资源及育种研究.草业学报,2004,13(2):7-12.
[23] 李兆佳,喻杰,樊大勇,谢宗强,熊高明,张想英.克隆整合提高淹水胁迫下狗牙根根部的活性氧清除能力.生态学报,2011,31(17):4992-4999.
