MR磁量图对自发性脑出血患者脑铁过量沉积的定量研究
2013-12-13范敬争李冠武田亚楠周蕾陈瑶袁军黄影珠常时新
范敬争,李冠武,田亚楠,周蕾,陈瑶,袁军,黄影珠,常时新
上海中医药大学附属岳阳中西医结合医院影像科,上海 200437
脑铁过量沉积可能导致慢性神经功能障碍, 如多发性硬化、阿尔茨海默病及帕金森病等[1]。近来研究发现脑出血大鼠模型的脑细胞内存在铁过量的病理证据[2],提示脑铁在出血后脑损伤的发病机理及神经功能预后中起着重要作用。然而临床上缺乏有效监测出血后脑细胞内铁含量异常的方法,因此,笔者拟采用一种无创性脑铁定量评价技术MR磁量图(quantitative susceptibility mapping,QSM),通过对比分析自发性脑出血(spontaneous intracerebral hemorrhage, ICH)患者与健康对照组之间苍白球(globus pallidus, GP)区磁化率的差异,评价QSM在监测ICH患者GP区非血红素铁的定量评价中的潜在价值。
1 材料与方法
1.1 研究对象
本研究搜集了2010年12月至2012年6月的ICH患者,所有病例均来自上海中医药大学附属岳阳中西医结合医院脑外科。最终21例ICH患者入选本研究组,其中男12例,年龄在50~82岁,平均年龄60岁,女9例,年龄在54~89岁 平均年龄78岁。ICH发生到MR扫描的平均时间为338 h。21例ICH患者的基础疾病为:高血压病11例,脑白质疏松6例,4例有嗜烟、酒史。对照组为20名健康志愿者,男13名,年龄在51~81岁,平均年龄66岁,女7名,年龄在60~73岁,平均年龄62岁。所有受检者均无脑外伤史,且均已签署知情同意书。
1.2 设备及参数
采用3.0 T超导型高场MRI(Siemens verio),8通道头颅正交线圈,横断面成像。成像序列包括T1、T2、FLAIR像及QSM成像。QSM采用快速三维多回波T2*梯度回波序列,扫描参数:TR 53.00 ms,TE 16.26~45.00 ms,共8个回波,FOV 24 cm×22 cm,层厚 2.0 mm,层距 0.4 mm,层数64,反转角15°,像素0.9 mm×0.9 mm×2.0 mm,带宽240 Hz,激励次数1,QSM采集时间 5 min 23 s。采集数据传送至后处理工作站进行GP磁化率及数据分析。T2WI参数:TR 6300.00 ms,TE 86.00 ms,FOV 24 cm×22 cm,层厚4.0 mm,层距 1.2 mm。采集的数据传送至Siemens Numaris/4后处理工作站。
1.3 测量方法
GP T2信号强度(signal intensity on T2-weighted images,T2SI))的测量在T2WI上进行,其磁化率的测量在QSM相位图上进行,由2名高年资医师共同阅片。采用手工描绘制ROI,并于间隔3周后重复1次。血肿对侧GP区相应参数的测量见图1~8,其中T2SI的测量是将T2WI上相邻像素的GP区T2SI值相加之后平均;磁化率的测量是将GP在所有像素下的磁化率相加,通过调整像素大小而得到的测量结果具有物理意义。同时保证实验组及对照组所测GP分布的均衡性。
1.4 数据分析
采用SPSS 16.0统计软件,采用Mann-Whitney检验比较ICH组及对照组GP磁化率之间的差异,计量资料符合正态分布的数据相关分析采用Pearson相关,非正态分布的数据采用秩相关,分析GP磁化率与T2SI、疾病持续时间及年龄之间的相关性,P<0.05表示差异有统计学意义。
2 结果
2.1 ICH组与对照组一般情况及GP磁化率的比较
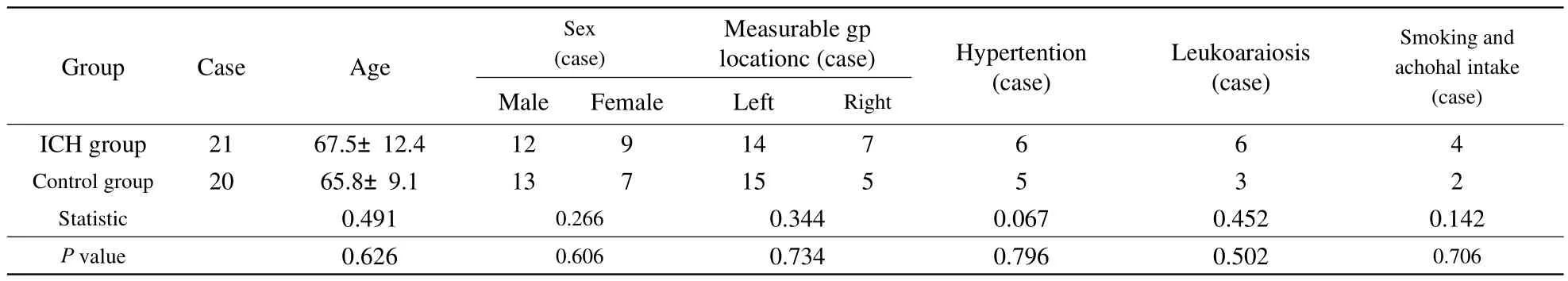
表1 ICH组及对照组临床特征比较Tab.1 Clinical data in the ICH group and control group

表2 ICH组与对照组GP磁化率的比较及其与年龄的相关性Fig.2 The comparison of GP susceptibility and the correlation with age between ICH group and control group

图1, 2 女,76岁。健康受试者的QSM图像(图1)。ROI (箭)代表同一受试者的苍白球(GP)区域(图2) 图3 女 65岁 左侧基底节区脑出血。ROI(箭)代表血肿对侧的GP区域 图4 男,59岁。左侧基底节区脑出血。ROI (箭)代表血肿对侧的GP区域 图5, 6 健康受试者。ROI (箭)代表T2信号强度值(T2SI) 图7 男,80岁,右侧基底节区脑出血。ROI (箭) 代表血肿对侧的T2SI 图8 女,66岁。右侧基底节区脑出血。ROI (箭)代表血肿对侧的T2SIFig.1, 2 Representative picture of a 76 years old healthy woman’s QSM image.ROI (arrow) drawn the subject’s GP region.Fig.3 Representative picture of a 65 years old woman, hemorrhage in left basal ganglia.ROI (arrow) drawn GP region of contralecteral hemotama.Fig.4 Representative picture of a 59 years old man ,hemorrhage in left basal ganglia.ROI(arrow) drawn GP region of contralecteral hemotama.Fig.5 , 6 Representative picture of a healthy subject’s T2-weighted image, ROI (arrow) represents the signal intensity on T2-weighted image (T2SI).Fig.7 Representative picture of a 80 years old man, hemorrhage in right basal ganglia.ROI (arrow) represents the T2SI of contralecteral hemotama.Fig.8 Representative picture of a 66 years old woman, hemorrhage in right basal ganglia.ROI (arrow) represents the T2SI of contralecteral hemotama.
ICH组与对照组的一般临床特征差异均无统计学意义(表1)。而ICH组的GP磁化率显著高于正常组(P<0.01)(表2)。ROI二次检测的一致性为r=0.95。
2.2 ICH组GP磁化率与T2SI的相关性分析
GP磁化率(330.92, 270.74~510.83)和T2SI(359.40, 281.70~436.50)呈显著负相关 (r=-0.715,P<0.01)。
2.3 ICH组GP磁化率与发病时间(h)的相关性分析
ICH组GP磁化率(330.92, 270.74~510.83)与发病时间(338, 1~1800)呈轻度正相关(r=0.434,P<0.05)。
2.4 ICH组及正常组GP磁化率与年龄的相关性
ICH组及正常组GP磁化率与年龄均无相关性(r=-0.135,P>0.05;r=0.183,P>0.05;表2)。
3 讨论
3.1 QSM技术的可行性及GP区的病理生理基础
QSM利用一般成像技术舍弃的相位信息得到局部磁场变化特性,采用快速有效的多回波T2*梯度回波成像序列,并通过复杂的场到源的反演计算,从MR梯度回波数据中重建并得到可直接定量的磁化率图。Liu等[3]采用QSM对ICH患者的研究证实,出血部位的总磁化率随着回波时间的增加未见显著改变;Li等[4]通过对不同含量的氧化铁水模进行分析证实,随着氧化铁水平增高,磁化率逐渐增高。采用QSM测量脑铁沉积量的准确性也得到尸解的病理学证实[5-6]。目前QSM定量测量脑铁磁化率已广泛应用于多发性硬化症、阿尔茨海默病及帕金森病等许多神经退行性病变的研究[7-9]。
健康人群在生理状态下脑铁含量处于稳定状态,并通过血脑屏障(BBB)调节、维持这种稳态。如通过调节血液,选择运输系统,限制铁进入脑内[10]。同时在脑内存在多个反馈回路来调节铁水平以维持神经系统的正常功能[11]。正常状态下,铁通过血脑屏障经过一系列途径进入到脑组织后主要储存在基底节区,尤其是GP,GP是脑内含铁量最高的组织。由于铁是一种强顺磁性物质,具有很高的磁化率[12]。且病理生理研究证实GP区铁主要为非血红素铁,主要以铁蛋白的形式存在[13]。基于QSM测量的磁化率反映的是GP铁蛋白含量。
3.2 脑内铁过量与GP非血红素铁的升高及其影响
由于铁得到(三价到二价,Fe3+→Fe2+)或者失去电子(Fe2+→Fe3+)相对容易,所以铁是神经功能代谢及各种病理过程中的一个重要辅助因子,包括髓鞘形成及线粒体能量的产生。虽然一定量的铁对于维持正常的脑功能是必要的,但过量的铁也会产生破坏作用[14]。铁含量的增高在许多慢性的神经退化紊乱性疾病中被发现,且能导致脑损伤或功能退化[15]。
近年来,基于ICH铁过量的动物实验研究也越来越受到关注。Siesjö等[16]发现脑出血后大鼠脑内铁含量升高,且其通过很多途径引起脑损伤。例如自由基的产生和脂质过氧化反应。然而这种异常增高的铁的具体结合形式仍然存在争议。一项对遗传改良型的小鼠的研究表明持续的自身铁蛋白增高可能和毒性有关,年长的血浆铜蓝蛋白敲除型小鼠,其脑内星形细胞中铁蛋白的积累与胶质细胞原纤维酸性蛋白及S100β的降低有关,且和细胞的缺失相一致[17];铁调节蛋白2(IRP2)敲除型小鼠晚期可能发展为的运动障碍,其铁沉积在白质纤维束和细胞核加速了神经的退化,而铁调节蛋白(IRPs)在控制铁蛋白合成中发挥着重要作用[18],是评估脑损伤及神经功能状态的主要参考指标。也有研究表明血清铁蛋白水平和脑损伤尤其是血肿周围水肿的形成有关,且较高的血清铁蛋白水平意味着ICH患者的神经功能恢复较差[19]。本研究也证实,ICH患者GP区域非血红素铁(铁蛋白)含量升高,且与T2SI值呈负相关,表明GP非血红素铁含量的升高可能意味着ICH患者脑损伤及神经功能退化的程度加重,这与文献报道结果一致[20-21]。
3.3 脑出血后脑组织铁蛋白含量升高的可能机制及其与发病时间、年龄的关系
铁蛋白是脑内的主要储存蛋白,其主要位于基底节区,尤其是苍白球区域。哺乳动物铁蛋白是含有24个亚基的杂聚体,根据其所占部位的器官或分子重量,其可以分为H (心或重)型及L(肝或轻)型[22]。且由于其具有结合铁的能力,所以很可能是血红素代谢所释放的铁的主要储存位点。研究显示血红素氧化酶(HO-I)的激活可能刺激铁蛋白的合成;同时IRPs的缺失也能诱导铁蛋白的合成[13]。由于IRPs位于脑内的星形胶质细胞内,铁必须转移到小胶质细胞内来控制铁蛋白的合成,因此,当血肿或血肿周围的水肿破坏了星形胶质细胞和小胶质细胞之间的联系时,铁蛋白的合成失去控制,而铁蛋白的合成增加则进一步加剧了铁的聚集。关于脑内铁蛋白的演变,Hua等[23]在动物实验中使用非血红素组织铁来评估ICH后脑内铁沉积的自然形成过程,并显示ICH大鼠血肿周围的非血红素铁较之前增长了3倍,并持续近一个月;而Koeppen等[24]通过对注入全血而制成ICH大鼠的观察发现,其发病的最初3 d内非血红素铁便开始增多,并且持续时间3个月。而本研究结果也表明,发病时间在3个月的ICH患者,其GP区域磁化率和发病时间呈轻度正相关,说明ICH患者GP磁化率可能持续增高近3个月,这与Koeppen等[24]的研究一致。同时这一结果可能提示基底节区(basal ganglia,BG)铁蛋白含量的增加不是偶然的,而是一个伴随的现象,并可能标志着组织的受损程度。
年龄对非血红铁沉积的影响自1958年便有描述,尤其是在GP区,健康年长的人群趋向于非血红素铁的沉积增多[25]。因此考虑年龄作为一个变量对比健康受试者来分析其与脑内铁含量的关系是必要的。而本研究在ICH组及健康对照组均未发现GP磁化率与年龄呈相关性,可能是由于本研究受试对象年龄过于集中的关系。
总之,ICH患者脑内存在铁过量,且应用QSM对GP区域非血红素铁的评估可以作为ICH脑细胞内铁过量的参考指标。因此,QSM铁定量技术的潜在重要价值将在自发性脑出血的诊断、监测中发挥重要作用。
[References]
[1]Khalil M, Langkammer C, Ropele S, et al.Determinants of brain iron in multiple sclerosis: a quantitative 3 T MRI study.Neurology, 2011,77(18): 1691-1697.
[2]Hua Y, Nakamura T, Keep RF, et al.Long-term effects of experimental intracerebral hemorrhage: the role of iron.J Neurosurg, 2006, 104(2):305-312.
[3]Liu T, Xu W, Spincemaille P, et al.Accuracy of the morphology enabled dipole inversion (MEDI) algorithm for quantitative susceptibility mapping in MRI.IEEE Trans Med Imaging, 2012, 31(3):816-824.
[4]Li J, Chang S, Liu T, et al.Reducing the object orientation dependence of susceptibility effects in gradient echo MRI through quantitative susceptibility mapping.Magn Reson Med, 2012, 68(5): 1563-1569.
[5]Schrag M, McAuley G, Pomakian J, et al.Correlation of hypointensities in susceptibility-weighted images to tissue histology in dementia patients with cerebral amyloid angiopathy: a postmortem MRI study.Acta Neuropathol, 2010, 119(3): 291-302.
[6]Langkammer C, Schweser F, Krebs N, et al.Quantitative susceptibility mapping (QSM) as a means to measure brain iron? A post mortem validation study.Neuroimage, 2012, 62(3): 1593-1599.
[7]Cordonnier C, van der Flier WM.Brain microbleeds and Alzheimer’s disease: innocent observation or key player? Brain, 2011, 134 (2):335-344.
[8]Schrag M, Crofton A, Zabel M, et al.Effect of cerebral amyloid angiopathy on brain iron, copper, and zinc in Alzheimer’s disease.J Alzheimers Dis, 2011, 24(1): 137-149.
[9]Leskovjan AC, Kretlow A, Lanzirotti A, et al.Increased brain iron coincides with early plaque formation in a mouse model of Alzheimer’s disease.Neuroimage, 2011, 55(1): 32-38.
[10]Fillebeen C, Descamps L, Dehouck MP, et al.Receptor-mediated transcytosis of lactoferrin through the blood-brain barrier.J Biol Chem,1999, 274(11): 7011-7017.
[11]Moos T, Rosengren Nielsen T, Skjørringe T, et al.Iron trafficking inside the brain.J Neurochem, 2007, 103(5): 1730-1740.
[12]Valdés Hernández MC, Jeong TH, Murray C, et al.Reliability of two techniques for assessing cerebral iron deposits with structural magnetic resonance imaging.J Magn Reson Imaging, 2011, 33(1): 54-61.
[13]Wu J, Hua Y, Keep RF, et al.Iron and iron-handling proteins in the brain after intracerebral hemorrhage.Stroke, 2003, 34(12):2964-2969.
[14]Brass SD, Chen NK, Mulkern RV, et al.Magnetic resonance imaging of iron deposition in neurological disorders.Top Magn Reson Imaging, 2006, 17(1): 31-40.
[15]Wagner KR, Sharp FR, Ardizzone TD, et al.Heme and iron metabolism: role in cerebral hemorrhage.J Cereb Blood Flow Metab,2003 , 23(6): 629-652.
[16]Siesjö BK, Agardh CD, Bengtsson F.Free radicals and brain damage.Cerebrovasc Brain Metab Rev, 1989, 1(3): 165-211.
[17]Jeong SY, David S.Age-related changes in iron homeostasis and cell death in the cerebellum of ceruloplasmin-deficient mice.J Neurosci,2006, 26(38): 9810-9819.
[18]LaVaute T, Smith S, Cooperman S, et al.Targeted deletion of the gene encoding iron regulatory protein-2 causes misregulation of iron metabolism and neurodegenerative disease in mice.Nat Genet, 2001,27(2): 209-214.
[19]Mehdiratta M, Kumar S, Hackney D, et al.Association between serum ferritin level and perihematoma edema volume in patients with spontaneous intracerebral hemorrhage.Stroke, 2008, 39(4):1165-1170.
[20]Godau J, Klose U, Di Santo A, et al.Multiregional brain iron deficiency in restless legs syndrome.Mov Disord, 2008, 23(8):1184-1187.
[21]McNeill A, Birchall D, Hayflick SJ, et al.T2*and FSE MRI distinguishes four subtypes of neurodegeneration with brain iron accumulation.Neurology, 2008, 70(18): 1614-1619.
[22]Li Z, Chen-Roetling J, Regan RF.Increasing expression of H- or L-ferritin protects cortical astrocytes from hemin toxicity.Free Radic Res, 2009, 43(6): 613-621.
[23]Hua Y, Keep RF, Hoff JT, et al.Brain injury after intracerebral hemorrhage: the role of thrombin and iron.Stroke, 2007, 38 (2 Suppl):759-762.
[24]Koeppen AH, Dickson AC, Smith J.Heme oxygenase in experimental intracerebral hemorrhage: the benefit of tin-mesoporphyrin.J Neuropathol Exp Neurol, 2004, 63(6): 587-597.
[25]Hallgren B, Sourander P.The effect of age on the nonhaemin iron in the human brain.J Neurochem, 1958, 3(1): 41-51.
