大蹼铃蟾的线粒体基因组D-loop区序列分析
2013-12-10韩毛振罗学才王晶晶
张 雁 韩毛振 罗学才 王晶晶
(1 合肥师范学院生命科学系,安徽 合肥 230061)
(2 安徽大学生命科学学院,安徽 合肥 230601)
大蹼铃蟾(Bombina Maxima)隶属无尾目(A-nura)、盘舌蟾科、铃蟾属,外形似蟾蜍,头宽略大于头长;吻钝圆,吻棱不显;无鼓膜,无颞褶,舌近圆形,周围与口腔粘膜相连;犁骨齿二短列,横置内鼻孔内侧后方。四肢粗壮,趾间全蹼或近全蹼,皮肤极粗糙,整个背面满布大瘰粒,瘰粒之间及其上面满布小刺,体侧及四肢刺疣多。成体体长60 mm左右。铃蟾属分布于欧洲到东亚一带,是我国最原始的无尾目,有毒,腹部颜色鲜艳,遇到危险时露出腹部的警戒色。在我国盘舌蟾科只有铃蟾属中的东方铃蟾(BombinaBombina)、强刺铃蟾(Bombinafortinuptialis)、微蹼铃蟾(Bombinamicrodeladigitora)、大蹼铃蟾(Bombina Maxima)四种铃蟾分布。大蹼铃蟾(Bombina Maxima)栖于海拔2500–3600m中高山环境中,国内分布于四川、云南及贵州等地,在东南亚靠近云南的地区也有分布。
线粒体是细胞进行氧化磷酸化提供能量的场所[1],是真核细胞内的重要的细胞器。脊椎动物线粒体DNA是一个环形双链结构,少数也有线性的,长度约为 15-22kb[2,3];线粒体 DNA 从硬骨鱼类到哺乳动物具有相对保守性[4],由于其具有分子量小,结构简单,呈母系遗传,进化速率快等特点,已被广泛应用于动物遗传学、分类学、疾病机理研究[5,6]及类群间的系统发生关系的研究。关于线粒体基因组的研究较多的集中在对于其蛋白编码基因和rRNA基因的研究。对于线粒体基因组中的非编码区(D-loop区)研究较少。近年来发现其非编码区(D-loop区)包含重链的复制起始位点和3个保守区[7-9],并发现在部分物种的非编码区(D-loop区)中存在串联重复序列。
本文采用LA-PCR、测序技术和生物信息学的方法,研究了大蹼铃蟾的线粒体基因组的非编码区域。
1 材料与方法
1.1 主要仪器设备
PCR仪、超速冷冻离心机、凝胶成像系统、电泳仪、恒温水浴锅、移液枪、制冰机,超净工作台、恒温培养箱、灭菌锅、电子天平、纯水仪等。
1.2 样品来源和基因组DNA提取
成体大蹼铃蟾(1♂),2004年采自云南玉龙雪山,标本现-80℃保存。总DNA采用Sambrook的方法[10]从肌肉组织中提取,琼脂糖凝胶电泳检测。
1.3 引物设计和PCR扩增
综合参考黑斑蛙(Rananigromaculata)、东方铃蟾(Bombinaorientalis)的线粒体基因组全序列,先用CLUSTAL W1.8[11,12]比对同源区段,在D-loop区两端的保守区段设计1对兼并引物,通过LA-PCR技术扩增目的序列。

图1 大蹼铃蟾线粒体基因组D-loop区LA-PCR结果
LA-PCR反应循环参数为:
94℃预变性 1min,97℃变性 10s,58℃退火15min,30个循环,最后72℃延伸10min。
取5μl PCR产物经1.2%琼脂糖凝胶电泳检测,用紫外观察PCR产物扩增情况,凝胶成像系统扫描记录结果。目的片段经纯化试剂盒 (V-gene DNA凝胶回收试剂盒)纯化后,克隆到E.colipGEM-T载体中,筛选阳性克隆进行培养,菌液委托上海英骏生物技术有限公司测序(ABI 3730 DNA测序仪)。序列分析采用 BioEdit、DNASTAR(2001)软件和测序峰图结果分析进行拼接,去除两端多余序列最后得到大蹼铃蟾的D-loop区完整基因序列。
2 结果与分析
2.1 大蹼铃蟾线粒体基因组D-loop区序列扩增结果
大蹼铃蟾线粒体包括D-loop区在内的基因序列扩增长度约为3500 bp(图1)。
2.2 大蹼铃蟾线粒体基因组D-loop结构分析
通过对大蹼铃蟾线粒体基因组D-loop区的测序和分析,去除两端多余序列,得出大蹼铃蟾的mtDNA中的D-loop区全长2987bp,其中包括三个保守序列(CSB-1,CSB-2 and CSB-3)[13],其结构比较类似[14]。目前已知部分始蛙亚目在3`端有串联重复序列。大蹼铃蟾D-loop区的5`端和3`端各有明显的串联重复序列VNTR (a)和VNTR(b),因此造成其D-loop区长度较一般始蛙亚目物种较长。而除明显的串联重复序列(a)(b)外,大蹼铃蟾的mtDNA的D-loop区VNTR(a)之后还有序列(5`-TAA-3`)重复 4 次,紧接着VNTR(b)有一个(5`-TGGTGGGGG-3`)的序列重复两次,在这个重复序列之后就是tRNAPhe(图2)。
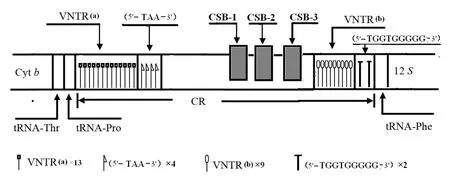
图2 大蹼铃蟾D-loop区主要结构特征
在大蹼铃蟾D-loop区5`端有一段总长989bp的重复序列(a),共重复了13次,将这13次重复的序列比对后发现这些重复序列大部分极其相似,但也有细微差别(图3)。第一次重复的序列5`端有所差异,第13次重复的序列3`端缺少了一段,中间的重复序列第9次重复多了一段20bp的序列,其他的重复序列极其保守。
D-loop 3`端有一段总长556bp的重复序列(b),为66bp左右的序列重复了9次,其中2、3段重复序列在顺序上只有只有第38个碱基的差别,一个是碱基 C,一个是碱基 A;4、5、6、7、8 段的重复序列完全相同;其第1次重复的5`端有差异;第9次重复串联重复序列的3`端的序列也是缺少了一段(图4)。

图4 大蹼铃蟾D-loop区的3`端串联重复序列(b)
3 讨论
大蹼铃蟾的mtDNA的D-loop区全长2437bp,具有三个保守序列 (CSB-1,CSB-2 and CSB-3)。其5`端和3`端各有明显的串联重复序列。D-loop区因其调控整个mtDNA的复制和转录,又称为控制区,是线粒体全序列中变化最大的区域。物种和个体之间长度的差异主要是由于串联重复序列造成的。串联重复序列多数位于中央控制区的两侧。这表明控制区易发生插入和缺失突变而其功能却不受影响。线粒体基因组中重复序列的产生机制还没有完全确定,一般认为是复制滑脱和非同源性重组的结果[15-17]。新蛙亚目有很多物种D-loop很长,尤其是在树蛙科中:斑腿泛树蛙(Polypedatesmegacephalus)2224bp,史立积绿树蛙(Rhacophorusschlegelii)5659bp,卡吉卡蛙(Buergeriabuergeri)4575bp, 马 达 加 斯 加 彩 蛙(Mantellamadagascariensis)6977bp。但是在始蛙亚目中,线粒体D-loop区一般在1000-2000bp左右,大蹼铃蟾D-loop区与其他始蛙亚目相比较长,这可能是因为其5`端和3`端各有明显的串联重复序列,而大多数始蛙亚目只在3`端有明显的串联重复序列。
通过分析我们发现大蹼铃蟾的这些串联重复序列具有以下规律:
1.临近的重复序列同源性较高,在(a)中,重复片断(1 2 3);(5 6 7);(8 10 11 12)同源性很高,在重复序列(b)中(1 2 3);(4 5 6 7 8)分别相似。
2.在整个串联重复序列中的处于5`和3`端的第一次和最后一次的重复序列片断中往往不完整,第1次的重复序列的5`端常发生改变,最后一次的重复序列的重复序列往往发生缺失。
3.重复序列有时会插入一些片断。在VNTR(a)中的第9次重复序列的中间就插入了一段长19bp的序列。
4.重复片断的差异是一种渐变的差异。
这些串联重复序列表现出来的特征可能是复制滑脱和非同源性重组过程中产生的,对于分析线粒体基因组中重复序列的产生机制有十分重要的意义。
[1]Papa S.Mitochondrial oxidative phosphorylation changes in the life span.Molecular aspects and physiopathological implications[J].Biochimica et biophysica acta,1996,(1276):87.
[2]Wolstenholme DR.Animal mitochondrial DNA:structure and evolution[J].International review of cytology 1992,(141):173.
[3]Saccone C,De Giorgi C,Gissi C,Pesole G,Reyes A.Evolutionary genomics in Metazoa:the mitochondrial DNA as a model system[J].Taxon,1999,(238):195-209.
[4]Boore JL.The duplication/random loss model for gene rearrangement exemplified by mitochondrial genomes of deuterostome animals[M].Comparative genomics:Springer,2000:133.
[5]陈丽峰,柳君泽,宋熔,党永明.氯霉素处理对急性缺氧大鼠脑线粒体氧化呼吸功能变化研究[J].第三军医大学学报,2004,(18):1611.
[6]鄢卫华.OMT对模拟高原缺氧大鼠脑线粒体呼吸氧耗与能量生成的影响及抗缺氧效应研究[D].重庆:第三军医大学,2012.
[7]Walberg MW,Clayton DA.Sequence and properties of the human KB cell and mouse L cell D-loop regions of mitochondrial DNA[J].Nucleic acids research,1981,(9):5411.
[8]Shadel GS,Clayton DA.Mitochondrial DNA maintenance in vertebrates[J].Annual review of biochemistry,1997,(66):409.
[9]Miyazono F,Schneider PM,Metzger R,Warnecke-Eberz U,Baldus SE,Dienes HP,et al.Mutations in the mitochondrial DNA D-Loop region occur frequently in adenocarcinoma in Barrett's esophagus[J].Oncogene 2002,(21):3780.
[10]Sambrook J,Fritsch EF,Maniatis T.Molecular cloning:Cold spring harbor laboratory press New York,1989.
[11]Thompson JD,Higgins DG,Gibson TJ.CLUSTAL W:improving the sensitivity of progressive multiple sequence alignment throughsequenceweighting,position-specificgappenaltiesandweightmatrixchoice[J].Nucleicacidsresearch,1994,(22):4673.
[12]Chenna R,Sugawara H,Koike T,Lopez R,Gibson TJ,Higgins DG,et al.Multiple sequence alignment with the Clustal series of programs[J].Nucleic acids research,2003,(31):3497.
[13]Walberg MW,Clayton DA.Sequence and properties of the human KB cell and mouse L cell D-loop regions of mitochondrial DNA[J].Nucleic acids research,1981,(9):5411.
[14]Partridge MA,Davidson MM,Hei TK.The complete nucleotide sequence of Chinese hamster(Cricetulus griseus)mitochondrial DNA*Full Length Research Article[J].Mitochondrial DNA,2007,(18):341.
[15]黄族豪,梅文枫,程亚林,刘迺发.鸟类线粒体DNA控制区研究进展[J].安徽农业科学,2009,(8):3427.
[16]郭学光,郭乔楠.线粒体DNA控制区研究进展[J].肿瘤防治杂志,2005,(22):1747.
[17]颜亮,张雁,汪宁,张莉,聂刘旺.鳄龟科和平胸龟科线粒体控制区序列分析和结构比较[J].动物学研究,2008,(29):127.
