半干旱区沙地芦苇对浅水位变化的生理生态响应
2013-12-09马赟花张铜会刘新平
马赟花, 张铜会,刘新平
(中国科学院寒区旱区环境与工程研究所, 兰州 730000)
半干旱区沙地芦苇对浅水位变化的生理生态响应
马赟花, 张铜会*,刘新平
(中国科学院寒区旱区环境与工程研究所, 兰州 730000)
在半干旱区科尔沁沙地研究沙地芦苇生长发育对地下水位改变的响应。通过比较不同地下水位深度下沙地芦苇生态特征,结果表明:与对照相比,0—200 cm的水位条件更利于沙地芦苇的生长。但是这种生长特点随着水位深度不同而有所差异。具体表现为40—120 cm的水位条件下沙地芦苇的根冠比和垂直根长都随着水位深度的增加而逐渐增加,当地下水位大于120 cm时根冠比的趋势则相反;根长密度值则表现出在0—120 cm水位条件下的要大于120—200 cm水位条件下的;而40 cm的浅水位表现出了对沙地芦苇生长的抑制作用,即在这种水位条件下会抑制沙地芦苇的蒸腾光合作用、减小叶面积的增长,但是其最终的株高叶面积及生物量仍表现出优于对照的生长状况。
科尔沁沙地;地下水位;沙地芦苇;马氏瓶;生理生态特征
地下水是干旱区植被生存所依赖的最为重要的水分来源,地下水位改变对植物叶面积、生物量、蒸腾速率、净光合速率等生理特征会产生很大影响,如赵明[1]等研究表明荒漠区2年生植物蒸腾量随地下水位的下降而降低。Horton[2- 3]等指出在半干旱区植被的净光合速率在干旱年份均随着地下水位的下降而下降。地下水位的改变同时会直接影响植物地上部分及地下根系的结构与功能从而影响植被的生长分布甚至群落演替。国内外一些学者已经开展了大量有关地下水变化和天然植被关系的研究[4- 5],如干旱区生物过程微弱,生物生态系统规模小、稳定性低,地下水的变化会直接影响天然植被的生长发育。因为随水位的下降,土壤含水量也随毛管水的补给减少而下降,从而导致土壤的有效含水量不能满足植物的生理需要。在科尔沁沙地,近二三十年来,由于人类活动加剧、气候干旱,该地区大面积沙化,出现了河流断流、湖泊萎缩甚至消失,引起了地下水位下降等一系列生态环境问题[6- 8]。而沙地芦苇(Phragmitescommunis)作为干旱区特有的旱生型芦苇,属根茎型禾草,由于其广泛的适应性,根系结构和生理生态方面在干旱的沙地生境中都已经发生了深刻的变异,其强大的地下根系在减少沙尘暴、保护绿洲农田、改良盐碱地、防护沙漠公路有着其他干旱区植被不可替代的生态作用[9]。但是目前有关地下水位的改变对沙地芦苇影响的研究仍相对缺乏。
由于多年生芦苇在沙地生态系统中的根系分布通常较深,在自然条件下定量研究地下水埋深对芦苇的影响存在一定难度,但通过人工控制试验, 可以有效的探讨沙地芦苇对地下水位的生理生态特征响应机制。因此,本研究以科尔沁沙地芦苇为研究对象, 通过人工控制试验,探讨沙地芦苇的生理生态变化及对浅层地下水位变化的响应机制。
1 材料与方法
1.1试验区概况[10]
本试验在中国科学院寒区与旱区环境与工程研究所科尔沁沙地奈曼沙漠化研究站的农田综合水分试验场(42°54′N, 120°41′E)进行。科尔沁沙地位于内蒙古自治区东部,属于半干旱大陆性季风气候区,春季干旱多风,年均气温6.5 ℃, 1月平均气温-13.1 ℃,极端最低气温-29.7 ℃, 7月平均气温23.6 ℃,极端最高气温39.0 ℃, ≥10 ℃年积温3218 ℃,无霜期 151 d,多年平均降水量在360 mm左右,年均蒸发量1935.4 mm。年均日照2951.2 h,年均风速 3.5—4.5 m/s, 其中4—5月平均风速可达5.0—6.0 m/s 。
1.2 实验设计
本试验主要观察研究芦苇在不同的浅层地下水位条件下的生长发育状况。考虑到实际可操作性和当地芦苇的生长特性,地下水位共设计了40、80、120、180 cm和对照CK 5个处理,每个处理3个重复。试验均在直径为30 cm的 PVC桶中进行,前4个试验处理的PVC桶是封底的,对照CK的PVC桶则不封底。2011年4月开始准备试验。第一步先将高度分别为0.6、1、1.4、2 m试验桶以及每行相应的对照PVC桶埋入地下。第二步将试验桶中装入直径大于10 mm的石子,厚度为10 cm,再将直径大于2 mm的粗沙铺到石子上面,厚度也为10 cm,这样就可在桶底形成20 cm的自由水面层。最后将原状固定沙丘土回填到桶中。第三步选择固定沙丘上长势一致的成年沙地芦苇,挖取带芽根系,选直径约为5 mm,长度为15 cm且带两个芽的根茎剪下来,植种在实验桶中。在初期将所有栽种的芦苇浇适量的水并记录浇水量,待芽将土面顶出裂缝即芦苇成活为止。第四步在需要控制水位的试验桶上安装简易的马氏瓶装置控制水位并记录人为加水量。对照则不安装控制水位装置。控制水位的PVC桶里的土壤既可接受来自天然降水的水分,也可接受由马氏瓶装置模拟提供的不同深度的地下水的水分;对照的PVC桶则只能接受来自天然降水的水分。因为实验区周围的地下水位约为7.34 m,基本可以认定本实验中的芦苇在自然状态是不可能利用到地下水的。
1.3 数据获取和计算
选取沙地芦苇光合呼吸等生理特征参数较稳定且其生物量基本达到峰值的8 月中下旬进行株高、地上生物量、叶面积、根系的调查以及用LI- 6400测定叶片的光合和蒸腾速率。用叶面积仪测量单株叶面积。用TRIME-FM-P3(IMKO Micromodultechnik, Ettlingen, Germany)便携式土壤水分测量仪监测芦苇生长期间的土壤表层0—15 cm的土壤体积含水量动态。
用全挖法测定地下生物量和垂直根系的长度。具体方法为是先进行植株高度测量,然后剪去地上部分以备叶面积等指标。然后用尖头铁铲从PVC桶的桶壁向中间的芦苇根部挖取,尽量不要损伤根系,若有散断的根系全部从挖出的土中将挑出,沿着桶壁每20 cm为一层逐层挖取直到无根系出现为止,洗净后将直径大于2 mm的粗根与直径小于2 mm的细根分开,分别测量其长度。
在本研究中生物量以每个实验桶中生产的所有干重来表示。所有生物量在80 ℃,烘干48 h后称重。
根冠比、根长密度的计算。根长密度是指单位体积土壤中根系的长度,本实验中根长密度用每立方米土壤中根长的米数来表示。
1.4 统计分析方法
用Excel软件对数据整理和初步分析,采用SPSS17.0统计分析软件包对数据进行One-way ANOVA方差分析、相关分析,并用LSD法进行多重比较株高、叶面积、生物量、根长密度、光合蒸腾速率各指标在处理间的差异。
2 结果与分析
2.1不同地下水位下0—15 cm表层土壤的体积含水量
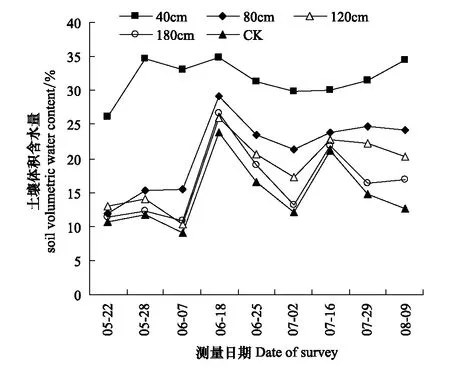
图1 不同地下水位条件下0—15cm表层土壤的体积含水量Fig.1 The soil volumetric water content of the 0—15cm topsoil at different water tables
在芦苇生长时期用TRIME-PICO TDR便携式土壤水分测量仪测量不同地下水位深度条件下0—15 cm表层土壤的体积含水量,所得结果动态曲线图1所示。
由下图的监测结果可知,0—15 cm表层土壤的体积含水量与地下水位深度成反比,即地下水位越浅,表层的土壤含水量越大,反之越小。图1中地下水位为40 cm条件下,在芦苇的整个生长时期表层土壤含水量几乎都处于饱和状态而不会由于受降水的影响有的波动,而当地下水位为80、120 cm条件下时,表层土壤含水量由于受降水的影响都出现了较小的波动,且在地下水位增加到180 cm和CK时,即随着地下水位深度的增加,表层土壤含水量由于受降水的影响出现的波动也随着变大。这种变化必然会引起沙地芦苇的生理生态特征在新环境中表现出一定的适应性。
2.2 不同地下水位下沙地芦苇生态统计特征。
2.2.1 不同地下水位下沙地芦苇的株高、叶面积
地下水位变化影响着土壤水分,而土壤水分一直是沙地芦苇生长发育的限制因素,因此地下水位的变化会影响到沙地芦苇的植株高度。如图2所示各处理间的沙地芦苇植株高度都表现出显著差异。植株高度表现出随地下水位降低先增加后减小的变化趋势。其中地下水位在80 cm时植株的高度最高为92.92 cm,而最低值51.42 cm出现在对照,其余都处于这二者之间。即株高从地下水位为40 cm逐渐增加到80 cm时达到峰值,之后随着水位的降低株高也逐渐减小并在对照水位的情况下呈现出最小值。比起对照,200 cm以下的水位条件更利于沙地芦苇的株高的增长,且在80 cm时植株高度最大。
图2中还显示出不同地下水位下沙地芦苇植株叶面积在水位为120 cm时最大,其它水位条件下芦苇单株叶面积均有所减小且差异显著。即在水位小于120 cm时,沙地芦苇的植株叶面积会随着水位的变浅而减小,这种适应性与土壤水分近似饱和的环境有关,而当水位深于120 cm时,芦苇的植株叶面积会随着水位深度的增加而减小,这是由于地下水位的下降使得土壤从地下水得到供给的减少,从而影响到地上部分叶面积的增长。
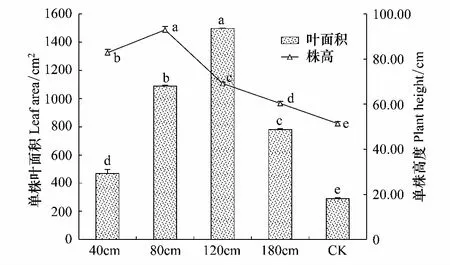
图2 不同地下水位条件下芦苇的植株高度与单株叶面积 Fig.2 The plant height and Leaf Area at different water tables 横坐标的40、80、120、180 cm为人工控制的地下水位的深度,CK为对照; 同一变量字母a、b、c、d、e的不同表示该变量在0.05水平上有显著差异
2.2.2 不同地下水位下沙地芦苇地上与地下生物量
不同地下水位对沙地芦苇地上与地下生物量与根冠比的影响见图3。从图中可看出沙地芦苇地上与地下部分的生物量均在地下水位为120 cm时最大,而较浅水位(40,80 cm)和较深水位条件(180 cm,CK)芦苇的生物量的积累都会减小且差异显著。这说明地下水位的变化影响了沙地芦苇的生物量的积累。当水位较深时,不论是地上部分还是地下根系的生物量都会随着水位的增加而减小。如对照的沙地芦苇生物量积累小于浅水位(40 cm)条件下的积累量,这说明在本实验中栽种第1年的芦苇根系在深水位的干旱胁迫下,比起浅水位下的水涝胁迫,更会影响到生物量的积累,从生态学的角度讲,沙地芦苇是典型的浅水植物在干旱地区后适应的生态类型[11],本实验中的沙地芦苇对水涝胁迫表现出了比在干旱胁迫中更强的适应性。
图3还显示了不同地下水位下沙地芦苇的根冠比,在水位为40 cm时,沙地芦苇的根冠比最小为1.23,地下水位在40 cm到120 cm之间时随着水位深度的增加,根冠比逐渐增加,而当水位大于120 cm时随着水位深度的增加,根冠比又会逐渐减小,这说明地下水位的变化影响了干物质的分配比例。对照沙地芦苇的根冠比大于浅水位(40 cm)条件下的根冠比,这说明在深水位的干旱胁迫条件下分配到地下根系的生物量比例要大于在浅水位条件下的分配量。

图3 不同地下水位条件下芦苇的生物量 Fig.3 The changes of the Phragmites biomass at different water table
2.3不同地下水位下沙地芦苇粗根与细根的长度、根长密度。
图4显示,当水位在80 cm与120 cm时,沙地芦苇整株的粗、细根的长度均较长,粗根总根长可达到8.5 m以上,细根总根长可达34.2 m。而其它水位条件下的细根总根长则达不到这个长度,说明地下水位的深度影响了根系的长度。而且地下水位深度还会影响到芦苇根系的分布状况,通常用根长密度来表示。沙地芦苇粗根和细根的根长密度在地下水位为80 cm时最大,密度分别为156.76 m/m3和605.10 m/m3,而其最低值21.76 m/m3和14.86 m/m3均出现在对照中,其余都处于这二者之间(图4)。不论是粗根还是细根,沙地芦苇的根长密度表现出随地下水位降低先增加后减小的变化趋势。

图4 不同地下水位条件下芦苇粗细根的长度与根长密度Fig.4 The length of thick roots and fine roots and root long density at different water tables
2.4 不同地下水位下沙地芦苇的光合生理指标。
图5为不同地下水位下沙地芦苇叶片的光合速率和蒸腾速率,图中显示地下水位在80—180cm时的沙地芦苇的光合速率较高且相互无显著差异,而在浅水位40 cm与对照时沙地芦苇的光合速率均小于以上水位下的光合速率且无显著差异。说明地下水位在80—180 cm时,最适合沙地芦苇生长,其光合作用可以维持较高速率,有利于干物质的积累;浅水位40 cm的条件虽然向沙地芦苇提供了足够的水分,但此时反而抑制了光合作用;而在对照干旱的条件下的叶片光合速率也较小。图5中所显示的不同地下水位下沙地芦苇蒸腾速率的变化趋势与光合速率相似,在浅水位40 cm时,沙地芦苇蒸腾速率也小于其它水位水平下的蒸腾速率。这与图6中显示不同地下水位下沙地芦苇的气孔导度和胞间CO2浓度变化趋势相呼应,即在浅水位40 cm下沙地芦苇叶片气孔导度和胞间CO2浓度最小,在80 cm、120 cm、180 cm水位条件下时大于在40 cm水位条件下的气孔导度和胞间CO2浓度但三者之间无显著差异,而对照的气孔导度和胞间CO2浓度则小于这三者且有显著差异而大于在40 cm浅水为条件下的值。
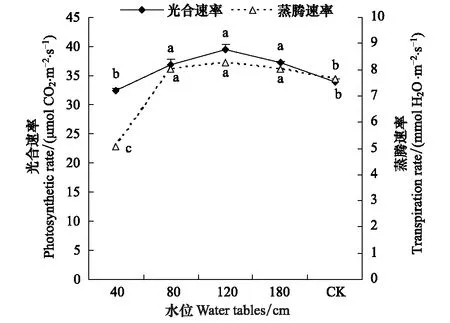
图5 不同地下水位条件下芦苇的光合速率和蒸腾速率Fig.5 The photosynthetic rate and transpiration rate at different water tables
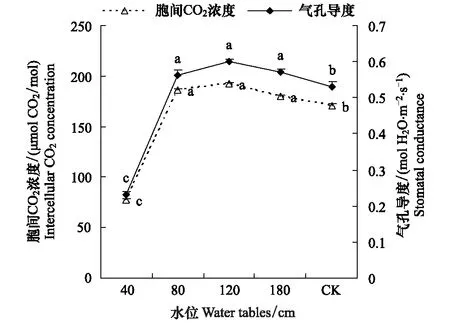
图6 不同地下水位条件下芦苇的胞间CO2浓度和气孔导度Fig.6 The intercellular CO2 concentration and stomatal conductance at different water tables
3 讨论
3.1 地下水位的变化对沙地芦苇形态特征的影响
芦苇本是一种典型的浅水植物, 但因生境条件的差异,使得其生长和生产具有较大的生态可塑性[12]。在本实验中沙地芦苇的形态特征受地下水位的影响表现出了其强大的适应性。
首先,植株高度与叶面积均表现出随地下水位降低先增加后减小的趋势,植株高度在地下水位为80 cm时达到峰值。植株叶面积在120 cm时达到峰值。比起对照自然水位条件下,200 cm以下的水位条件更利于沙地芦苇的株高和叶面积的增长。但是在40 cm的浅水位条件下,表现出了浅水位对沙地芦苇的一定的抑制作用,这是因为在在40 cm浅水位条件下,土壤水分近似饱和的状态下,根系缺氧导致叶片的气孔关闭,继而影响光合相关酶类的活性与此同时叶绿素合成能力下降最后导致绿色面积减少从而影响了地上叶片部分的发育,因此在本实验中低水位不仅不会促进沙地芦苇植株叶面积的增加反而会抑制其增长[13]。即使在浅水位条件下受到了抑制,沙地芦苇还是表现出了比在干旱条件下更为强大的适应性,在40 cm时的水位下沙地芦苇的高度和叶面积仍然要优于在自然水位情况下的生长状况,由此可见较浅水位条件下更利于沙地芦苇的株高的增长。这与张潇予和苏芳莉等[14]的研究结果类似,他们发现地下水位埋深在小于40 cm时,地下水埋深越浅, 芦苇植株生长越高。
其次,地下水位的变化也影响了沙地芦苇的生物量的积累与分配。当水位大于120 cm时,不论是地上部分还是地下根系的生物量都会随着水位的增加而减小,这说明比起浅水的水涝胁迫,较深水位的干旱胁迫更会影响到生物量的积累。这与在赵文智,常学礼等的研究[15]结果类似而具体的变化特点不同,他们发现芦苇种群地上生物量与地下水埋深的关系是随地下水埋深的增加而增加,变化特点为当在地下水埋深小于150cm时,生物量的变化不明显, 当地下水埋深大于150 cm时呈波动式增加。
再次,地下水位的变化还影响了沙地芦苇的根冠比。本实验中沙地芦苇生物量分配表现为当地下水位在40 cm到120 cm之间时随着水位深度的增加,根冠比逐渐增加,而当水位大于120 cm时随着水位深度的增加,根冠比又会逐渐减小。这与赵文智,常学礼等[15]的研究结果相似,他们发现随着地下水埋深的增加芦苇种群的生长优势逐渐从地下转到地上, 地上生物量所占比重逐渐增加。
最后,地下水位的变化也影响了沙地芦苇粗、细根的长度和根长密度。本实验中当水位在80 cm与120 cm时,沙地芦苇整株的粗、细根的长度最长,而且粗、细根的根长密度在地下水位为80 cm时最大。而当地下水位在浅水位40 cm时的沙地芦苇粗、细根的根长密度均大于180 cm和CK时的,这是因为在浅水位时水分比较容易吸收, 土壤输水距离缩短, 增加吸水表面,所以其根长密度大;在较深水位时,土壤输水距离变长,此时芦苇根系表现出了向水性[4],为了寻找水源,致力于下扎垂直根系的生长,减小了根系表面积,沙地芦苇的根长密度就会减小。实际上由相关分析可知沙地芦苇的垂直根长与地下水位深度极显著正相关(0.945**)而与根长密度呈显著负相关(-0.601*)。此外由图4中的b图中显示,在地下水位在能够利用的情况下,沙地芦苇细根的根长密度要大于粗根的根长密度,实际上由相关性分析可知,沙地芦苇的根长密度与细根长极显著正相关(0.727**),而与粗根长度不相关(0.458),这与以前的研究结果类似[16- 17],根系中最活跃lt; 2 mm的细根的部分其形态特征直接与根系的功能特征相关,进一步会关系到生态系统的能量流动和物质循环过程[18- 19]。
此外,本研究的结果地下水位深度与粗根长相关但不显著(相关系数为0.43)而与细根长几乎不相关(相关系数为0.05)。这是因为直径大于2 mm的粗根是沙地芦苇的垂直生长的根系,主要是向水性的作用[4],随着地下水位深度越深,沙地芦苇的垂直根长越长,而沙地芦苇的根长密度与直径小于2 mm的细根呈极显著正相关,而与粗根长度不相关,说明根长密度主要由细根长决定,而根长密度的大小则会影响到植物吸收土壤中的水分和养分[20- 21]。在以往的研究中发现植物根系通过调节直径的大小表现出对环境的适应性[18- 22],同一植物根系直径大小不同,其生理功能存在差异[23]。本实验中不同地下水位下沙地芦苇粗细根的长度、比例及其功能表现再次验证了以上研究结论。
3.2地下水位的改变对科尔沁沙丘芦苇光合生理指标的影响
本实验中在浅水位40 cm条件下, 土壤水分始终处于过饱和状态,虽然提供了足够的水分,但根系处于水涝状态。这种胁迫条件下在刘永贤,曾祥难等[24]在烟草叶片的研究中表现出的适应性就是气孔关闭, 使得气孔导度下降。同时气孔还是二氧化碳进入植物体、水蒸汽逸出植物体的通道,气孔关闭导致蒸腾速率下降,进一步影响光合效率。在本实验中沙地芦苇也表现出相似的适应性。在本研究中,一方面因为水淹作用,导致土壤缺氧,限制了根系的呼吸作用,从而影响到植株的整体生长发育以及叶片的光合作用。另一方面由于水涝的胁迫作用,导致沙地芦苇的叶片通过减小气孔导度,降低胞间CO2浓度,抑制沙地芦苇的蒸腾速率,同时还会抑制叶面积的增长。而在对照条件下土壤由于受地下水位的限制影响了土壤含水量,而水作为光合作用的原料之一, 当其供应不足时, 也直接导致光合速率的降低[25]。光合速率对气孔导度具有指示调节作用,光合作用处于优势时,气孔导度增大,劣势时气孔导度减小[26- 27]。
上述理由虽然能够解释本实验出现的这种现象,但是由于本研究中沙地芦苇的光合蒸腾指标是在芦苇的生殖生长期测量的一个瞬时值,所以地下水位的深度的改变是否总是令沙地芦苇的光合蒸腾一系列指标出现相似的的反应趋势,还有待于进一步的试验和验证。
[1] Zhao M, Guo Z Z, Wang Y L, Li A D, Zhang D K, Jia B Q. Study on the transpiration characteristics of 10 species of plants under the different depths of groundwater level. Arid Zone Research, 2003, 20(4): 286- 291.
[2] Horton J L, Kolb T E, Hart S C. Responses of riparian trees to interannual variation in ground water depth in a semi-arid river basin. Plant Cell and Environment, 2001, 24(4): 293- 304.
[3] Horton J L, Kolb T E, Hart S C. Physiologic response to ground water depth varies among species and with river flow regulation. Ecological Applications, 2001, 11(4): 1046- 1059.
[4] Chen Y, Li W H, Xu H L, Liu J Z, Zhang H F, Chen Y P. The influence of Groundwater on Vegetation in the Lower Reaches of Tarim River, China. Acta Geographica Sinica, 2003, 58(4): 542- 549.
[5] Barid A J, Robert L. Eco-Hydrology: Plants and Water in Terrestrial and Aquatic Environments. USA, Canada: Routledge, 1999: 401- 403.
[6] Zhu Z D, Chen G T. Land Sandy Desertification in China. Beijing: Science Press, 1994: 46- 59.
[7] Zhao H L, Zhao X. The ecological environment degradation and its control in the semi-drought region of Northern China. Arid Zone Research, 1993, 10(4): 44- 48.
[8] Liu X M, Zhao H L, Zhao A F. Wind-sandy Environment and Vegetation in the Horqin Sandy Land, China. Beijing: Science Press, 1996: 24- 30.
[9] He Y H, Zhao H L, Liu X P, Zhao X Y. Growth characteristics of phragmites australis in typical habitats of Horqin sandy land. Journal of Desert Research, 2009, 29(2): 288- 292.
[10] Zhao X Y, Zhang C M, Zuo X A, Huang G, Huang Y X, Luo Y Y, Wang S K, Qu H. Challengeto the desertification reversion in Horqin Sandy Land. Chinese Journal of Applied Ecology, 2009, 20(7): 1559- 1564.
[11] Liu M Z, Nurbay·Abdusalih, Jiang L, Pan X L. Study on utilizations of the wildtype reed in Xinjiang. Journal of Agricultural Sciences, 2005, 26(1): 76- 79.
[12] Yang Y F, Lang H Q. A study of population regulation ofPhragmitescommunisas aClonalplantin different ecological conditions. Acta Pratacultural Science, 1998, 7(2): 1- 9.
[13] Li R P, Wang J B. Plant Adversity Cells and Physiology. Wuhan: Wuhan University Press, 2002: 53- 70.
[14] Zhang X Y, Su F L, Wang L Y, Wang T L. Influence of groundwater depth on reeds budding and growth. Journal of Irrigation and Drainage, 2009, 28(3): 116- 117.
[15] Zhao W Z, Chang X L, Li Q S, He Z B. Relationship between structural component biomass of reed population and ground water depth in desert oasis. Acta Ecologica Sinica, 2003, 23(6): 1138- 1146.
[16] Mei L, Wang Z Q, Han Y Z, Gu J C, Wang X R, ChengY H, Zhang X J. Distribution patterns of Fraxinus mandshurica root biomass, specific root length and root length density. Chinese Journal of Applied Ecology, 2006, 17(1): 1- 4.
[17] Caldwell M M, Pearcy R W. Exploitation of environmental heterogeneity by plants: Ecophysiological processes above-and be-lowground. San Diego: Academic Press, 1994: 325- 347.
[18] Eissenstat D M, Wells C E, Yanai R D, Whitbeck J L. Building roots in a changing environment: implications for root longevity. New Phytologist, 2000, 147(1): 33- 42.
[19] Pregitzer K S, Deforest J L, Burton A J, Allen M F, Ruess R W, Hendrick R L. Fine root architecture of nine north American trees. Ecological Monographs, 2002, 72(2): 293- 309.
[20] Hendrick R L, Pregitzer K S. Temporal and depth-related patterns of fine root dynamics in northern hardwood forests. Journal of Ecology, 1996, 84(2): 167- 176.
[22] Schmid I, Kazda M. Clustered root distribution in mature stands ofFagussylvaticaandPiceaabies. Oecologia, 2005, 144(1): 25- 31.
[21] Forde B G, Lorenzo H. The nutritional control of root development. Plant and Soil, 2001, 232(1/2): 51- 68.
[23] Wang X R, Wang Z Q, Han Y Z, Gu J C, Guo D L, Mei L. Variations of fine root diameter with root order inManchurianashandDahurianlarchplantations. Acta Phytoecologica Sinica, 2005, 29(6): 871- 877.
[24] Liu Y X, Zeng X N, Zhou X, Nong M L, Ou Q H. Research progress of flood menace′s impact on tobacco′s physiological and biochemical characters. Journal of Guangxi Agriculture, 2007, 22(1): 32- 38.
[25] Zhu J J, Kang H Z, Li Z H, Wang G C, Zhang R S. Impact of water stress on survival and photosynthesis of Mongolian pine seedlings on sandy land. Acta Ecologica Sinica, 2005, 25(10): 2527- 2533.
[26] Chen M S, Ke S S, Ni Q Q. Diurnal variation of net photosynthetic rate and ecological factors ofViburnumodoratissimumin the field. Journal of Sichuan Normal University: Natural Science, 2004, 27(3): 298- 302.
[27] Tao J, Chen P, She X D. Studies on the photosynthetic characteristics of Ginkgo. Acta Horticulturae Sinica, 1999, 26(3): 157- 160.
参考文献:
[1] 赵明, 郭志中, 王耀琳, 李爱德, 张德魁, 贾宝全. 不同地下水位植物蒸腾耗水特性研究. 干旱区研究, 2003, 20(4): 286- 291.
[4] 陈亚宁, 李卫红, 徐海量, 刘加珍, 张宏峰, 陈亚鹏. 塔里木河下游地下水位对植被的影响. 地理学报, 2003, 58(4): 542- 549.
[6] 朱震达, 陈广庭. 中国土地沙质荒漠化. 北京: 科学出版社, 1994: 46- 59.
[7] 赵哈林, 赵雪. 中国北方半干旱地区生态环境的退化及其防治. 干旱区研究, 1993, 10(4): 44- 48.
[8] 刘新民, 赵哈林, 赵爱芬. 科尔沁沙地风沙环境与植被. 北京: 科学出版社, 1996: 24- 30.
[9] 何玉慧, 赵哈林, 刘新平, 赵学勇. 科尔沁沙地典型生境下芦苇的生长特征分析. 中国沙漠, 2009, 29(2): 288- 292.
[10] 赵学勇, 张春明, 左小安, 黄刚, 黄迎新, 罗亚勇, 王少昆, 曲浩. 科尔沁沙地沙漠化土地恢复面临的挑战. 应用生态学报, 2009, 20(7): 1559- 1664.
[11] 刘明智, 努尔巴衣, 阿布都沙力克, 江凌, 潘晓玲. 新疆野生植物资源芦苇多用化研究. 农业科学研究, 2005, 26(1): 76- 79.
[12] 杨允菲, 郎惠卿. 不同生态条件下芦苇无性系种群调节分析. 草业学报, 1998, 7(2): 1- 9.
[13] 利容干, 王建波. 植物逆境细胞及生理学. 武汉: 武汉大学出版社, 2002: 53- 70.
[14] 张潇予, 苏芳莉, 王立业, 王铁良. 地下水埋深对芦苇出苗及苗期生长发育的影响. 灌溉排水学报, 2009, 28(3): 116- 117.
[15] 赵文智, 常学礼, 李启森, 何志斌. 荒漠绿洲区芦苇种群构件生物量与地下水埋深关系. 生态学报, 2003, 23(6): 1138- 1146.
[16] 梅莉, 王政权, 韩有志, 古加存, 王向荣, 程云环, 张秀娟. 水曲柳根系生物量、比根长和根长密度的分布格局. 应用生态学报, 2006, 17(1): 1- 4.
[23] 王向荣, 王政权, 韩有志, 谷加存, 郭大立, 梅莉. 水曲柳和落叶松不同根序之间细根直径的变异研究. 植物生态学报, 2005, 29(6): 871- 877.
[24] 刘永贤, 曾祥难, 周晓, 农梦玲, 欧清华. 水涝胁迫对烟草生理生化特征影响的研究进展. 广西农学报, 2007, 22(1): 32- 38.
[25] 朱教君, 康宏樟, 李智辉, 王国臣, 张日升. 水分胁迫对不同年龄沙地樟子松幼苗存活与光合特性影响. 生态学报, 2005, 25(10): 2527- 2533.
[26] 陈模舜, 柯世省, 倪琼琼. 田间珊瑚树净光合速率及生态因子的日变化. 四川师范大学学报: 自然科学版, 2004, 27(3): 298- 302.
[27] 陶俊, 陈鹏, 佘旭东. 银杏光合特性的研究. 园艺学报, 1999, 26(3): 157- 160.
Eco-physiologicalresponseofPhragmitescommunistowatertablechangesintheHorqinSandLand
MA Yunhua,ZHANG Tonghui*, LIU Xinping
ColdandAridRegionsofEnvironmentalandEngineeringResearchInstitute,ChineseAcademyofSciences,Lanzhou730000,China
This study examines growth responses ofPhragmitescommunisto controlled changes in the water table in the semiarid areas of the Horqin Sand Land. Water table level treatments were a natural control which the water table is deeper than 200 centimeters, 40 centimeters, 80 centimeters, 120 centimeters and 180 centimeters below the soil surface. We found that the water table between 0—200 centimeter was more advantageous for Phragmites to grow than natural control. And also we found significantly different growing characteristics ofPhragmitescommuniswith the different water table depths.The root-shoot ratio and the vertical root length increased gradually as the water table decreased from 40—120 cm,whereas the root-shoot ratio increased below a water table of 120 cm. The root density of thePhragmitescommuniswas higher at water tables of 0—120cm than at water tables of 120—200 cm. At shallow water tables above 40cm depth, although rates of transpiration and photosynthesis ofPhragmitescommuniswas inhibited, however plant height, leaf area and biomass of thePhragmitescommunisat shallow water was higher than that at natural control.
Horqin Sand Land; water table;Phragmitescommunis; Marriott glasses; characteristics of photosynthesis and transpiration
973项目课题资助项目 (2009CB421303); 国家科技支撑项目课题资助项目(2011BAC07B02); 中国科学院战略性先导科技专项子专题(XDA05050201-04-01); 国家自然科学基金(41371053)
2012- 07- 09;
2013- 03- 14
*通讯作者Corresponding author.E-mail: zhangth@lzb.ac.cn
10.5846/stxb201207090963
马赟花, 张铜会,刘新平.半干旱区沙地芦苇对浅水位变化的生理生态响应.生态学报,2013,33(21):6984- 6991.
Ma Y H,Zhang T H,Liu X P.Eco-physiological response ofPhragmitescommunisto water table changes in the Horqin Sand Land.Acta Ecologica Sinica,2013,33(21):6984- 6991.
