珠海鹤洲水道沿岸红树林湿地大型底栖动物群落特征
2013-12-09方展强
王 卉,钟 山,方展强
(华南师范大学生命科学学院,广东省高等学校生态与环境科学重点实验室, 广州 510631)
珠海鹤洲水道沿岸红树林湿地大型底栖动物群落特征
王 卉,钟 山,方展强*
(华南师范大学生命科学学院,广东省高等学校生态与环境科学重点实验室, 广州 510631)
对珠海鹤洲水道沿岸围垦湿地的4个红树人工林(包括老鼠簕Acanthusilicifolius、木榄Bruguieragymnorrhiza、秋茄Kandeliacandel和无瓣海桑Sonneratiaapetala)样地和2个挺水植被样地(短叶茳芏Cyperusmalaccensisvar.brevifolius和芦苇Phragmitesaustralis)的大型底栖动物群落进行为期1a的生物调查。利用大型多元分析软件Primer 5的等级聚类分析CLUSTER(基于Bray-Curtis相似性矩阵)和非参数多变量标序NMDS分析大型底栖动物的群落结构,鹤州北围垦湿地6种生境下大型底栖动物在非相似度55%的条件下被划分为3组(组1:短叶茳芏-老鼠簕-木榄组合;组2:无瓣海桑组合;组3:秋茄-芦苇组合)。组1栖息地其大型底栖动物以谭氏泥蟹(Ilyrplaxdeschampsi)和多毛类为主,其中老鼠簕样地大型底栖动物物种数目(19种)、物种丰富度(d=1.93±0.11)和多样性指数(H′=1.51±0.13)均为全部6种生境最高;短叶茳芏样地的栖息密度((254.67±156.81) 个/m2)在6种生境中最高。组2栖息地其大型底栖动物以攀援型螺类和无齿螳臂相手蟹(Chiromantesdehaani)为主,生物量((32.06±19.62) g/m2)在6种生境中最高,物种丰富度(d=1.28±0.45)和多样性指数(H′=1.04±0.27)居中。组3栖息地其大型底栖动物以麦克碟尾虫(Discapseudesmackiei)和多毛类为主,物种数、栖息密度、生物量和多样性指数均较低。SIMPER相似性百分比分析显示对群落划分起重要作用的物种主要为各个生境的优势物种。使用典范对应分析(CCA)对大型底栖动物分布与盐度、深度和温度3个环境因子的关系进行深入分析,并利用蒙特卡罗置换检验(Monte Carlo Permutation Test)鉴定环境因子的显著水平,其中盐度(Plt;0.05)和深度(Plt;0.05)与大型底栖动物分布差异显著相关,温度(Pgt;0.05)无显著相关。研究结果表明:不同生境大型底栖动物优势物种存在差异;盐度和深度是影响鹤州北围垦湿地大型底栖动物群落结构最重要的环境因子;围垦区人工湿地与自然滩涂大型底栖动物群落结构差异显著。
大型底栖动物;群落特征;红树林湿地;鹤洲水道;珠海
珠海市位于珠江出海口,海域内陆岸线长15.8 km,海岛岸线长601.2 km,滩涂宽阔,适合红树林生长的潮间带生境约有171 km2[1]。但是随着围垦造田和工业的快速发展,珠海市红树林面积急剧缩小。剩余的红树林湿地生物多样性水平则低下并且生态功能不完整[2]。近年来,珠海市大力保护并开展人工恢复红树林,引种速生红树种类无瓣海桑(Sonneratiaapetala),以达到恢复珠海红树林湿地生态系统的目的。
已有研究证明,大型底栖动物可以影响和调节红树林的结构和功能,并且可以通过掘穴、迁移、取食等活动,来介导潮汐流动、帮助冲刷沉积物中的有毒物质和降低红树植被间的种内竞争[3- 4]。另外,大型底栖动物的群落结构能反映出湿地底质条件、水质状况、水温等非生物因子以及植被、物种间的影响、捕食压力等生物因子的情况[5]。因此,国内外许多研究都认为十分有必要将大型底栖动物作为一种可靠有效的指标来评估红树林的生态恢复状态[6- 9]。
由于珠海鹤州北湿地围垦时间较短,而且围垦后大部分区域开发为农田和鱼虾养殖池塘,所以一直缺少相关的湿地生态研究:鹤州北围垦湿地人工红树林恢复过程中大型底栖动物群落结构如何及变化趋势是什么?影响大型底栖动物群落结构最重要的环境因子是什么?本研究旨在填补珠海鹤州北围垦湿地的大型底栖动物生态现状的空白并为围垦湿地的生态修复提供科学依据。
1 材料与方法
1.1 研究区域概况
研究区位于广东省珠海市鹤州北鹤州水道沿岸(东经113°22′38″—113°24′52″,北纬22°7′58″—22°9′36″)人工种植红树林区湿地,属于低纬度亚热带季风区,日照充足,年平均气温22.4 ℃,最冷月1月14.5 ℃,最热月7月28.6 ℃;年平均降雨量1700—2300 mm,东风为常向风,空气平均相对湿度为79%。潮汐属不正规半日潮,平均高潮位0.17 m,平均低潮位-0.14 m,水质比较清洁;土壤属于滨海盐渍草甸沼泽土。
1.2 站位布设
在鹤洲水道沿岸围垦湿地共设置6个采样站位(图1),红树植物属于人工林,种植时间2a左右。围垦区内有若干条狭窄潮沟,呈田字形排列,其中一条潮沟(大致南北走向)与围垦区堤坝闸口相通。6个采样站位根据位于堤坝外侧临海自然滩涂(A)或是堤坝内侧临潮沟的围垦湿地(B)由西向东分别记为:短叶茳芏(Cyperusmalaccensisvar.brevifolius; 老鼠簕(Acanthusilicifolius);无瓣海桑(Sonneratiaapetala);木榄(Bruguieragymnorrhiza);秋茄(Kandeliacandel);芦苇(Phragmitesaustralis)。
1.3 采样方法及样品处理
采样时间为2010年12月、2011年3月、6月和9月份,分别对应冬季、春季、夏季和秋季4个季节。每个研究样地从沿岸端向近海水端选择4个较为典型的地方布设站点,采用25 cm × 25 cm的定量样框,每个站点取4个样,总计96个样方。先捡出框内底表动物,再挖至30 cm深的沉积物,用0.5 mm孔径筛子分选出底内动物,所获动物标本用5%的甲醛溶液现场固定,于实验室内分析鉴定。同时另取1 kg左右的沉积物作为土壤样本。盐度使用质量法测定,取全年平均值。
1.4 大型底栖动物生活型及功能群的划分

图1 珠海鹤洲北水道沿岸滩涂采样位点设置 Fig.1 Map of the study area showing the sampling sites along the waterways in the tidal flat of North Hezhou, Zhuhai
依据本实验的实际情况并参考范航清等、杨泽华等和葛宝明等[10- 12]的划分,本文将采获的大型底栖动物的生活型划分为:(1)面上生活型(GS),包括底上附着型[腹足纲所有种]和游泳底栖型[甲壳纲十足目所有种、鼠妇(Armadillidiumvulgare)、黄纹丽龙虱(Hydaticusvittatus)及弹涂鱼(Periophthalmusmodestus)];(2)面下生活群(GSB),包括底内型[多毛类、双壳纲所有种、纽虫、昆虫幼虫]和穴居型[甲壳纲蟹类、原足目、等足目、端足目]。
同时,本文主要依据大型底栖动物的食性,并参考朱晓君等和鲍毅新等[12- 14]的研究,将大型底栖动物划分为5个功能群: 即浮游生物食者(Pl)、植食者(Ph)、肉食者(C)、杂食者( O)和碎屑食者(D)。
1.5 数据处理
1.5.1 优势物种
Y=Pi×fi
(1)
式中,Pi为物种i的个体数占全部物种个体数的比例,fi为物种i在各个站位出现的频率,当Ygt;0.02时,该物种为优势种。
1.5.2 栖息密度和生物量分析
使用SPSS17.0软件包对站位中大型底栖动物群落的平均栖息密度和平均生物量等进行以季节和站位为因素的无重复双因素方差分析。
1.5.3 多样性测度
采用Margalef物种丰富度指数(d)、Shannon-Wiener多样性指数(H′) 以及Pielou均匀度指数(J′)。
Margalef物种丰富度指数
d=(S-1)/log2N
(2)
Shannon-Wiener指数
(3)
(4)
式中,S为总物种数,N为总个体数,Pi为物种i的个体数与全部物种个体数的比值。
1.5.4 大型底栖动物群落结构的分析
使用大型多元分析软件PRIMER 5对大型底栖动物群落结构进行分析。数据取各个站位全年平均栖息密度。为了减少机会种对群落结构的干扰,删除在总体中相对丰度lt;1%的种类,但保留其中任一站点相对丰度gt;3%的种类为非机会种,再将数据进行平方根处理后构建Bray-Curtis相似性矩阵,进行类平均法等级聚类(CLUSTER)和非参数多变量排序(NMDS)。使用SIMPER相似性百分比分析来确定对各个站位动物群落划分起主要作用的物种。
1.5.5 动物群落与环境因子的关系
使用CANOCO 4.5 for Windows中的典范对应分析(CCA)方法分析大型底栖动物物种与环境因子的关系,找出对大型底栖动物群落结构影响起主要作用的环境因子,并利用蒙特卡罗置换检验鉴定环境因子的显著水平。取大型底栖动物非机会种作为分析物种,并且将大型底栖动物栖息密度和环境因子标准化以减少极端数值对典范对应分析的干扰。
2 结果与分析
2.1 不同生境大型底栖动物的种类组成
鹤州北4次采样共采集到大型底栖动物35种,隶属于5门8纲30科(表1),其中软体动物10种,占29%;甲壳动物10种,占29%;环节动物7种,占20%;鱼类1种,其他无脊椎动物7种,占22%。

表1 鹤州北大型底栖动物的物种、生活型和功能型的组成和分布
续表
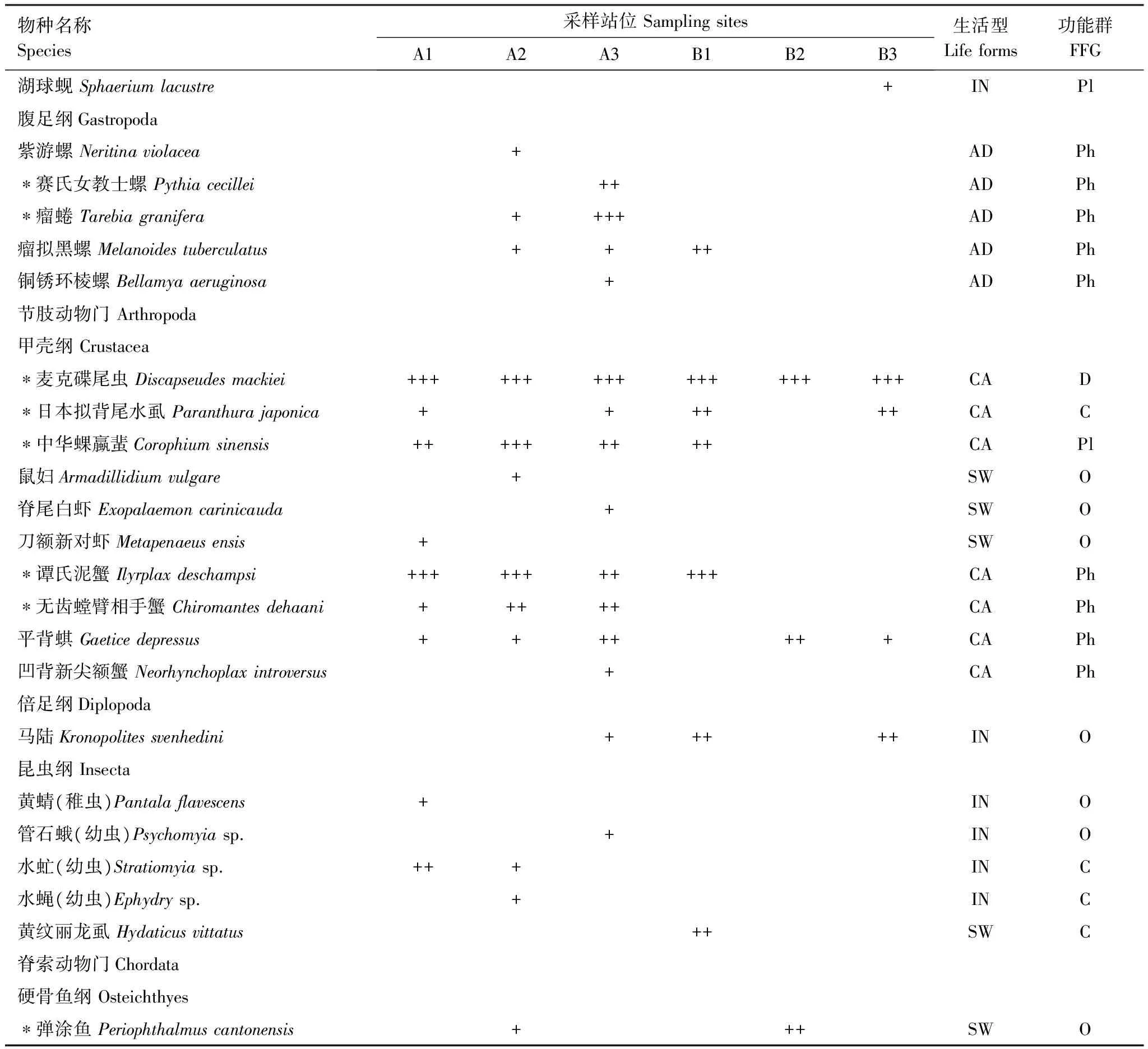
物种名称Species采样站位SamplingsitesA1A2A3B1B2B3生活型Lifeforms功能群FFG湖球蚬Sphaeriumlacustre+INPl腹足纲Gastropoda紫游螺Neritinaviolacea+ADPh∗赛氏女教士螺Pythiacecillei++ADPh∗瘤蜷Tarebiagranifera++++ADPh瘤拟黑螺Melanoidestuberculatus++++ADPh铜锈环棱螺Bellamyaaeruginosa+ADPh节肢动物门Arthropoda甲壳纲Crustacea∗麦克碟尾虫Discapseudesmackiei++++++++++++++++++CAD∗日本拟背尾水虱Paranthurajaponica++++++CAC∗中华蜾蠃蜚Corophiumsinensis+++++++++CAPl鼠妇Armadillidiumvulgare+SWO脊尾白虾Exopalaemoncarinicauda+SWO刀额新对虾Metapenaeusensis+SWO∗谭氏泥蟹Ilyrplaxdeschampsi+++++++++++CAPh∗无齿螳臂相手蟹Chiromantesdehaani+++++CAPh平背蜞Gaeticedepressus+++++++CAPh凹背新尖额蟹Neorhynchoplaxintroversus+CAPh倍足纲Diplopoda马陆Kronopolitessvenhedini+++++INO昆虫纲Insecta黄蜻(稚虫)Pantalaflavescens+INO管石蛾(幼虫)Psychomyiasp.+INO水虻(幼虫)Stratiomyiasp.+++INC水蝇(幼虫)Ephydrysp.+INC黄纹丽龙虱Hydaticusvittatus++SWC脊索动物门Chordata硬骨鱼纲Osteichthyes∗弹涂鱼Periophthalmuscantonensis+++SWO
+:个体数lt;总个体数的1%;++:占总个体数的1%—10%;+++:gt;总个体数的10%;生活型 IN: 底内型; CA: 穴居型; AD: 底上附着型; SW: 游泳底栖型; 功能摄食类群 Pl: 浮游生物食者; Ph:植食者;D:碎屑食者;C:肉食者;O:杂食者; *非机会物种
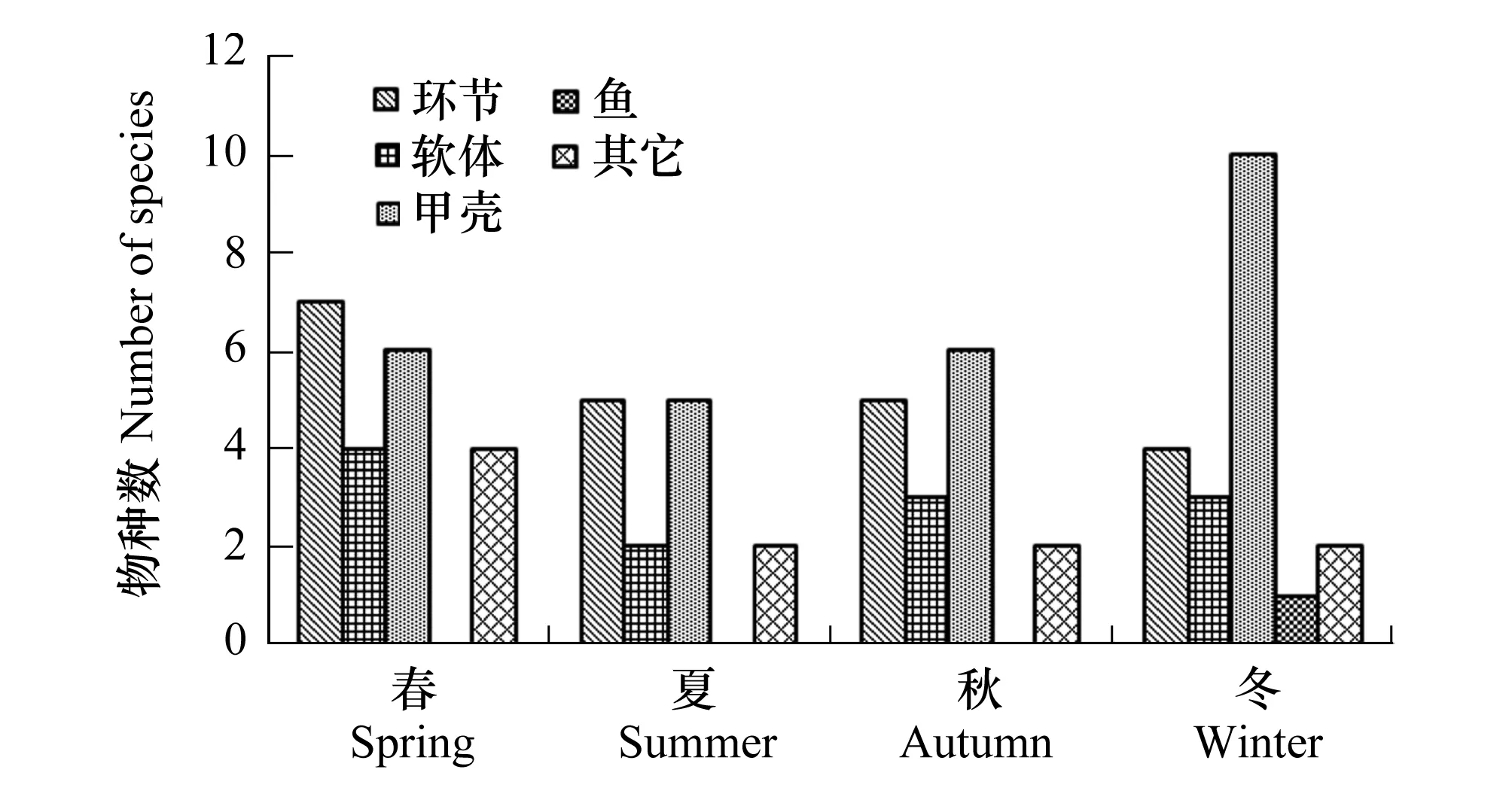
图2 大型底栖动物物种类群的季节分布 Fig.2 The distribution of macrobenthic assemblages in different seasons
鹤州北围垦湿地大型底栖动物的动物类群季节分布见图2,春季采获的物种最多,为21种,主要类群为环节动物和甲壳动物;冬季为20种,主要类群为甲壳动物;秋季16种,主要为甲壳动物和环节动物;夏季最少,为14种,主要为环节动物和甲壳动物。
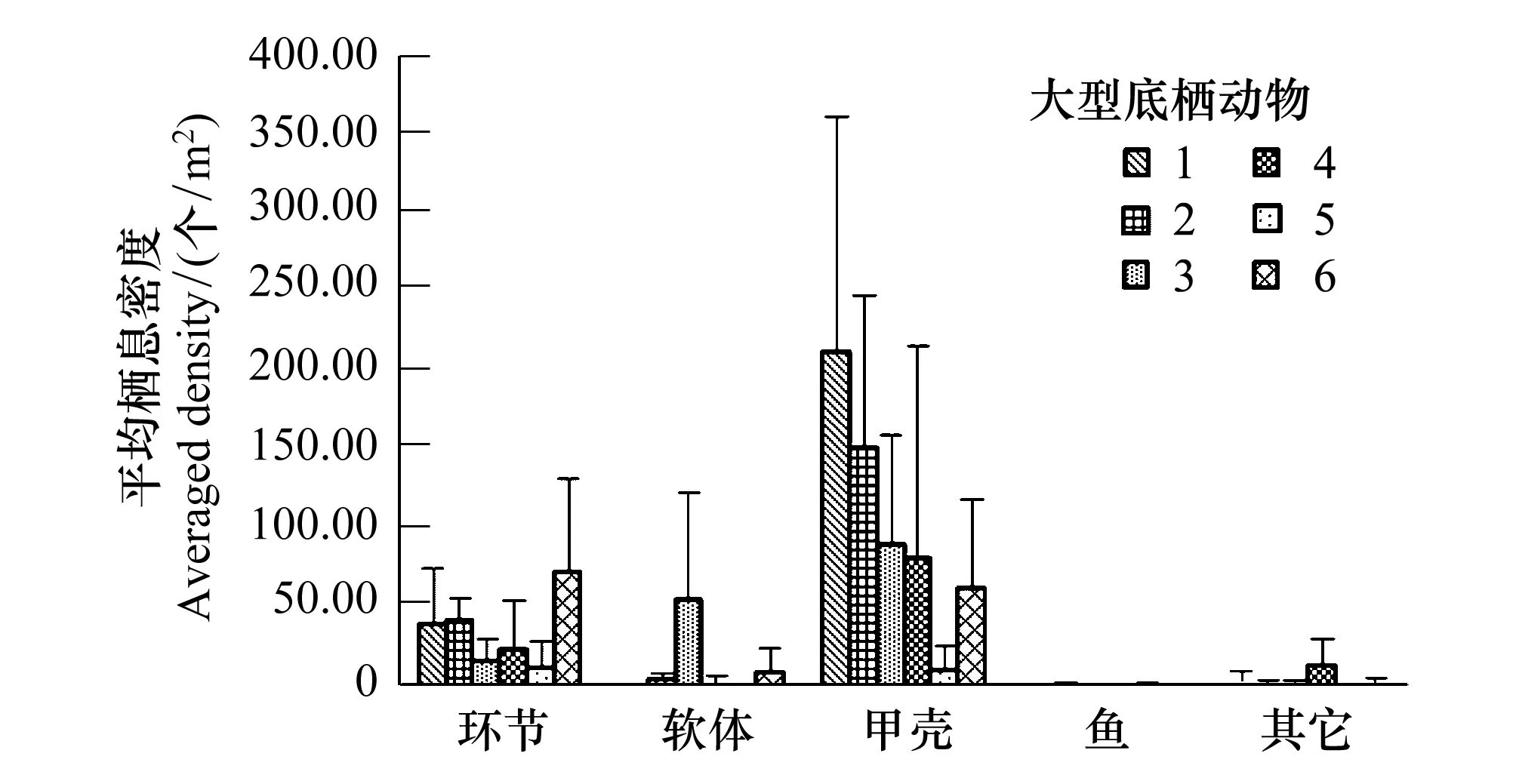
图3 大型底栖动物物种类群的站位组成 Fig.3 The composition of sampling sites at different macrobenthic assemblages环节 Annelida;软体 Mollusca;甲壳 Crustacea;鱼 Fish;其他 Others; 1:短叶茳芏Cyperus malaccensis var. brevifolius; 2:老鼠簕Acanthus ilicifolius; 3:无瓣海桑Sonneratia apetala; 4: 木榄Bruguiera gymnorrhiza;5:秋茄Kandelia candel; 6:芦苇Phragmites australis
图3为鹤州北湿地6个站位中大型底栖动物类群的分布差异。从图中可以看出,鹤州北湿地大型底栖动物类群的种群数量差别很大,物种分布十分不均匀。其中甲壳动物的栖息密度最高,集中分布在短叶茳芏、老鼠簕两个站位,除秋茄站位分布很少外其他站位栖息密度居中; 环节动物在芦苇(B3)站位分布最多,其余各站位栖息密度相差不大;而软体动物分布最不均衡,在无瓣海桑栖息密度最大,其余各站位则鲜有分布。
2.2 优势物种
鹤州北围垦湿地不同采样站位大型底栖动物的优势物种见表2。其中小型原足目动物麦克碟尾虫是本研究唯一在6个站位和4个季节均有分布的物种,且栖息密度很高。羽须鳃沙蚕除无瓣海桑站位未采集到外,其他站位均有分布,且芦苇站位的栖息密度最高。谭氏泥蟹和无齿螳臂相手蟹均为中小型蟹类,谭氏泥蟹在老鼠簕和短叶茳芏站位栖息密度最高,秋茄和芦苇两个站位没有发现,无齿螳臂相手蟹在无瓣海桑站位栖息密度最高,在临潮沟的3个站位均未发现。赛氏女教士螺在6个站位中只在无瓣海桑站位发现,有大量成螺聚堆吸附在树干潮位线以上。

图4 大型底栖动物栖息密度和生物量的变化Fig.4 The changes of macrobenthic densities and biomass1:短叶茳芏Cyperus malaccensis var. brevifolius; 2:老鼠簕Acanthus ilicifolius; 3:无瓣海桑Sonneratia apetala; 4: 木榄Bruguiera gymnorrhiza;5:秋茄Kandelia candel; 6:芦苇Phragmites australis
2.3 平均栖息密度和平均生物量
鹤州北湿地季节间和站位间栖息密度和生物量变化见图4。以季节和站位为因素的栖息密度和生物量无重复双因素方差分析显示:栖息密度站位间无显著差异(F=1.808,Pgt;0.05),季节间差异显著(F=3.306,Plt;0.05);生物量站位间(F=3.302,Plt;0.05)差异显著,季节间(F=1.455,Pgt;0.05)不显著。秋季大型底栖动物的栖息密度和生物量均为4个季节中最大,主要是由于采获的小型蟹类谭氏泥蟹最多,谭氏泥蟹秋季全部站位栖息密度为732.00 个/m2,生物量为71.58 g/m2;而由于夏季采获质量较大而个数较少的赛氏女教士螺较多,造成夏季栖息密度最小,而生物量却偏大的现象。短叶茳芏站位栖息密度在6个站位中最大,主要是由于谭氏泥蟹栖息密度(4季总栖息密度为684.00 个/m2)很大所导致;无瓣海桑生物量最大是由于采到了较多的赛氏女教士螺。
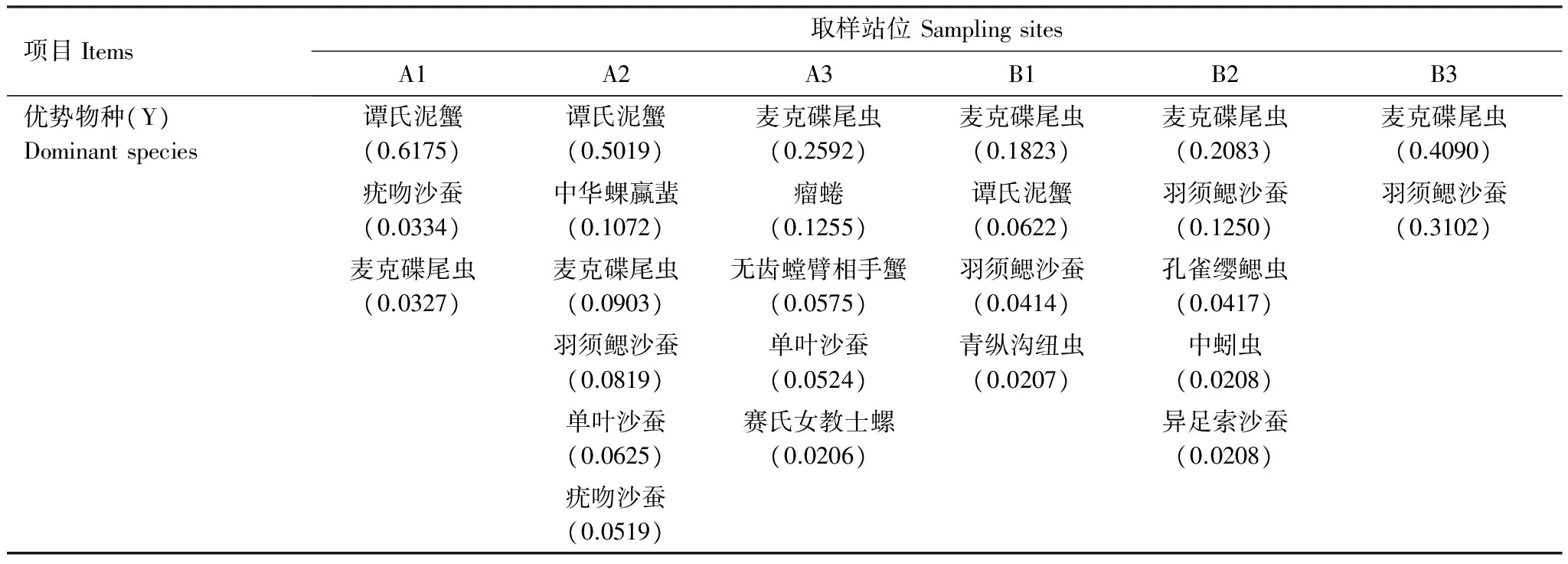
表2 不同采样站位大型底栖动物优势物种
2.4 物种生活型和功能群组成
鹤州北水道沿岸6个站位大型底栖动物生活型组成以及GS/GSB值见表3。底内型共18种,占绝对优势。

表3 不同采样站位大型底栖动物生活型及生活类群组成特征

图5 不同采样站位大型底栖动物功能群物种组成百分比 Fig.5 Relative number of species of the different functional feeding groups in different sampling sites
图5为6个站位大型底栖动物功能群的物种组成百分比。5种功能群类型的物种数量相差不大,其中肉食者6种(其中3种为昆虫幼虫)、杂食者7种,碎屑食者6种、植食者9种和浮游生物食者有7种。参照尤仲杰等[15]在研究象山港大型底栖动物功能群时对功能群的营养级的分类得出,鹤州北垦区大型底栖动物功能群第二营养级(植食者、浮游生物食者和碎屑食者)共22种,第三营养级(杂食者)为7种,第四营养级(肉食者)为6种。
2.5 生物多样性
鹤州北围垦湿地不同采样站位生物多样性指数的变化见表4。无重复双因素方差分析(以季节和站位为因素)表明,鹤州北湿地物种丰富度指数季节间差异不显著(F=1.490,Pgt;0.05),站位间差异显著(F=3.660,Plt;0.05);均匀度季节间(F=1.317,Pgt;0.05)和站位间(F=3.023,Pgt;0.05)均无显著差异;香浓威纳指数季节间差异显著(F=3.519,Plt;0.05),站位间差异不显著(F=2.081,Pgt;0.05)。物种丰富度指数以秋季和冬季的老鼠簕站位最高(分别为d=2.05和d=2.02),其次是冬季的无瓣海桑站位(d=1.95);香浓威纳指数为秋季的木榄站位(H′=1.76)和夏季的老鼠簕站位(H′=1.65)最高;均匀度站位间相差不大。综合比较,老鼠簕、无瓣海桑和木榄3个站位无论是物种丰富度,还是均匀度和香浓威纳指数,其指数均较高。

表4 不同采样站位大型底栖动物物种多样性指数
2.6 大型底栖动物群落结构
根据等级聚类分析图(图6a)可见,全年平均生物量在55%的非相似度下,被分为3个组,分别为组1:短叶茳芏-老鼠簕-木榄;组2:无瓣海桑;组3:秋茄-芦苇。非参数多变量标序(MDS)连续地展示样本间生物组成的相似关系, 即生物组成越相似的两个站位, 在MDS图上代表它们点的距离就越近; 生物组成相差越远的两个站位, 则代表它们的点在图上的距离就越远[1]。在非参数多变量标序(图6a)图中短叶茳芏、老鼠簕和木榄站位3个站位彼此紧邻,说明这3个站位的大型底栖动物群落非常相似。秋茄和芦苇站位相邻,并远离其他站位;无瓣海桑站位远离上述的两个分组,但距离短叶茳芏、老鼠簕和木榄站位分组较近。等级聚类分析和非参数多变量标序的结果一致。
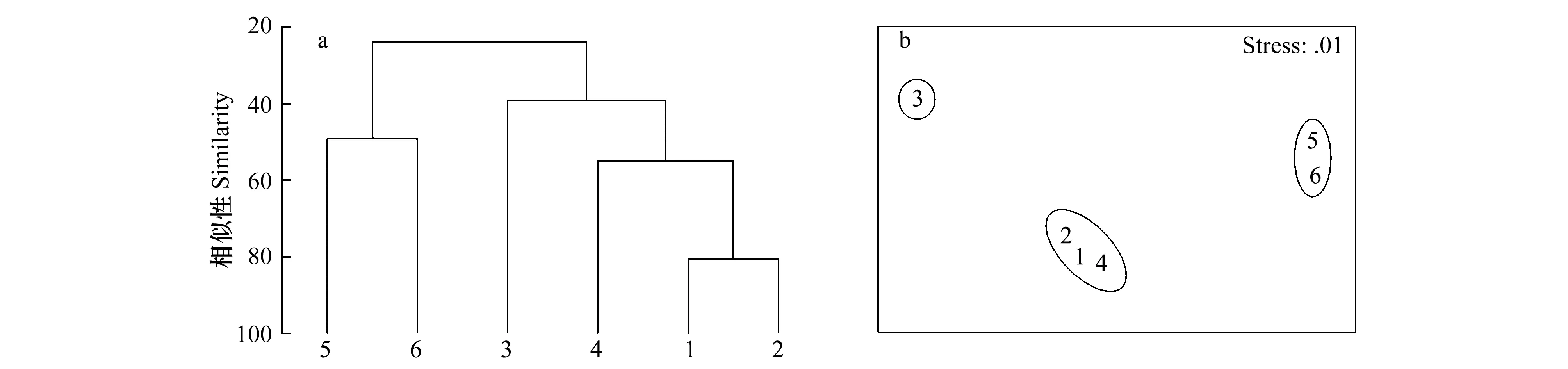
图6 鹤州北不同采样站位大型底栖动物群落结构的等级聚类分析(a)和非参数多变量标序(b)Fig.6 The hierarchical cluster dendrogram (a) and non-metric multidimensional scaling ordinations (b) of macrobenthic communities in different sampling sites
根据上述分组特征,利用群落间相似性百分比分析(SIMPER)对造成鹤州北湿地大型底栖动物群落结构差异的物种进行鉴定(表5),结果表明:瘤蜷除在秋季老鼠簕站位有极少量分布外和赛氏女教士螺一样只在组2(无瓣海桑站位)有大量分布,而羽须鳃沙蚕仅在组2(无瓣海桑站位)未发现,因此这3个物种对组2(无瓣海桑站位)与其他的组有区别贡献最大;谭氏泥蟹在组3未发现,而在组1栖息密度非常大,因此是造成组1和组3区别的最重要物种。
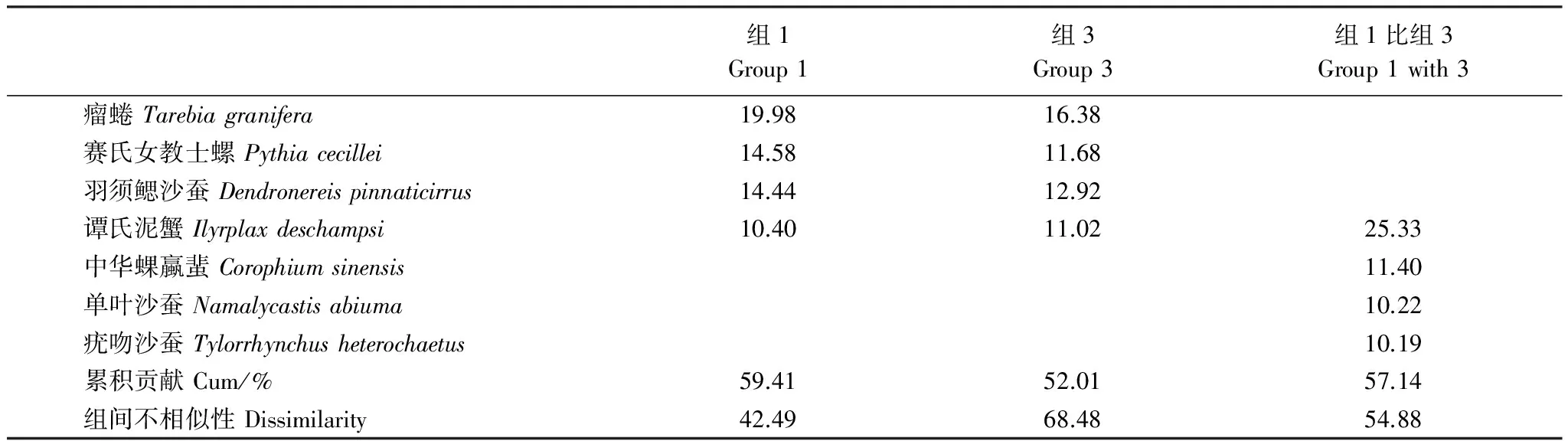
表5 鹤州北大型底栖动物群落组间物种相似性百分比分析
Group 1: A1+A2+B1, Group 2: A3, Group 3: B2+B3; 数据log10(X+1)转化后去掉低于累积贡献率50%的物种
2.7 大型底栖动物与环境因子的关系
表6为鹤州北围垦湿地不同站位环境因子的特征。使用典范对应分析(CCA)方法评估大型底栖动物主要物种(非机会种)和环境变量之间的关系(图7)。蒙特卡罗置换检验显示鹤州北围垦湿地大型底栖动物群落变化与盐度(Plt;0.05)、深度(Plt;0.05)变量相关性显著,但与温度(Pgt;0.05) 变量相关性不显著。疣吻沙蚕(3)、谭氏泥蟹(9)、单叶沙蚕(2)和中华蜾蠃蜚(11)分布在原点附近,说明盐度、深度和温度3个环境变量对其影响最小;瘤蜷(7)、赛氏女教士螺(8)和无齿螳臂相手蟹(12)与盐度、深度和温度变量正相关,其他的物种均与3个环境变量呈负相关;环境变量之间的夹角可以近似代表它们之间的相关性,盐度、深度和温度3个环境变量之间的相关性均较强,其中盐度和深度的相关性最强。
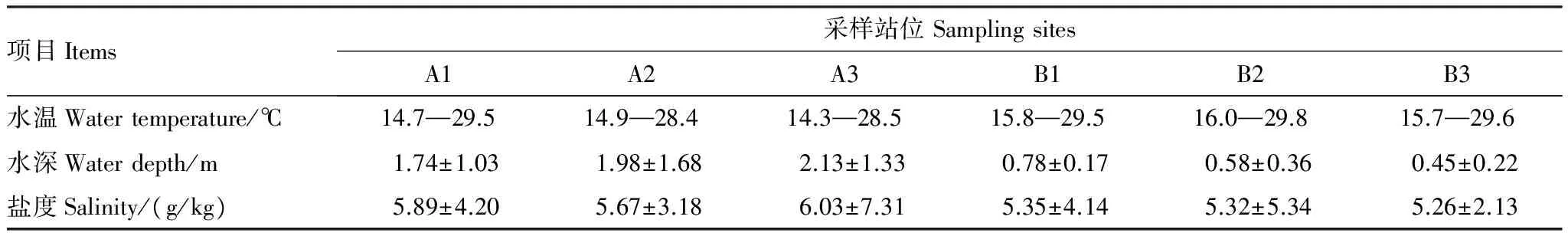
表6 鹤州北不同采样站位的环境特征
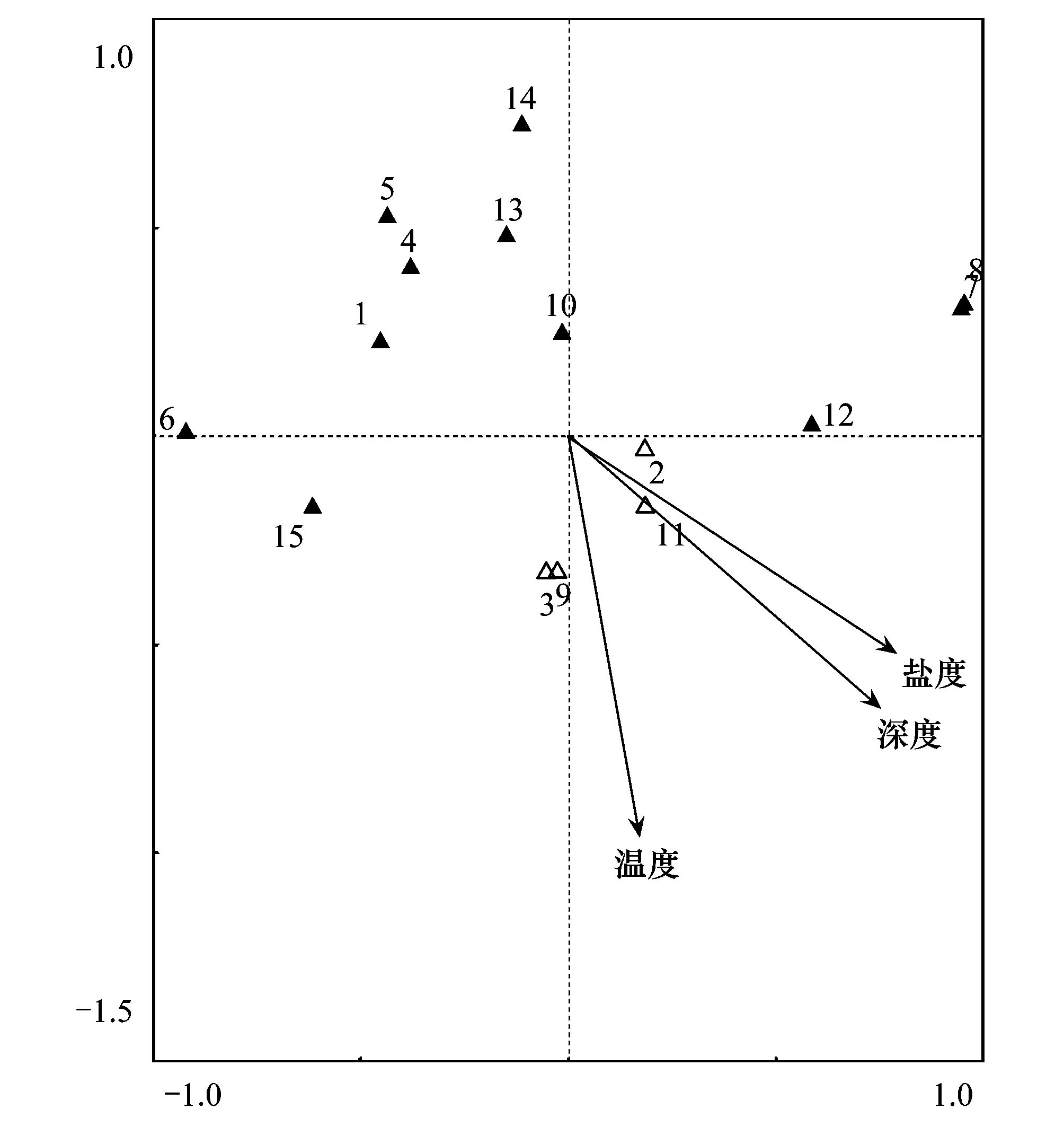
图7 典范对应分析物种和环境因子双标图 Fig.7 Biplot resulting from the canonical correspondence analysis(species×environmental variables)△:受环境影响较小的物种;▲:受环境影响较大的物种;箭头表示环境变量;Salinity:盐度;Depth:深度;Temperature:温度;1:羽须鳃沙蚕;2:单叶沙蚕;3:疣吻沙蚕;4:孔雀缨鳃虫;5:中蚓虫;6:异足索沙蚕;7:瘤蜷; 8:赛氏女教士螺;9:谭氏泥蟹;10:麦克碟尾虫;11:中华蜾蠃蜚;12:无齿螳臂相手蟹;13:日本拟背尾水虱;14:青纵沟纽虫;15:弹涂鱼
3 讨论
3.1 鹤州北围垦湿地大型底栖动物群落的结构特征
6个站位大型底栖动物物种组成结构简单,优势种的体积小、种类单一,多为繁殖力强的r-对策的小型的甲壳动物,缺少大型蟹类和软体动物。这与章飞军等[16]研究结果相一致。单一种的优势地位越突出、主导群落的种类越少,则群落的多样性水平越低[17]。某一物种的优势很突出,可能说明环境正处于压力之下,而比较高的多样性则可能代表环境更加稳定成熟[8]。在鹤州北湿地6个站位中,优势种麦克碟尾虫、羽须鳃沙蚕和谭氏泥蟹3个物种的平均密度占总平均密度的71%,栖息密度和生物量集中在少数几个物种上,这些都说明鹤州北湿地大型底栖动物群落发育比较脆弱,生态系统处于不稳定的状态。
红树林内的底栖动物具有低物种多样性和高栖息密度的特点[18],但是在群落演替初期,物种的多样性和均匀性一般会比较低,随着演替过程而逐渐增高,群落中生物个体也会经历从体型较小生活周期短的r-选择种类到大型有较长世代种的K-选择种类的过程[19]。鹤州北湿地大型底栖动物的生活型以底内型为主,缺少底上型;功能群以食物链下层的浮游生物食者、植食者和杂食者为主,缺少食物链高层的肉食者和食碎屑者,说明生境较为单一[20],而且物种数量、生物多样性和均匀性均较低,说明整个系统处于生物演替的初级阶段,这和鹤州北湿地人工林恢复时间仅为2a,时间较短,湿地植被属于生物演替的初级阶段的现状相吻合。
3.2 不同生境下大型底栖动物优势种的组成
无瓣海桑为先锋造林物种,可以促进其它红树植物天然定居和生长[21]。鹤州北湿地无瓣海桑站位的大型底栖动物群落以树栖腹足类和攀爬型蟹类为主,缺少多毛类和双壳类。优势物种为耳螺科的瘤蜷(Y=0.1255)、赛氏女教士螺(Y=0.0206)和相手蟹科的无齿螳臂相手蟹(Y=0.0575)。赛氏女教士螺属有鳃目耳螺科,营树栖生活,分布在高潮线附近,属于狭分布种[22],在本研究的6个站位中只在无瓣海桑站位发现。相手蟹科动物因其可以显著影响生境和营养循环的生物扰动作用而在红树林研究中受到广泛关注,更被视为关键物种来研究[8]。熊李虎和陆健健[23]研究长江口湿地无齿螳臂相手蟹的分布情况时发现,无齿螳臂相手蟹的栖息密度与植株高度接近显著正相关。黄建荣等[24]在研究珠海淇澳岛红树林蟹类区系时发现,在道路两侧和堤坝等红树林外硬质泥滩,无齿螳臂相手蟹等个体相对较大,挖穴能力强的蟹类是优势种。在本调查中我们发现,无瓣海桑树干潮水上缘线上攀附有大量的无齿螳臂相手蟹,并且林下发现大量的蟹类洞穴。杨泽华等[11]在长江口湿地研究发现,随着高程的增加,淹水时间缩短,特别适合穴居型蟹类和底上附着型的拟沼螺生活,但是游泳底栖型和底内型种类明显减少。所以,瘤蜷、赛氏女教士螺和无齿螳臂相手蟹的大量出现与无瓣海桑植株高大,地上枝干分化复杂,淹水时间缩短,为底栖生物提供了复杂多样的生境有很大的关系。该站位发现了除刀额新对虾外的全部甲壳类动物和除紫游螺外的全部腹足类动物,但是没有发现双壳类,环节动物也仅发现4种。
老鼠簕和短叶茳芏同无瓣海桑一样位于堤坝外临海一侧,水文活动强烈,加上这两个站位植株矮小,淹水时间较长,环境干扰作用十分明显,底上附着型底栖动物难以生存,尤其不适于攀爬蟹类无齿螳臂相手蟹的生存,这就为小型蟹类谭氏泥蟹提供了发展空间。谭氏泥蟹是河口区典型的小型蟹类优势种[25- 26]。在本研究中,在短叶茳芏(Y=0.6715)和老鼠簕(Y=0.5019)两个站位,谭氏泥蟹的秋季的栖息密度分别高达448.00 个/m2和164.00 个/m2。
芦苇站位位于堤坝内围垦区临潮沟一侧,优势种为麦克碟尾虫(Y=0.4090)、羽须鳃沙蚕(Y=0.3102)(两者平均密度皆为6个站位最高)和小型双壳类,四季均未发现蟹类。羽须鳃沙蚕是深圳河口泥滩底栖动物群落的优势种,体大肉肥,是湿地鸟类的天然饵料[27]。麦克碟尾虫是珠海淇澳—担杆岛红树林自然保护区底栖动物种群的优势种,优势度明显[28]。潮沟虽然有潮汐作用但是较临海站位水文变化不明显,盐度偏低,且底质类型为软泥底,适宜多毛类、双壳类和小型甲壳类这样低盐的底内型和游泳底栖型的生存,并且由于芦苇的茎叶分化简单,底上部分细密柔软,不利于蟹类的攀爬和掘穴,这和澳大利亚东北部潮间带发现中潮带的多毛类最多而蟹类则偏向分布于高潮带的结果相一致[29]。特别是在6个站位中羽须鳃沙蚕在芦苇站位的栖息密度最大且春季达到峰值125.33 个/m2,这可能与春季是羽须鳃沙蚕的繁殖期有关。
3.3 大型底栖动物和环境因子的关系
盐度是影响河口区大型底栖动物物种分布最重要的环境因子[30]。斯海尔德河口潮间带湿地大型底栖动物群落沿着盐度梯度有显著变化,大型底栖动物物种多样性和物种数目随盐度下降而减小[31- 32]。蒙特卡罗置换检验显示盐度和深度是对鹤州北围垦湿地大型底栖动物分布影响贡献最大的环境因子。温度、深度和盐度3个环境变量之间夹角均为锐角,说明3个变量之间有较强的相关性,尤其是盐度和深度变量之间相关性很强。深度可以反映潮汐淹没程度,对大型底栖动物的分布有很大影响。谭氏泥蟹、疣吻沙蚕、中华蜾蠃蜚和单叶沙蚕属于广盐种,受到盐度的影响最小,普遍分布在6个站位;瘤蜷、赛氏女教士螺和无齿螳臂相手蟹与盐度和深度呈正相关,均为无瓣海桑站位的优势物种,这与无瓣海桑站位位于临海一侧且植株高大的生境特征相符合;弹涂鱼,羽须鳃沙蚕和麦克碟尾虫等淡水种与盐度和深度负相关,普遍分布在临潮沟一侧的3个站位,与水浅且水文变化不大的生境特征相一致。可以看出鹤州北围垦湿地大型底栖动物以淡水和广盐型物种为主,只有无瓣海桑站位的优势物种分布与盐度和深度正相关。
3.4 围垦区红树林人工湿地和自然滩涂大型底栖动物群落结构的比较
围垦是大型底栖动物群落结构改变的一个重要因素[33]。在本次调查中,围垦区内人工湿地的大型底栖动物群落结构与堤坝外侧的自然滩涂差异显著。围垦区大型底栖动物的物种数量(20种)小于自然滩涂(28种),其年平均密度和年平均生物量分别为291.33 个/m2和17.24 g/m2,同样明显小于自然滩涂(615.96 个/m2和71.23 g/m2);从动物类群上分析,围垦区站位双壳类(4种)多于自然滩涂(1种),而自然滩涂的螺类(5种)和甲壳动物(10种)多于围垦区(1种和5种),这与袁兴中和陆健健[34]在研究围垦对长江口南岸底栖动物群落结构的影响时发现在围垦以后, 甲壳动物种类减少;昆虫幼虫比例增加;随着围垦时间延长,软体动物种类相对有所增加的现象一致。潮汐的改变对围垦后滩涂环境的影响也较重要,主要表现在潮汐消失后形成的封闭系统导致淡水化和陆生化[35]。围垦后仍有潮水周期性影响的站位物种多样性虽然降低,但是却有利于某些和盐沼植物有关的大型底栖动物的生存[34]。同样位于围垦区内的芦苇、秋茄和木榄3个站位,由于木榄站位与堤坝闸门相对,潮汐作用较为明显,其大型底栖动物群落结构与围垦区外的老鼠簕和短叶茳芏站位相似,这一点从等级聚类和非参数多变量标序图中可以得到证明。而芦苇和秋茄站位远离闸门,潮沟水文变化小,两个站位均被茂密的草本植物覆盖,其大型底栖动物群落的栖息密度、生物量以及多样性指数均较临海站位低很多,并出现了淡水起源的红明樱蛤等小型双壳类。堤坝外侧无瓣海桑、老鼠簕和短叶茳芏站位,真红树植物无瓣海桑和老鼠簕的大型底栖动物群落最为复杂、稳定。两者皆已形成一定规模的纯林,这为林下的大型底栖动物提供了栖息、摄食场所,因此大型底栖动物类群的生态恢复也有较大发展。
3.5 对管理者的建议
鹤州北围垦湿地人工红树林恢复时间较短,生态环境较差,大型底栖动物群落结构单一脆弱,需要管理者加强对恢复区的保护和管理:(1)禁止鱼塘向恢复区排入养殖废水,以免造成潮沟淤堵,陆地化程度加剧。并定期清理红树植被周围的杂草;(2)定期清理和挖掘潮沟,保持围垦区内潮沟具有一定的潮汐作用和水文变化,维持潮间带的完整性,促进大型底栖动物的生存和发展;(3)避免农药等有毒物质和垃圾破坏大型底栖动物生存环境和人为捕捞大型底栖动物。
[1] Zhang J H, Huang X S. The protection and development of mangrove in Zhuhai. Guangzhou Environmental Sciences, 2003, 18(2): 37- 40.
[2] Peng Y S, Chen G Z, Tian G H, Yang X B. Niches of plant populations in mangrove reserve of Qi′ao Island, Pearl Piver Estuary. Acta Ecologica Sinica, 2009, 29(6): 357- 361.
[3] Lee S Y. Mangrove macrobenthos: assemblages, services, and linkages. Journal of Sea Research, 2008, 59(1/2): 16- 29.
[4] Nagelkerken I, Blaber S J M, Bouillon S, Green P, Haywood M, Kirtong L G, Meyneckeh J O, Pawliki J, Penrosej H M, Sasekumark A, Somerfield P J. The habitat function of mangroves for terrestrial and marine fauna: a review. Aquatic Botany, 2008, 89(2): 155- 185.
[5] Hu Z Y, Bao Y X, Cheng H Y, Zhang L L, Ge B M. Research progress on ecology of natural wetland zoobenthos in China. Chinese Journal of Ecology, 2009, 28(5): 959- 968.
[6] Ye Y, Weng J, Lu C Y, Cheng G C. Mangrove biodiversity restoration. Acta Ecologica Sinica, 2006, 26(4): 1243- 1250.
[7] Bosire J O, Dahdouh-Guebas F, Walton M, Crona B I, Lewis III R R, Field C, Kairo J G, Koedam N. Functionality of restored mangroves: a review. Aquatic Botany, 2008, 89(2): 251- 259.
[8] Macintosh D J, Ashton E C, Havanon S. Mangrove rehabilitation and intertidal biodiversity: a study in the Ranong Mangrove Ecosystem, Thailand. Estuarine, Coastal and Shelf Science, 2002, 55(3): 331- 345.
[9] Elison A M. Managing mangroves with benthic biodiversity in mind: moving beyond roving banditry. Journal of Sea Research, 2008, 59(1/2): 2- 15.
[10] Fan H Q, He B Y, Wei S Q. Influences of sand dune movement within the coastal mangrove stands on the macrobenthosinSitu. Acta Ecologica Sinica, 2000, 20(5): 722- 727.
[11] Yang Z H, Tong C F, Lu J J. Characteristics of macrobenthic fauna communities in three successional stages of the new emergent salt marsh in an estuary of the Yangtze River. Zoological Research, 2006, 27(4): 411- 418.
[12] Ge B M, Bao Y X, Zheng X. Structure of macrobenthic communities in different habitats at the diked tidal flat in winter. Zoological Research, 2005, 26(1): 47- 54.
[13] Zhu X J, Lu J J. Functional groups of zoobenthos in the intertidal zone of Jiuduansha, the Yangtze River Estuary. Zoological Research, 2003, 24(5): 355- 361.
[14] Bao Y X, Hu Z Y, Li H H, Ge B M, Cheng H Y. Seasonal variation and functional groups of macrobenthic communities at diked and natural tidal flat, Lingkun Island, China. Acta Zoologica Sinica, 2008, 54(3): 416- 427.
[15] You Z J, Tao L, Jiao H F, Shi H X, Lou D. A survey of macrobenthos in the Xiangshan Bay. Oceanologia et Limnologia Sinica, 2011, 42(3): 431- 435.
[16] Zhang F J, Tong C F, Xie Z F, Liu W L, Gao W, Lu J J. The re-colonisation progress of intertidal benthic fauna community in the Changjiang Estuary. Acta Ecologica Sinica, 2007, 27(12): 4944- 4952.
[17] Du F Y, Wang X H, Li C H, Zhang H H, Jia X P. Study on species diversity of macrobenthos in Daya Bay, South China Sea. South China Fisheries Science, 2008, 4(6): 33- 41.
[18] Wang W Q, Wang M. The Mangroves of China. Beijing: Science Press, 2007: 89- 89.
[19] Shen G Y, Huang L F, Guo F, Shi B Z. Marine Ecology. 3rd ed. Beijing: Science Press, 2010: 112- 113.
[20] Yuan X Z, Lu J J, Liu H. Distribution pattern and variation in the functional groups of zoobenthos in the Changjiang Estuary. Acta Ecologica Sinica, 2002, 22(12): 2054- 2062.
[21] Chen Y J, Liao B W, Zheng S F, Li M, Song X Y. Dynamics and species-diversities of artificialSonneratiaapetala,Sonneratiacaseolarisand Kandelia candel communities. Chinese Journal of Applied Ecology, 2004, 15(6): 924- 928.
[22] Liu Y, Wang M, Wang W Q, Lu C Y. Ellobiid molluscs of Chinese mangrove habitats. Biodiversity Science, 2011, 19(6): 723- 728.
[23] Xiong L H, Lu J J. Distribution and use of burrows byChiromantesdehaaniin different vegetations in salt marsh of Yangtze Estuary. Chinese Journal of Zoology, 2009, 44(6): 1- 9.
[24] Huang J R, Liu Q Z, Zhao Y C, Dou B X, Li L C, Liu W Q, Lin J Q. The crab fauna in the mangrove of the Qi′Ao Island, Zhuhai. Ecology and Environmental Sciences, 2011, 20(4): 730- 736.
[25] Zhou X, Ge Z M, Shi W Y, Wang T H. Temporal and spatial fluctuation of macrobenthos community in a newly established wetland in Yangtze River Estuary. Chinese Journal of Ecology, 2007, 26(3): 372- 377.
[26] An C G, Zhao Y L, Lin L, Li J Y, Cui L L, Ma C Y. The biodiversity of marobenthos of intertidal zone on Chongming Island in summer. Acta Ecologica Sinica, 2008, 28(2): 577- 586.
[27] Cai L Z, Li H M, Lin P, Liu J J. Analysis of environmental effect and polychaete quantitative variations on intertidal mudflat in Shenzhen Estuary. Journal of Xiamen University: Natural Science, 2001, 40(3): 741- 750.
[28] Wang C F. Studies on the Taxonomy and Ecology of Macrobenthic Crustaceans Under Different Vegetations in the Qi′ao-Dan′gan Island Mangrove Natural Reserve, Pearl River Estuary, China. Guangzhou: Doctoral Dissertation of Zhongshan University, 2010.
[29] Dittmann S. Zonation of benthic communities in a tropical tidal flat of north-east Australia. Journal of Sea Research, 2000, 43(1): 33- 51.
[30] van der Linden P, Patrício J, Marchini A, Cid N, Neto J M, Marques J C. A biological trait approach to assess the functional composition of subtidal benthic communities in an estuarine ecosystem. Ecological Indicators, 2012, 20: 121- 133.
[31] Ysebaert T, Herman P M J, Meire P, Craeymeersch J, Verbeek H, Heip C H R. Large-scale spatial patterns in estuaries: estuarine macrobenthic communities in the Schelde estuary, NW Europe. Estuarine, Coastal and Shelf Science, 2003, 57(1/2): 335- 355.
[32] Hampel H, Elliott M, Cattrijsse A. Macrofaunal communities in the habitats of intertidal marshes along the salinity gradient of the Schelde estuary. Estuarine, Coastal and Shelf Science, 2009, 84(1): 45- 53.
[33] Ma C A, Xu L L, Tian W, Lü W W, Zhao Y L. The influence of a reclamation project on the macrobenthos of an East Nanhui tidal flat. Acta Ecologica Sinica, 2012, 32(4): 1007- 1015.
[34] Yuan X Z, Lu J J. Influence of diking on the benthic macro-invertebrate community structure and diversity in the south bank of the Changjiang Estuary. Acta Ecologica Sinica, 2001, 21(10): 1642- 1647.
[35] Huang S F, Liu Y, Li C, Huang J M. Influence of reclamation on macrobenthic community in the Pearl River Estuary. Chinese Journal of Applied and Environmental Biology, 2011, 17(4): 499- 503.
参考文献:
[1] 章金鸿, 黄晓珊, 李玫. 珠海红树林的保护与发展. 广州环境科学, 2003, 18(2): 37- 40.
[5] 胡知渊, 鲍毅新, 程宏毅, 张龙龙, 葛宝明. 中国自然湿地底栖动物生态学研究进展. 生态学杂志, 2009, 28(5): 959- 968.
[6] 叶勇, 翁劲, 卢昌义, 陈光程. 红树林生物多样性恢复. 生态学报, 2006, 26(4): 1243- 1250.
[10] 范航清, 何斌源, 韦受庆. 海岸红树林地沙丘移动对林内大型底栖动物的影响. 生态学报, 2000, 20(5): 722- 727.
[11] 杨泽华, 童春富, 陆健健. 长江口湿地三个演替阶段大型底栖动物群落特征. 动物学研究, 2006, 27(4): 411- 418.
[12] 葛宝明, 鲍毅新, 郑祥. 围垦滩涂不同生境冬季大型底栖动物群落结构. 动物学研究, 2005, 26(1): 47- 54.
[13] 朱晓君, 陆健健. 长江口九段沙潮间带底栖动物的功能群. 动物学研究, 2003, 24(5): 355- 361.
[14] 鲍毅新, 胡知渊, 李欢欢, 葛宝明, 程宏毅. 灵昆东滩围垦区内外大型底栖动物季节变化和功能群的比较. 动物学报, 2008, 54(3): 416- 427.
[15] 尤仲杰, 陶磊, 焦海峰, 施慧雄, 楼丹. 象山港大型底栖动物功能群研究. 海洋与湖沼, 2011, 42(3): 431- 435.
[16] 章飞军, 童春富, 谢志发, 刘文亮, 高伟, 陆健健. 长江口潮间带大型底栖动物群落演替. 生态学报, 2007, 27(12): 4944- 4952.
[17] 杜飞雁, 王雪辉, 李纯厚, 张汉华, 贾晓平. 大亚湾大型底栖动物物种多样性现状. 南方水产, 2008, 4(6): 33- 41.
[18] 王文卿, 王瑁. 中国红树林. 北京: 科学出版社, 2007: 89- 89.
[19] 沈国英, 黄凌风, 郭丰,施并章. 海洋生态学 (第三版). 北京: 科学出版社, 2010: 112- 113.
[20] 袁兴中, 陆健健, 刘红. 长江口底栖动物功能群分布格局及其变化. 生态学报, 2002, 22(12): 2054- 2062.
[21] 陈玉军, 廖宝文, 郑松发, 李玫, 宋湘豫. 无瓣海桑、海桑、秋茄红树人工林群落动态及物种多样性研究. 应用生态学报, 2004, 15(6): 924- 928.
[22] 刘毅, 王瑁, 王文卿, 卢昌义. 中国红树林区的耳螺. 生物多样性, 2011, 19(6): 723- 728.
[23] 熊李虎, 陆健健. 长江河口湿地不同植被中无齿螳臂相手蟹的分布及其洞穴利用. 动物学杂志, 2009, 44(6): 1- 9.
[24] 黄建荣, 刘启智, 赵一臣, 窦碧霞, 李连春, 刘蔚秋, 林继球. 珠海淇澳岛红树林蟹类区系. 生态环境学报, 2011, 20(4): 730- 736.
[25] 周晓, 葛振鸣, 施文彧, 王天厚. 长江口新生湿地大型底栖动物群落时空变化格局. 生态学杂志, 2007, 26(3): 372- 377.
[26] 安传光, 赵云龙, 林凌, 李嘉尧, 崔丽丽, 马春艳. 崇明岛潮间带夏季大型底栖动物多样性. 生态学报, 2008, 28(2): 577- 586.
[27] 蔡立哲, 厉红梅, 林鹏, 刘俊杰. 深圳河口潮间带泥滩多毛类的数量变化及环境影响. 厦门大学学报: 自然科学版, 2001, 40(3): 741- 750.
[28] 王昌付. 珠江河口淇澳- 担杆岛红树林自然保护区大型底栖甲壳动物的分类学和生态学研究 [D]. 广州: 中山大学, 2010.
[33] 马长安, 徐霖林, 田伟, 吕巍巍, 赵云龙. 围垦对南汇东滩湿地大型底栖动物的影响. 生态学报, 2012, 32(4): 1007- 1015.
[34] 袁兴中, 陆健健. 围垦对长江口南岸底栖动物群落结构及多样性的影响. 生态学报, 2001, 21(10): 1642- 1647.
[35] 黄少峰, 刘玉, 李策, 黄晋沐. 珠江口滩涂围垦对大型底栖动物群落的影响. 应用与环境生物学报, 2011, 17(4): 499- 503.
CharacteristicsofmacrobenthiccommunitiesinmangrovewetlandsalongthewaterwaysofNorthHezhou,Zhuhai,SouthChina
WANG Hui, ZHONG Shan, FANG Zhanqiang*
KeyLaboratoryofEcologyandEnvironmentalScienceinGuangdongHigherEducation,CollegeofLifeSciences,SouthChinaNormalUniversity,Guangzhou510631,China
Macrobenthic communities were sampled four times over a one year period between December 2010 and September 2011 at six different sites in North Hezhou, Zhuhai, China. The six sites comprised four restored mangrove forest habitats (each dominated by a different mangrove species:Acanthusilicifolius,Bruguieragymnorrhiza,KandeliacandelandSonneratiaapetala) and two diked wetland habitats, one of which was composed ofCyperusmalaccensisvar.brevifolius, and the otherPhragmitesaustralis. In total, 35 macrobenthic species were recorded during the study. The dominant taxa recorded were crustaceans (10 taxa) and polychaetes (7 taxa). The number of species recorded at a single site varied from 7 (Kandeliacandelhabitat) to 19 (Acanthusilicifoliushabitat). Hierarchical clustering (based on the Bray-Curtis similarity index) combined with non-metric multidimensional scaling (NMDS); implemented in PRIMER 5 under the condition of 55% non-similarity), was used to classify sampling sites into three groups based on their macrobenthic fauna. Group 1 comprisedCyperusmalaccensisvar.brevifolius,Acanthusilicifolius, andBruguieragymnorrhizahabitats; Group 2 comprised theSonneratiaapetalahabitat; while Group 3 comprisedKandeliacandelandPhragmitesaustralishabitat. However, species composition was similar across all three groups, becauseDiscapseudesmackieiwas abundant at all six habitats. The highest number of species (19), highest Margalef index (d= 1.93± 0.11), and highest species diversity (Shannon-wiener index,H′ = 1.51 ± 0.13)were recorded at theAcanthusilicifoliushabitat, where crustaceans, mainlyIlyrplaxdeschampsi, were the dominant group recorded. Macrobenthos density was highest at theCyperusmalaccensisvar.brevifoliushabitat (254.67 ± 156.81) ind./m2, while macrobenthos biomass was highest at theSonneratiaapetalahabitat (32.06 ± 19.62) g/m2). Interestingly, the faunal community structure at theSonneratiaapetalahabitat differed significantly to the other habitats, as it was dominated by climbing species, such asChiromantesdehaaniandPythiacecillei.Discapseudesmackieiand polychaetes were the dominant species withinKandeliacandelandPhragmitesaustralishabitats. Overall, macrobenthos species richness, density, biomass and species diversity were low within all six habitats. We also classified macrobenthic community structure based on functional feeding groups (FFGs) and life form analyses. Results showed that the omnivorous functional feeding group and below-surface life forms were abundant at all habitats within the North Hezhou tidal flat. Similarity percentages analysis (SIMPER) showed that the species that differentiated the macrobenthic communities of different habitats were the dominant species in each habitat. The results of a canonical correspondence analysis (CCA) revealed that macrobenthic communities changed significantly with depth (Monte Carlo permutation test:Plt;0.05) and salinity (Plt;0.05), but not with temperature (Pgt;0.05). The findings of this study suggest that macrobenthic communities differ structurally between the diked wetland habitats and the natural tidal flat habitats, with the highest densities and biomasses of macrobenthos occurring at habitats close to the tidal gate. Our results further reveal significant differences in the dominant species of macrobenthos occurring in different habitats. Furthermore, our results show that environmental variables, such as depth and salinity, are the most important factors affecting macrobenthic communities in the North Hezhou tidal flat.
macrobenthos;community characteristics;mangrove wetland;the waterways of North Hezhou; Zhuhai
国家科技支撑计划项目(2009BADB2B401- 02);广东省科技计划项目(2009B030600006);珠海市野生动植物保护管理所项目(珠海市珠江口湿地生态系统动植物监测)
2012- 07- 18;
2013- 03- 04
*通讯作者Corresponding author.E-mail: fangzhq@scnu.edu.cn
10.5846/stxb201207181017
王卉,钟山,方展强.珠海鹤洲水道沿岸红树林湿地大型底栖动物群落特征.生态学报,2013,33(21):6913- 6924.
Wang H, Zhong S, Fang Z Q.Characteristics of macrobenthic communities in mangrove wetlands along the waterways of North Hezhou, Zhuhai, South China.Acta Ecologica Sinica,2013,33(21):6913- 6924.
