镉胁迫下杞柳对金属元素的吸收及其根系形态构型特征
2013-12-09王树凤施翔孙海菁陈益泰杨肖娥
王树凤,施翔,孙海菁,陈益泰,杨肖娥
(1. 浙江大学紫金港校区,环境与资源学院, 杭州 310028; 2. 中国林业科学研究院亚热带林业研究所, 富阳 311400)
镉胁迫下杞柳对金属元素的吸收及其根系形态构型特征
王树凤1,2,施翔2,孙海菁2,陈益泰2,杨肖娥1,*
(1. 浙江大学紫金港校区,环境与资源学院, 杭州 310028; 2. 中国林业科学研究院亚热带林业研究所, 富阳 311400)
采用水培方法,研究了杞柳(Salixintegra)2个品种在0—90 μmol/L Cd处理下不同组织对Cd的吸收和积累规律,探讨了镉胁迫下杞柳根系形态学功能响应特征以及对矿质离子吸收的影响。结果发现,镉在杞柳2个品种不同组织的含量均表现为根gt;韧皮部gt;木质部gt;叶。2个品种地上部组织对镉的吸收和积累规律相似:在0—70 μmol/L Cd处理浓度范围内,随着溶液Cd浓度的增加,叶、木质部、韧皮部中镉的含量逐渐增加,到50 μmol/L时,镉在地上部组织的含量达到最高,当Cd处理浓度达90 μmol/L时,地上部各组织中Cd含量出现下降趋势。而2个品种根系对Cd的吸收则不同,“微山湖”品种在溶液Cd达70 μmol/L时,根系镉的积累量最大,在90 μmol/L时,根系Cd的积累量明显下降;“一枝笔”品种根系在0—90 μmol/L范围内,根系Cd的积累量均为增加趋势。通过分析2个品种根系形态学参数变化发现,Cd胁迫抑制了杞柳2个品种根的伸长,促进了“微山湖”品种根的径向生长,导致根系平均直径增加;进一步对叶片矿质营养状态分析发现, Ca、Mn的吸收受镉胁迫的影响较大,在高浓度镉胁迫下(50—70 μmol/L)“微山湖”和“一枝笔”对Ca和Mn的吸收明显下降;Cd胁迫对Fe在叶片的含量影响不明显;同时发现,在50 μmol/L Cd处理下,Cu2+在叶片的积累明显增加。由此可见,杞柳2个品种间对镉的吸收和积累差异主要体现在根系,地上部对镉毒害的响应差异不大。
杞柳;镉胁迫;吸收和积累;根系形态学
镉(Cd)是生物毒性最强的重金属元素之一,土壤中过量的Cd不仅对农作物造成危害,影响作物产量,而且严重威胁人类的健康,例如长期食用Cd污染(大于1 mg/kg)的“镉米”会患骨痛症,引起高血压,并影响机体酶系统和生育力[1]。柳树(Salixspp.)被认为是Cd高积累型植物[2],欧美等很多些国家通过柳树短轮伐矮林栽培模式用于修复土壤和水体中的Cd等重金属污染,通过定期收获地上部生物量而进行镉的植物提取,生物质用作生物能源,把可再生能源生产和植物修复结合起来,取得显著的生态效益与经济效益[3- 6]。用于污染修复的植物材料首先必须能够耐受较高浓度重金属并能在金属型土壤中生存与繁殖[7],这是进行植物修复首要的和必要的条件。植物在适应土壤非生物胁迫的过程中,根系是最先感知逆境胁迫的器官,一般表现为根生物量的减少和根系形态的变化[8- 9],而根系形态的变化直接影响根的生理功能,从而对植物生长产生重大影响,因此,研究根系对重金属胁迫的响应对于揭示植物抵抗重金属胁迫的机理和提高植物修复效率具有重要意义。目前国内外对柳树根系重金属耐性机制的研究很多[10- 13],但大多研究集中在根系解剖结构[10]、重金属微区分布[13]等方面,对根系形态构型特别是根系分形变化方面的研究还不多见。本文以2个对镉耐性不同的杞柳(Salixintegra)品种为材料,研究不同耐性品种间重金属的吸收和积累规律差异以及根系功能响应特征,为进一步研究杞柳不同耐性品种间对镉的响应机制提供依据。
1 材料与方法
1.1 供试材料
2个杞柳品种为微山湖 (S.integra‘Weishanhu’)和一枝笔(S.integra‘Yizhibi’),其中“微山湖”品种对镉的耐性较低(忍耐系数0.61—0.82),“一枝笔”品种对镉具有较高的耐性(忍耐系数0.92—0.93)[14],材料均引自山东省,为当地主栽品种,种质资源现保存于中国林科院亚热带林业研究所苗圃。
1.2 试验设计与方法
试验在塑料大棚内开展,剪取杞柳当年生枝条,扦插于10 L塑料盆中的泡沫板上,插条8—10 cm,采用Watson等[15]改进的营养液,培育无性系材料。营养液配方为:大量元素 Ca(NO3)2·4H2O、 KNO3、 MgSO4·7H2O、NH4H2PO4、Fe-EDTA分别为1、1.2 5、0.5、0.5、0.025 μmol/L,微量元素 H3BO4、ZnC12、CuC12·2H2O、 MnC12·4H2O、Na2MoO4·2H2O分别为1.43、0.055、0.03、0.905、0.015 mg/L, pH值5.5,连续不断充气, 自然光照, 温度为l5—27 ℃,预培养30 d后,选取生长一致的扦插苗进行Cd(NO3)2处理。试验共设6个处理, Cd(NO3)2浓度分别为0,10,30,50,70,90 μmol/L,每个处理3盆,每盆20株苗木,每周更换营养液2次,培养48d后收获植株,先以自来水冲洗根部,再以20 mmol/L EDTA清洗,最后以去离子水冲洗3次。
1.2.1 根系形态学参数分析
根系冲洗干净后,用吸水纸擦干,通过扫描仪(Epson V700)将完整的根系图像扫描存入计算机,采用WinRHIZO PRO 2007根系分析系统软件(Regent Instruments Inc8,Canada)分析根长、表面积、体积以及不同径级根长和分形维数等,分形维数以盒维数表示。
1.2.2 叶片镉、钙、镁、铁、铜、锰含量测定
收获的植株分成根、木质部、韧皮部、叶4部分,在80 ℃干燥至恒重,粉碎,过60目尼龙筛。准确称取0.2 g 样品,用HNO3-HClO4(4∶1)混合液消解,Ca、Mg、Mn、Fe、Cu含量采用原子吸收光度计法测定,Cd含量采用石墨炉原子吸收分光光度计法(Thermo Fisher Solaar M6)测定。
1.2.3 数据分析
所有数据采用Origin 7.5和DPS软件作图和方差分析,LSD方法进行差异性比较。
2 结果与分析
2.1 镉胁迫下杞柳不同组织镉的积累特点
由表1可以看出,杞柳2个品种根系Cd含量远远高于其他组织,不同组织中Cd的含量从大到小依次为:根gt;韧皮部gt;木质部gt;叶,说明杞柳2个品种根系对高浓度镉均具有很强的耐受性。镉是植物生长过程中的一种非必需元素,但由于其具有很强的移动性,因此很容易被植物吸收,在一定的浓度范围内,植物组织Cd含量随介质中Cd浓度的升高而增加[16]。本文研究也发现,在0—70 μmol/L Cd(NO3)2处理范围内,“微山湖”和“一枝笔”不同组织中Cd的含量随着Cd浓度的增加而增加,而当溶液Cd 浓度达90 μmol/L时,“微山湖”品种根系对Cd的吸收明显下降;而“一枝笔”品种根部Cd的积累依然呈增加趋势。

表1 Cd 在杞柳不同组织中的含量
本研究还发现,在未添加Cd(NO3)2的营养液中生长的杞柳组织中依然能检测3.68—36.61 mg/Kg. DW Cd,与杨卫东等[14]相同培养条件下相同试验材料中检测到的含量类似。这一方面可能是因为扦插取材的母树生长环境中含有Cd,使得母树本身就积累了一定量的Cd,导致插条在生长过程中产生了Cd的再分配,这种情况往往在一些镉耐性或超级累植物中产生。张圆圆等[17])在研究氮素对超级累植物——东南景天(Sedumalfredii)镉、锌的积累影响中发现,东南景天无镉处理条件下,植株体内原有的镉发生了再转运;而不同柳树品种对重金属的吸收特点也可能会产生这种现象,Waston等[15]研究中发现,一种杂交柳品种(S.triandraviminalis ‘Q83’)在无重金属处理下,体内含有的Zn、Cd、Pb等重金属远远高于S.burjatica‘Germany’。除了试验材料本身的特性以外,在水培试验过程中,配制营养液的某些试剂被污染或本身含量不纯、混有重金属元素等原因也可能导致对照组重金属元素含量的检出。
通过对杞柳不同组织镉积累量和镉处理浓度的一元非线性拟合(表2),在0—70 μmol/L Cd处理浓度范围内,2个品种镉积累量与处理浓度之间具有相同的规律(图1),其中叶中镉的积累规律用Michaelis-Menten 模型达到较好的拟合,而韧皮部、木质部和根部具有相同的镉积累量-浓度相关关系,均符合Logistic模型。 2个品种之间唯一不同的是:“一枝笔”品种根部镉积累量和浓度之间的拟合方程在0—90 μmol/L Cd处理范围内均适用,而“微山湖”品种根部镉积累模型仅适用于0—70 μmol/L Cd处理浓度范围(图1)。
2.2 镉胁迫下杞柳根系形态构型变化
如图2所示,镉胁迫下,2个品种的根系形态学参数均受到不同程度影响。2个品种根系总长、表面积和根系总体积均有不同程度下降,所不同的是,“微山湖”品种在镉胁迫下根系总长、表面积和根系总体积下降程度明显,而耐性较强的“一枝笔”品种则下降程度不明显(图2)。而根系平均直径在镉胁迫下的变化与其他指标不同,与对照相比,“微山湖”品种根系平均直径在10 μmol/L Cd 处理时下降,而在30—70 μmol/L范围内均有不同程度的增加;而“一枝笔”品种的根系平均直径在镉胁迫下有所下降,然而,2个品种根系直径增加或减少的趋势均不明显。

表2 一元非线性拟合杞柳不同组织Cd浓度-积累量之间的关系
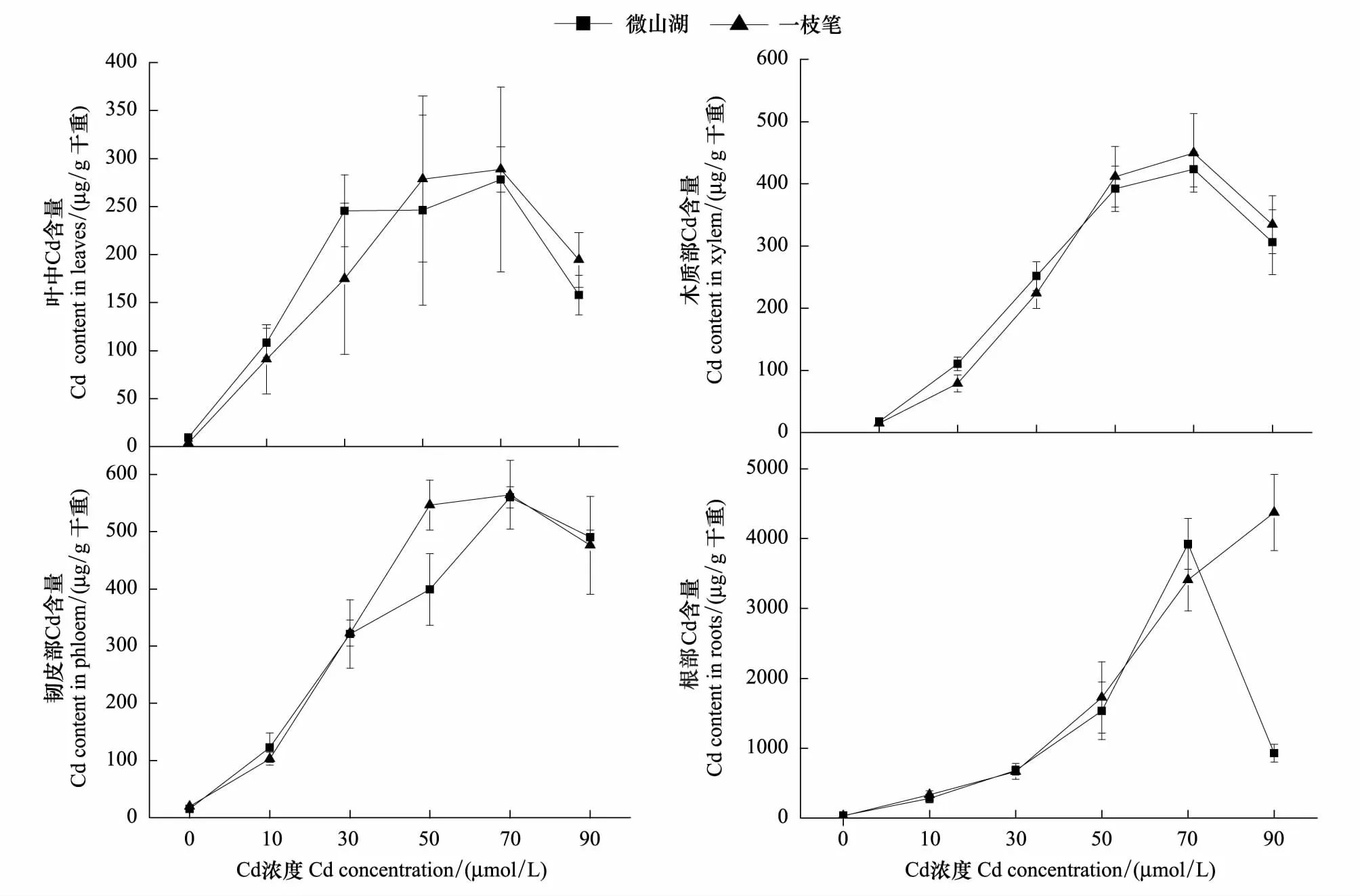
图1 杞柳不同组织中Cd的积累特点Fig.1 Accumulation of cadmium in different tissues of S. integra
通过对不同径级根系总长的分析发现(表3),镉胁迫主要是明显降低了“微山湖”品种D≤0.5 mm的细小根系的总长度(Plt;0.01),对1—2 mm根系的总长影响不大;“一枝笔”品种D≤0.5 mm 的细小根系在0—70 μmol/L范围内变化不大,而0.5 mmlt;D≤1.0 mm的根系总长在镉胁迫下明显下降(Plt;0.05),但不同浓度之间差异不明显。不同浓度镉胁迫有可能抑制了杞柳根系向周围空间的扩张,特别是用于吸收功能的细小根系的伸长;但耐性较强的品种在镉胁迫下根系形态参数变化相对不明显,这有利于维持根系正常的生理功能,有助于提高植物对逆境的适应能力。

图2 镉胁迫下杞柳根系形态学参数变化Fig.2 Changes of root morphological parameters of S. integra under cadmium treatment
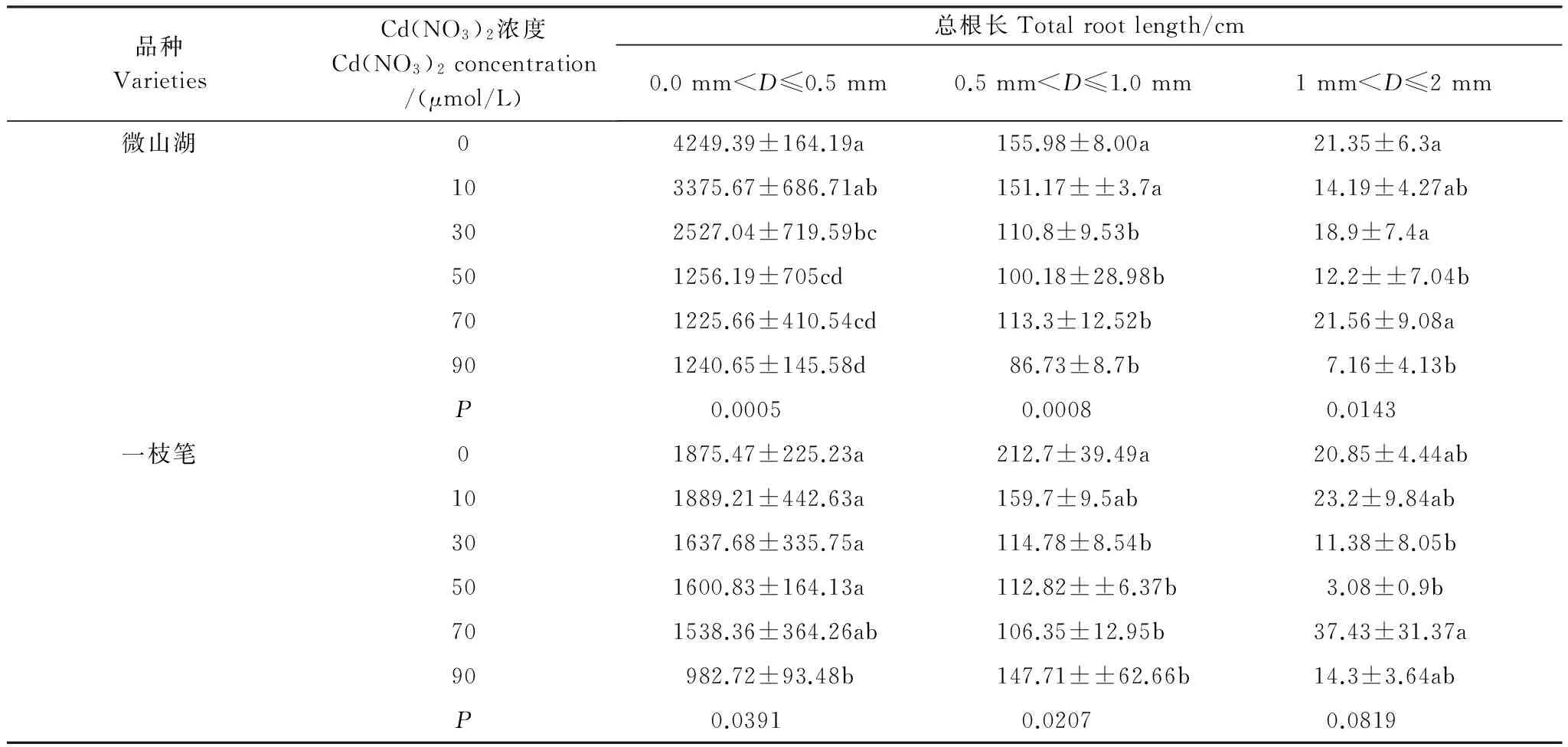
品种VarietiesCd(NO3)2浓度Cd(NO3)2concentration/(μmol/L)总根长Totalrootlength/cm0.0mmlt;D≤0.5mm0.5mmlt;D≤1.0mm1mmlt;D≤2mm微山湖04249.39±164.19a155.98±8.00a21.35±6.3a103375.67±686.71ab151.17±±3.7a14.19±4.27ab302527.04±719.59bc110.8±9.53b18.9±7.4a501256.19±705cd100.18±28.98b12.2±±7.04b701225.66±410.54cd113.3±12.52b21.56±9.08a901240.65±145.58d86.73±8.7b7.16±4.13bP0.00050.00080.0143一枝笔01875.47±225.23a212.7±39.49a20.85±4.44ab101889.21±442.63a159.7±9.5ab23.2±9.84ab301637.68±335.75a114.78±8.54b11.38±8.05b501600.83±164.13a112.82±±6.37b3.08±0.9b701538.36±364.26ab106.35±12.95b37.43±31.37a90982.72±93.48b147.71±±62.66b14.3±3.64abP0.03910.02070.0819
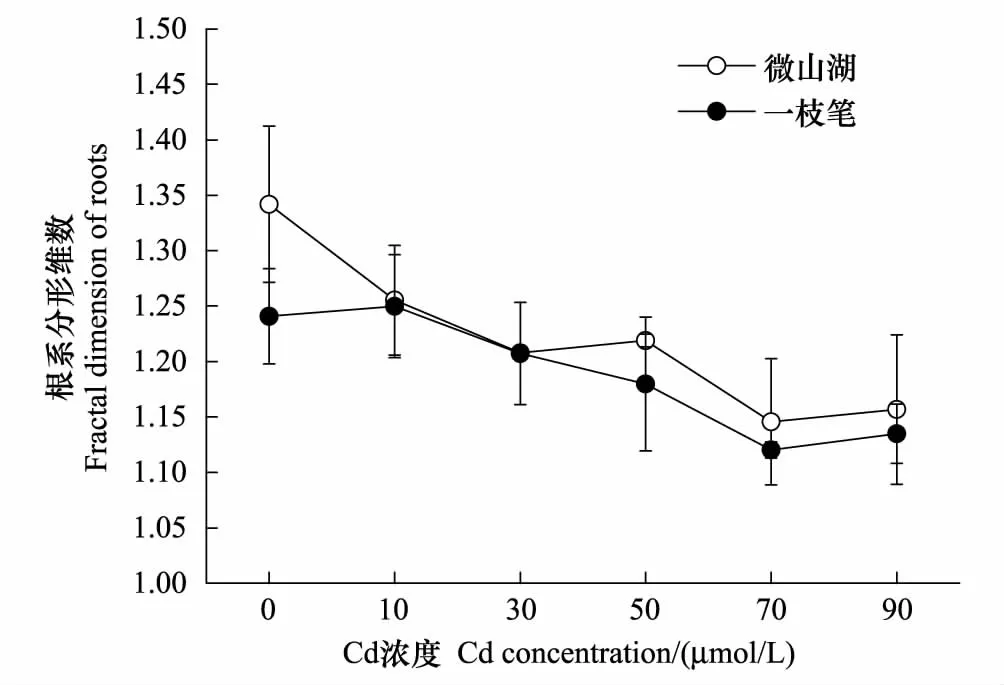
图3 镉胁迫下杞柳根系的分形维数 Fig.3 Fractal dimension of roots in S.integra under cadmium treatment
形态学参数的变化影响了根系的空间构型,根系形态的分形维数可从整体上反映出根系空间结构,直接反映根系在不同环境影响下发育程度的差异,分形维数越高,根系越发达,分支多,相对小的分形维数反映出根系的分生能力相对较弱,分枝越简单[18- 19]。研究发现,杞柳2个品种在镉胁迫下根系的分形维数虽有所下降(图3),但与对照相比差异不明显,说明镉胁迫使根系空间结构及其分枝趋向简单化,随着镉胁迫浓度的增加,根系能够维持相对稳定的分形维数,这对维持根系营养物质的吸收具有重要意义。
2.3 镉胁迫对杞柳叶片营养元素吸收的影响
叶片营养状态在一定程度上反映根系的吸收功能,研究发现,根系对Ca、Mn的吸收受镉胁迫的影响较大,在较高浓度镉胁迫下(50和70 μmol/L),“微山湖”和“一枝笔”对Ca和Mn的吸收明显下降(图4);镉胁迫对Fe在叶片的含量影响不明显(图4);同时发现,在50 μmol/L Cd处理下,Cu在叶片的积累明显增加(图4),这可能与离子的协同运输有关,Mg在叶片的含量也有类似的趋势(图4)。

图4 镉胁迫下杞柳叶片微量元素含量Fig.4 Micronutrients content in leaves of S.integra under Cd stress
3 讨论
3.1 杞柳在重金属污染植物修复实践中的潜力
研究发现,柳树(Salix)对土壤重金属Cd具有很高的吸收量,Cd在柳树茎中的含量可达0.4—3.9 mg/kg,远远高于农作物中的含量[3]。由于柳树生长快,生物量大,通过定期收获柳树地上部生物量,可以达到对重金属进行植物提取的目的。Nicholas 等[5]研究发现,通过短轮伐柳树矮林吸收的Cd远远大于其他重金属元素,表明柳树可以有效的对土壤中的Cd进行植物提取。通过对柳树对Cd的移除效率研究发现,柳树可以移除环境中约30%的Cd及其他重金属[6]。因此,柳树在欧美等发达国家被广泛用于植物修复工程[3]。全世界柳树有526种,其中产于中国的就有257种,122个变种,33个变型[20 ],其中蒿柳(S.viminalisL.)、白柳(S.alba),灰柳(S.cinerea)、 山羊柳(S.caprea)等[21- 23]已经应用于废水处理,清除有机化合物和重金属污染。利用水培方法[15]能够快速筛选具有植物修复潜力的柳树品种,但由于不同试验重金属的起始浓度和试验周期不同,不同文献报道的Cd在柳树体内的积累量差异很大。Utmazian 等[24]报道Cd在柳树叶片中的含量最高可达230—315 mg/kg干重,本研究发现,Cd 在杞柳叶片中的含量可达90—288 mg/kg干重,与报道的最高含量相当,又加上杞柳属灌木柳,在我国适应性广,栽培面积大,可进行短周期轮伐,因此,杞柳在Cd的植物提取方面具有很大潜力。
杨卫东等[14]初步探索了杞柳3个品种对低浓度和高浓度镉的吸收和积累差异,发现杞柳3个品种在溶液浓度10 μmol/L和50 μmol/L CdCl2处理下,对镉的吸收及积累在品种间没有显著差异,但对镉的耐性存在明显差异。因此,基于前期的研究,本研究采用了多个处理浓度,意在明确杞柳不同耐性品种对重金属镉的吸收特征和耐受剂量。研究表明,耐性不同的品种差异主要体现在根系对镉的积累量,耐性强的品种(一枝笔)根系对镉的积累量与处理浓度之间的关系符合非饱和曲线,而耐性较弱的品种(微山湖)根系对镉的积累量在达到最大值后便下降。在研究植物重金属吸收的浓度动力学过程中,国内外大多数研究采用的是短期(0—72 h)吸收试验,采用Michaelis-Menten方程对吸收曲线进行模拟[25],然而,植物修复周期较长,影响植物修复效率的关键因子之一是重金属在植物体内的积累量,Ling 等[26]采用线性方程对旱柳(S.matsudana)、白柳(S.alba)等柳树不同组织Cd的积累量和处理浓度之间的关系进行模拟,其R2均在0.9以下,说明柳树镉的积累量与处理浓度之间的线性相关性不高,因此本研究采用一元非线性方程对杞柳在镉胁迫培养48 d 后的积累量和浓度关系进行模拟,发现杞柳除叶片以外,其他组织镉的积累量和浓度关系符合Logistic 模型,而叶片镉积累量符合Michaelis-Menten模型,这说明,叶片是以不同于其他组织的方式吸收和积累重金属。然而,本文由于数据有限,仅仅是进行了曲线的模拟,对模型的适应范围还有待于进一步的探索。
3.2 杞柳根系对镉胁迫的响应
植物在适应土壤非生物胁迫的过程中,根系是植物最先感受逆境胁迫的器官,植物通过改变根系形态、分布以及调节根系生理生化反应等过程以适应环境胁迫。研究表明,重金属胁迫下根系形态变化是植物根系对重金属适应的重要方式,植物体内Cd的积累量与根系形态、大小密切相关。已有研究表明,镉主要通过抑制细胞分裂、养分吸收等抑制根系生长,但不同耐性植物品种间对镉的响应差异很大,耐性强的品种一般表现为根系生物量大和根较长[27- 28]。李继光等[29]研究了氮对Cd胁迫下超积累植物——东南景天(Sedumalfredii(Crassulaceae))根系形态及Cd积累的影响,发现适当提高营养液氮素用量有利于提高东南景天的各项根系形态指标,从而提高Cd的积累量。He等[8]研究发现Cd敏感型水稻突变体的根长、根数及根系表面积会随溶液Cd浓度的增加而增加,导致根系对Cd的吸收量比野生型明显增加。Manciulea等[12]通过对Cd胁迫下印度芥菜(BrassicajunceaL.)和莴苣(Lactucasativa)对Cd吸收的差异研究发现,印度芥菜茎部Cd的含量远远大于莴苣,主要原因可能是印度芥菜具有庞大的根系系统。研究发现,在无镉处理条件下,“微山湖”品种根系总长、表面积、体积明显高于“一枝笔”品种,然而在镉处理下,2个品种的根系总长、表面积、体积趋向于相同,表明“微山湖”品种在镉胁迫下根系生长更容易受到抑制,而耐性较强的“一枝笔”根系则倾向于保持相对稳定的形态特征,以尽可能减少镉对根系吸收功能的抑制。
柳树之所以对镉具有较强的耐受性,并能够在地上部积累大量的Cd,除了与其发达的根系形态功能有关外,其根系不同组分对镉的屏障与吸附作用也具有重要意义。Luxa等[10]通过分析镉胁迫下柳树不同无性系不定根解剖结构的变化,发现根部非原生质体障碍、内皮层、外皮层、表皮等组织比例的增加对保护根细胞免受Cd毒害具有重要意义。Chen等[30]研究发现,苏柳J- 172(S.jiangsuensisCL J- 172)根细胞壁的不同组分对镉的吸附具有重要作用。因此,有关镉在杞柳根系不同组分的含量以及微区定位情况还需要进一步的深入研究。
4 结论
杞柳“微山湖”和“一枝笔” 2个品种地上部对镉的吸收和积累极限均为70 μmol/L,而根系对镉的吸收和积累极限则不同,“微山湖”品种根系对镉的吸收和积累在镉浓度70 μmol/L达到极限,而“一枝笔”品种根系对镉的吸收和积累在镉浓度达90 μmol/L时依然呈上升趋势,推测其吸收极限可达90 μmol/L或高于90 μmol/L。2个品种对镉都具有较高的耐受性和积累量,加上杞柳生长速度快,可以进行短周期培育,因此,具有对土壤镉污染进行植物提取的潜力,而“一枝笔”品种由于根系对高浓度镉具有极强的耐性和积累能力,在镉的植物固定化修复中也具有一定的潜力。
致谢:感谢中国林业科学研究院亚热带林业研究所张建锋研究员对本文写作的帮助。
[1] Huang C Y. Soil Science. Beijing: Chinese Agricultural Press, 2000.
[2] Vysloužilová M, Tlustoš P, Száková J. Cadmium and zinc phytoextraction potential of seven clones ofSalixspp. planted on heavy metal contaminated soils. Plant Soil Environment, 2003, 49(12): 542- 547.
[3] Eriksson J, Ledin S. Changes in phytoavailability and concentration of cadmium in soil following long termSalixcropping. Water, Air, and Soil Pollution, 1999, 114(1/2): 171- 184.
[4] Greger M, Landberg T. Use of willow in phytoextraction. International Journal of Phytoremediation, 1999, 1(2): 115- 123.
[5] Nicholas M, Dickinsona, Pulford I D. Cadmium phytoextraction using short-rotation coppiceSalix: the evidence trail. Environment International, 2005, 31(4): 609- 613.
[6] Tlustoš P, Száková J, Vysloužilová M, Pavlíková D, Weger J, Javorská H. Variation in the uptake of Arsenic, Cadmium, Lead, and Zinc by different species of willowsSalixspp. grown in contaminated soils. Central European Journal of Biology, 2007, 2(2): 254- 275.
[7] Marques A P G C, Rangel A O S S, Castro P M L. Remediation of heavy metal contaminated soils: Phytoremediation as a potentially promising clean-up technology. Critical Reviews in Environmental Science and Technology, 2009, 39(8): 622- 654.
[8] He J Y, Zhu C, Ren Y F, Jiang D A, Sun Z X. Root morphology and cadmium uptake kinetics of the cadmium-sensitive rice mutant. Biologia Plantarum, 2007, 51(4): 791- 794.
[9] Yan X L, Liao H, Ge Z Y, Luo X W. Root architectural characteristic and phosphorus acquisition efficiency in plants. Chinese Bulletin of Botany, 2000, 17(6): 511- 519.
[11] Landberg T, Greger M. No phytochelatin (PC2 and PC3) detected inSalixviminalis. Physiologia Plantarum, 2004, 121(3): 481- 487.
[12] Manciulea A, Ramsey M H. Effect of scale of Cd heterogeneity and timing of exposure on the Cd uptake and shoot biomass, of plants with a contrasting root morphology. Science of the Total Environment, 2006, 367(2/3): 958- 967.
[13] Zimmer D, Kruse J, Baum C, Borca C, Laue M, Hause G, Meissner R, Leinweber P. Spatial distribution of arsenic and heavy metals in willow roots from a contaminated floodplain soil measured by X-ray fluorescence spectroscopy. Science of the Total Environment, 2011, 409(19): 4094- 4100.
[14] Yang W D, Chen Y T. Differences in uptake and tolerance to cadmium in varieties ofSalixintegra. Forest Research, 2008, 21(6): 857- 861.
[15] Watson C, Pulford I D, Riddell-Black D. Development of a hydroponic screening technique to assess heavy metal resistance in willow (Salix). International Journal of Phytoremediation, 2003, 5(4): 333- 349.
[16] Shacklette H T. Cadmium in Plant. U. S. Government Printing Office. Washington D. C. 20402. 1972, P. G1- 4.
[17] Zhang Y Y, Dou C Y, Yao F, Ye Z Q. Nitrogen application to enhance zinc and cadmium uptake by the hyperaccumulatorSedumalfredii. Journal of Zhejiang Forestry College, 2010, 27(6): 831- 838.
[18] Nielsen K L, Lynch J P, Weiss H N. Fractal geometry of bean root systems: correlations between spatial and fractal dimension. American Journal of Botany, 1997, 84(1): 26- 33.
[19] Qiao H T, Yang H Q, You W B, Jiang Q Q, You S Z, Zhang L, Ran K. Responses of root morphology and architecture inMalushupehensisvar.pingyiensisseedlings to cadmium chloride. Scientia Silvae Sinicae, 2010, 46(1): 56- 60.
[20] Wang Y L, Wang B S, Shi S Z. Cadmium absorption characters of arbor willows (Salix sp.) in solution culture. Journal of Nanjing Forestry University: Natural Sciences, 2011, 35(2): 135- 138.
[21] Zacchini M, Pietrini F, Mugnozza G S, Iori V, Pietrosanti L, Massacci A. Metal tolerance, accumulation and translocation in poplar and willow clones treated with cadmium in hydroponics. Water, Air, and Soil Pollut, 2009, 197(1/4): 23- 34.
[22] Perttu K L. Environmental and hygienic aspects of willow coppice in Sweden. Biomass and Bioenergy, 1999, 16(4): 291- 297.
[23] Eriksson J, Ledin S. Changes in phytoavailability and concentration of cadmium in soil following long term Salix cropping. Water, Air, and Soil Pollution, 1999, 114(1/2): 171- 184.
[24] Utmazian M N D S, Wieshammer, G Vega R, Wenzel W W. Hydroponic screening for metal resistance and accumulation of cadmium and zinc in twenty clones of willows and poplars. Environmental Pollution, 2007, 148(1): 155- 165.
[25] Chen C H, Liu Z K, Chen G C, Shan Q H, Zhang J F. Uptake kinetic characteristics of Cu2+bySalixjiangsuensisCL J- 172 andSalixbabylonicaLinn and the influence of organic acids. Acta Ecologica Sinica, 2011, 31(18): 5255- 5263.
[26] Ling T, Jun R, Fangke Y. Effect of cadmium supply levels to cadmium accumulation bySalix. International Journal of Environmental Science and Technology, 2011, 8(3): 493- 500.
[27] Sanita di Toppi L, Gabbrielli R. Response to cadmium in higher plants. Environmental and Experimental Botany, 1999, 41(2): 105- 130.
[28] He J Y, Ren Y F, Wang Y Y, Li Z J. Root morphological and physiological responses of rice seedlings with different tolerance to cadmium stress. Acta Ecologica Sinica, 2011, 31(2): 522- 528.
[29] Li J G, Zhu E, Li T Q, Liu D, Yang X E, Lin G L, Han X R, Zhang Y L. Effects of nitrogen fertilizer on biomass, root morphology and cadmium accumulation of Cd-stressed Sedum alfredii Hance species. Environmental Pollution and Control, 2007, 29(4): 271- 275.
[30] Chen G C, Liu Y Q, Wang R M, Zhang J F, Owens G. Cadmium adsorption by willow root: the role of cell walls and their subfractions. Environmental Science and Pollution Research Published online: 02 March, 2013.
参考文献:
[1] 黄昌勇. 土壤学. 北京: 中国农业出版社, 2000.
[9] 严小龙, 廖红, 戈振杨, 罗锡文. 植物根构型特性与磷吸收效率. 植物学通报, 2000, 17(6): 511- 519.
[14] 杨卫东, 陈益泰. 不同杞柳品种对镉(Cd)吸收与忍耐的差异. 林业科学研究, 2008, 21(6): 857- 861.
[17] 张圆圆, 窦春英, 姚芳, 叶正钱. 氮素营养对重金属超积累植物东南景天吸收积累锌和镉的影响. 浙江林学院学报, 2010, 27(6): 831- 838.
[19] 乔海涛, 杨洪强, 申为宝, 姜倩倩, 由淑贞, 张龙, 冉昆. 平邑甜茶根系形态构型对氯化镉处理的响应. 林业科学, 2010, 46(1): 56- 60.
[20] 汪有良, 王保松, 施士争. 乔木型柳树无性系镉积累特性研究. 南京林业大学学报: 自然科学版, 2011, 35(2): 135- 138.
[25] 陈彩虹, 刘治昆, 陈光才, 单奇华, 张建锋. 苏柳172 和垂柳对 Cu2+的吸收特性及有机酸影响. 生态学报, 2011, 31(18): 5255- 5263.
[28] 何俊瑜, 任艳芳, 王阳阳, 李兆君. 不同耐性水稻幼苗根系对镉胁迫的形态及生理响应. 生态学报, 2011, 31(2): 522- 528.
[29] 李继光, 朱恩, 李廷强, 柳丹, 杨肖娥, 林国林, 韩晓日, 张玉龙. 氮对镉胁迫下东南景天根系形态及镉积累的影响. 环境污染与防治, 2007, 29(4): 271- 275.
MetaluptakeandrootmorphologicalchangesfortwovarietiesofSalixintegraundercadmiumstress
WANG Shufeng1, 2, SHI Xiang2, SUN Haijing2, CHEN Yitai2, YANG Xiao′e1,*
1CollegeofEnvironmentandResource,ZhejiangUniversity,Hangzhou310028,China2InstituteofSubtropicalForestry,ChineseAcademyofForestry,Fuyang311400,China
Willows (Salixspp.) are suitable for heavy metal phytoextraction due to their high element accumulation, high metal transport from roots to the shoots and high biomass production. Many species and hybrids of Salix spp. are known to colonise contaminated soils. For example,S.alba,S.viminalis,S.cinereaandS.capreanaturally invade polluted dredged sediment disposal sites. Therefore, there is an opportunity for genotype selection by checking survival, regeneration, and potentially also by testing metals accumulating in tissues which could then be harvested with remediating contaminated soils. Willow species and clones have different tolerance to particular metals, and significant differences were found for the uptake and accumulation of metals among willow varieties and clones. Soil contamination by cadmium due to human and natural activities is one of the most serious environmental problems in the world. The aim of this study is to investigate the cadmium uptake potential of two cultivated varieties (‘Weishanhu’ and ‘Yizhibi’) ofSalixintegra, of which the variety ‘Yizhibi’ has stronger tolerance to cadmium stress than ‘Weishanhu’ according to previous studies, and to discuss the possible mechanisms which involved in root adaptation under hydroponically cadmium treatment.
The results showed the highest content of cadmium was observed in root tissues for both varieties ofS.integra, and the cadmium content in phloem tissues was lower than that in roots. The cadmium content in leaves showed the lowest level among roots, phloem and xylem. The cadmium content in the aboveground (including phloem, xylem and leaf) tissues of two varieties ofS.integraincreased significantly compared to the control with the increase of cadmium treatment in the range of 10—70 μmol/L, and it came to the highest cadmium accumulation at the concentration of 70 μmol/L cadmium, while when exposed to 90 μmol/L cadmium solution, the cadmium content declined in the aboveground parts. The same accumulation patterns were found in roots for two varieties ofS.integrain the range of 10—70 μmol/L cadmium treatment. However, when the roots were exposed to 90 μmol/L cadmium treatment, the cadmium content in ‘Weishanhu’ declined sharply, but still rose for that in ‘Yizhibi’. This suggests the roots of ‘Yizhibi’ have greater potentential in uptake of cadmium than the variety ‘Weishanhu’ when exposed to higher concentration of cadmium.
The higher uptake and accumulate potential of ‘Yizhibi’ depends on the relatively unchangeable root morphology and fractal dimension under cadmium stress. Comparing to the root images of ‘Weishanhu’ and ‘Yizhibi’ under cadmium treatment, we found the total length, total surface area and volume of roots of ‘Yizhibi’ changed a little compared to the control, while that of ‘Weishanhu’ decreased under cadmium treatment. The fractal dimension of two varieties ofS.integrahad minor decline, which may suggest both ‘Weishanhu’ and ‘Yizhibi’ prefer to simple root configuration under cadmium treatment. We also found the nutrient uptake in leaves of two varieties ofS.integrachanged in different cadmium concentration. The Ca and Mn content in leaves decreased significantly in the concentration of 50 and 70 μmol/L cadmium, and no obvious change was observed for Fe content in leaves. It is interesting that the Cu content in leaves of ‘Weishanhu’ increased significantly in the concentration of 50 μmol/L cadmium.
Salixintegra; cadmium stress; uptake and accumulation; root morphology
浙江省科学技术厅社会公益项目(2011C23036)
2013- 06- 09;
2013- 07- 15
*通讯作者Corresponding author.E-mail: xyang@zju.edu.cn
10.5846/stxb201306091521
王树凤,施翔,孙海菁,陈益泰,杨肖娥.镉胁迫下杞柳对金属元素的吸收及其根系形态构型特征.生态学报,2013,33(19):6065- 6073.
Wang S F, Shi X, Sun H J, Chen Y T, Yang Xiao′e.Metal uptake and root morphological changes for two varieties ofSalixintegraunder cadmium stress.Acta Ecologica Sinica,2013,33(19):6065- 6073.
