慢病毒载体系统介导hUC-MSC绿色荧光蛋白和荧光素酶共表达技术体系的建立
2013-12-06林凤锦王水良黄粱浒王瑾祝玲王庆华谭建明
林凤锦 王水良 黄粱浒 王瑾 祝玲 王庆华 谭建明
间充质干细胞是一类具有高度自我更新、增殖和多向分化潜能的干细胞。相对于骨髓源间充质干细胞,人脐带间充质干细胞(human umbilical cord mesenchymal stem cell,hUC-MSC)具有增殖活性及成骨分化能力高,且来源广泛、培养简单、不易污染及提取无创伤等诸多优点[1]。hUCMSC移植为临床各系统疾病的损伤修复治疗和细胞替代治疗提供一种新的手段[2],从而成为近年来医学研究的热点。
干细胞移植治疗疾病的研究常需要在体外对将要移植的细胞进行标记,使这些细胞植入后,以及在体内分化后仍能够携带标记,研究人员借此可以对植入细胞的活动进行监测,判断其存活状态。标记和示踪方法有多种,早期使用较多的有生物染料DiI等[3-4],还有利用干细胞不断自我复制增殖的特性,使其在复制过程中摄取一些放射性标记的碱基或碱基的类似物,例如5溴-2脱氧尿苷(BrdU),再用放射性核素显影或者特异抗体检测的方法[5]。
本研究通过慢病毒载体系统介导,成功地在hUC-MSC中引入外源绿色荧光蛋白(green fluorescent protein,GFP)和荧光素酶基因的共表达,且该双外源蛋白的共表达对hUC-MSC的生长增殖无显著影响。慢病毒载体系统介导hUCMSC绿荧光蛋白和荧光素酶共表达技术体系的建立不仅极大地方便了其体内转归的示踪,同时也为基因工程修饰干细胞提供了强有力的手段。
材料和方法
一、材料
1.细胞和质粒:hUC-MSC来源于福州总医院泌尿外科实验室干细胞组,取P4代细胞。人胚肾上皮细胞系HEK293T购自美国典型培养物保藏中心(ATCC)。慢病毒表达载体pLEXMCS购自美国Open Biosystem公司,慢病毒包装质粒psPAX2和pMD2.G购自Addgene公司,GFP和荧光素酶共表达慢病毒载体pLEX-GFP-Luc由美国杜克大学李博士(Dr.Chuan-Yuan Li)惠赠。
2.酶和试剂:PCR试剂盒购自TaKaRa公司;PCR引物由上海生工生物工程公司合成(序列见表1);胎牛血清、DMEM/F12培养基、低糖DMEM购自美国Hyclone公司;Polybrene和聚乙烯亚胺(PEI)购自Sigama公司;嘌呤霉素购自ACROS公司;MTS、PMS和荧光素酶底物Luciferin购自 Promega公司 ;TRIzol购自 Life technolgies公司;逆转录试剂盒购自Fermentas公司;质粒小提试剂盒购自TIANGEN公司;SYBR和质粒大提试剂盒购自ROCHE公司。

表1 RT-PCR扩增引物序列、扩增片段及退火温度
二、方法
1.细胞培养:人胚肾上皮细胞系HEK293T的培养使用含10﹪胎牛血清的DMEM/F12;hUC-MSC的培养使用含10﹪ 胎牛血清的低糖DMEM培养基,置于含5﹪ CO2饱和湿度的37℃温箱中。
2.慢病毒的包装:正常培养的HEK293T细胞传入100 mm培养皿后,待细胞长至80﹪左右汇合度时,以聚乙烯亚胺(PEI)为介导,将pLEX-GFP-Luc(或空载体pLEXMCS)连同两个包装质粒psPAX2 和pMD2.G行共转染;转染12h后吸去转染液,换正常培养基并置回温箱培养,每隔24 h后收集含慢病毒的培养液,经过滤(0.45 μmol/L滤器)后分装,-80℃保存待用。
3.慢病毒的感染:正常培养的P4代hUC-MSC接种至100 mm培养皿,待细胞长至80﹪汇合度时吸去培养基,将适量病毒稀释入含Polybrene(终浓度8 μg/ml)的常规培养基后加至培养皿中。感染24 h后,弃去感染液,换含嘌呤霉素(终浓度1 μg/ml)的新鲜培养基筛选24 h。
4.荧光显微镜及IVIS Kinetic成像系统观察:慢病毒感染24 h并经嘌呤霉素进一步筛选24 h后的P4代hUC-MSC置荧光倒置显微镜下直接观察GFP的表达情况;同时,胰酶消化一部分细胞,1000 rpm离心5min后去上清,200μl无血清的低糖DMEM培养基重悬细胞后,再与 200μl的 Luciferin(300 μg/ml)充分混匀,置IVIS Kinetic成像系统观察并拍照记录荧光素酶的表达情况。
5.细胞生长曲线作图:慢病毒感染24 h并经嘌呤霉素进一步筛选24 h后的P4代hUC-MSC接种至24孔板(3000个细胞/孔),从接种后24 h开始,连续7 d每天取样,行MTS法测定活细胞数并绘制细胞生长曲线。
6.RT-PCR:依TRIzol法抽提培养细胞的总RNA,取各样本2 μg总RNA,经逆转录制备cDNA。以β-actin为内参,行常规及实时定量RT-PCR法分析Cyclin D1、Cyclin E1和p21基因mRNA在对照和GFP和荧光素酶共表达慢病毒感染后的hUC-MSC中的表达情况。各基因RT-PCR扩增引物及PCR退火温度见表1,常规PCR 扩增体系含 :2.5μl 10×buffer、上下游引物各 100 pmol、1.5μl dNTP(2.5mmol/L each)、Taq酶 1.25 U、cDNA 1μl,ddH2O 补足至 25μl。PCR反应条件,94℃预变性3min,94℃变性30 s,特定温度退火30 s,72℃延伸30 s的条件下循环30次,最后72℃延伸5min。PCR产物1.5﹪琼脂糖凝胶电泳鉴定,凝胶成像仪成像。实时定量RT-PCR 反应体系为 :10μl 2×SYBR 混合物、上下游引物各 100 pmol、cDNA 1μl,ddH2O 补足至20μl;PCR 循环条件同上,反应于ABI 7900HT Fast PCR仪上完成。基因表达的相对定量方法为:以β-actin基因mRNA的表达为内对照,首先依据公式ΔCt=Ct靶基因-Ctβ-actin,分别计算实验组和对照组的ΔCt,再依公式ΔΔCt=ΔCt实验组-ΔCt对照组计算出ΔΔCt值,最后计算相对表达量的差值即 2-ΔΔCt。
三、统计学分析方法
细胞生长曲线作图实验各重复三次,统计学处理采用成对两样本等方差t检验计算单尾P值;实时定量RT-PCR实验重复3次,每次做3个重复孔,取各次实验的为最后结果,并以t检验行差异显著性分析。以P < 0.01为差异具有统计学意义。
结 果
一、慢病毒感染不会造成体外培养hUCMSC形态的明显改变
慢病毒感染并经嘌呤霉素筛选后并未引致体外培养的hUC-MSC大量死亡,说明慢病毒包装成功,且感染效率高。普通光学显微镜观察结果显示,与未经感染的正常培养细胞相比,慢病毒感染并不会造成体外培养的hUC-MSC形态的明显改变(图 1)。
二、慢病毒载体系统介导的GFP和荧光素酶在hUC-MSC中的共表达
荧光显微镜和IVIS Kinetic成像系统的观察结果分别证实,GFP和荧光素酶经慢病毒载体系统的介导可在hUC-MSC中成功地共表达(图2,3)。
三、外源GFP和荧光素酶共表达对体外培养hUC-MSC生长增殖等表型无显著影响
体外培养的P4代hUC-MSC经对照或GFP和荧光素酶共表达慢病毒感染后,细胞生长曲线作图结果表明二者的细胞生长增殖速率并无显著差异(表2,图4)。进一步的普通和实时定量RT-PCR法检测结果也显示,与对照慢病毒感染相比,GFP和荧光素酶共表达慢病毒感染后其细胞周期调控相关蛋白Cyclin D1、Cyclin E1 和p21WAF1/CIP1mRNA表达水平分别是对照组的1.11倍(P=0.130)、0.54倍(P=0.000002)和0.78倍(P=0.0052)。依实时定量RT-PCR结果的判定标准,通常认为相对表达倍数> 2或< 0.25为差异有统计学意义,据此认为GFP和荧光素酶共表达对细胞调控相关蛋白Cyclin D1、Cyclin E1 和p21WAF1/CIP1mRNA表达水平无显著影响,表明外源GFP和荧光素酶的共表达对体外培养的hUCMSC生长增殖等表型无显著影响(表3,图5)。
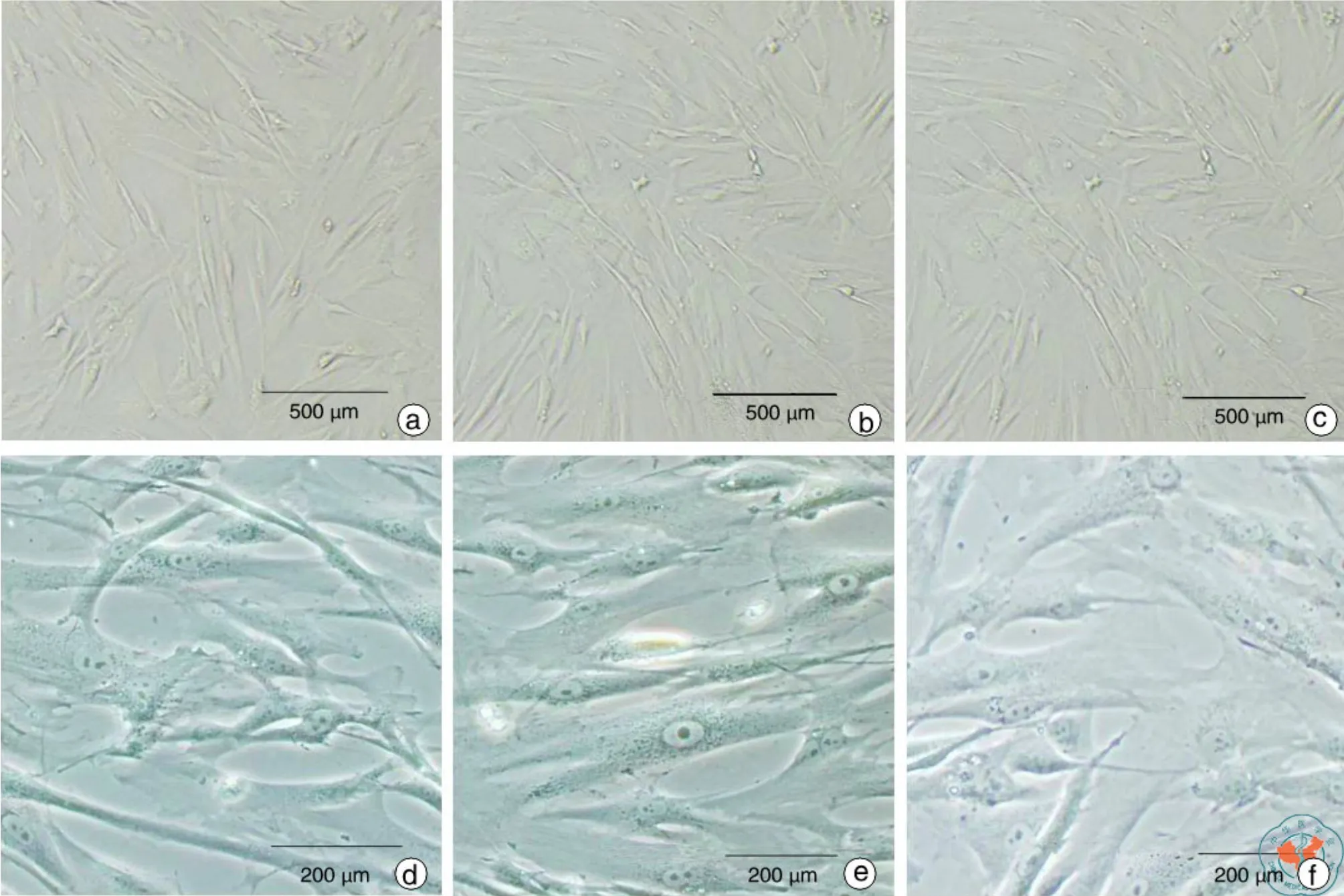
图1 普通光学显微镜下观察未经感染、对照病毒感染和GFP及荧光素酶共表达病毒感染的hUC-MSC的形态

图2 荧光显微镜观察对照病毒感染和GFP及荧光素酶共表达病毒感染的hUC-MSC中GFP的表达情况

表2 对照病毒和GFP及荧光素酶共表达病毒感染hUC-MSC生长增殖结果
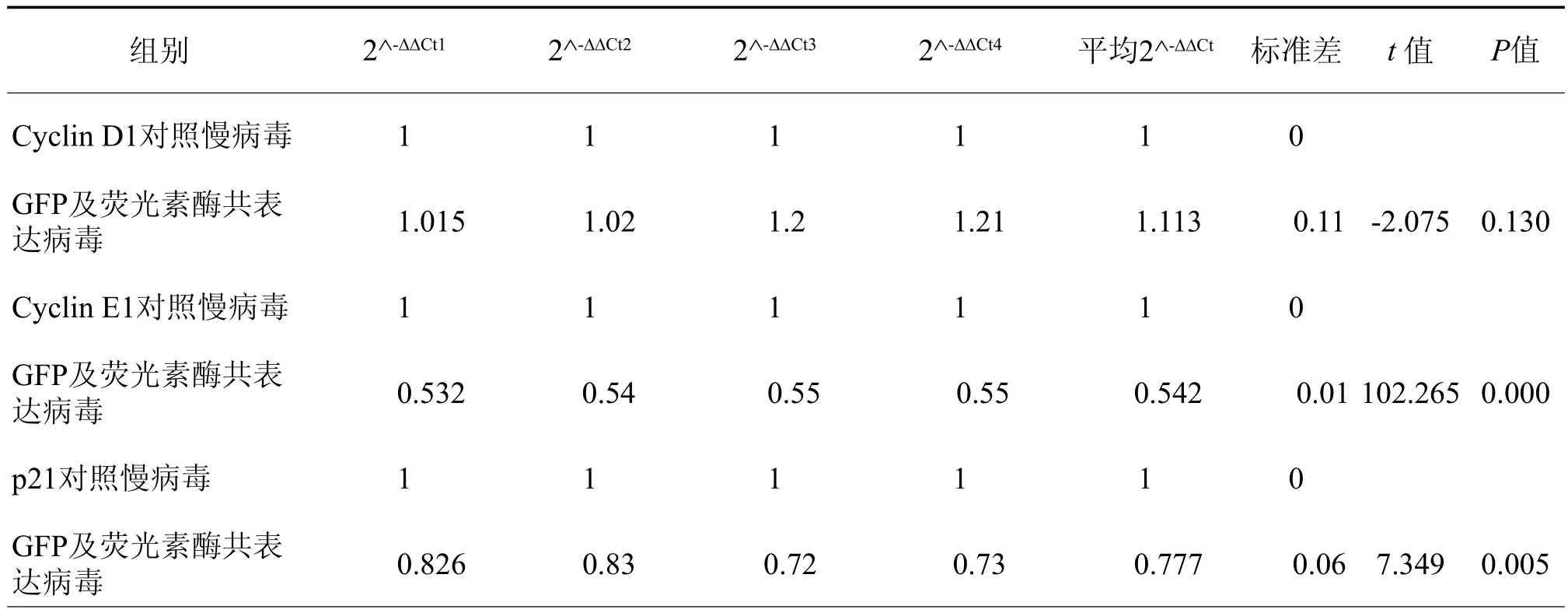
表3 hUC-MSC细胞周期调控相关蛋白mRNA表达水平的实时定量RT-PCR结果
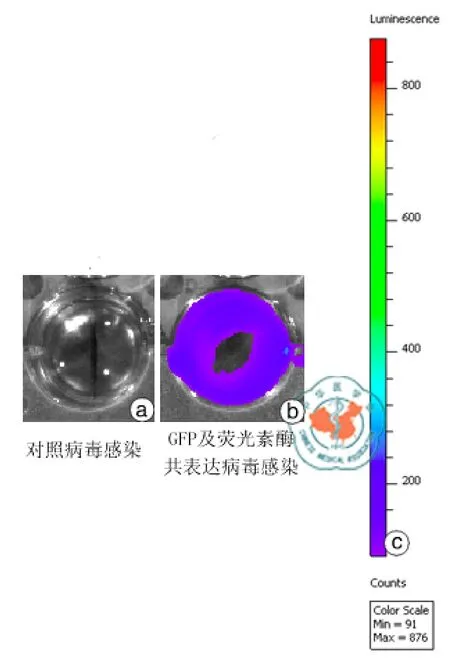
图3 IVIS Kinetic 成像系统观察人脐带间充质干细胞(hUC-MSC)对照病毒感染和GFP及荧光素酶共表达病毒感染的hUC-MSC中荧光素酶的表达情况

图4 对照病毒和GFP及荧光素酶共表达病毒感染hUC-MSC生长曲线
讨 论
近年来,干细胞生物学的飞速发展在丰富了干细胞基础理论的同时,也极大地促进了干细胞分离、体外培养和基因工程修饰等相关技术的持续改进;相应地,干细胞临床应用的相关研究也蓬勃兴起。迄今,基于其多向分化潜能,干细胞替代疗法已在神经退行性疾病以及肾脏等疾病的治疗中得以广泛应用[6]。此外,众多研究均表明,干细胞尚可通过抑制多种免疫细胞如树突状细胞、T和B淋巴细胞以及自然杀伤细胞等的增殖和功能而在体内发挥独特的免疫调节作用[7-9],这一属性使其因在免疫调节紊乱性疾病中的巨大潜在治疗价值而备受研究人员的关注。事实上,基于干细胞的治疗已在移植物抗宿主病、多发性硬化症和系统性红斑狼疮等多种人类免疫性疾病的治疗中得以成功应用[10];在一项临床试验中也证实,自体间充质干细胞输注可显著降低肾移植患者的急行排斥发生率,并有助于移植肾功能的及早恢复[11]。
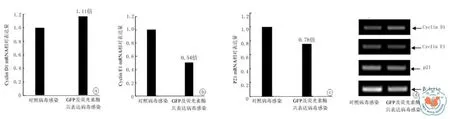
图5 hUC-MSC细胞周期调控相关蛋白mRNA表达水平的RT-PCR结果
干细胞有胚胎干细胞、成体干细胞和诱导性多潜能干细胞之分,目前临床基础和试验研究中以属成体干细胞的间充质干细胞居多。间充质干细胞依其来源分,主要包括骨髓间充质干细胞和脐带间充质干细胞等。相比较而言,骨髓间充质干细胞的基础和临床应用研究的开展较早,但鉴于其在骨髓内含量有限,仅约占有核细胞的0.001﹪~0.01﹪,且骨髓MSC的数量和分化能力随着年龄的增长相对减少和减弱[12],这在很大程度上限制了其临床应用;此外,骨髓MSC伴供者年岁增长而来的遗传改变(如基因突变等)和表观遗传学的改变(特别是有害改变的蓄积)也进一步增加了其临床治疗应用中的潜在风险。在探索间充质干细胞新来源的努力中,Romanov等[13]于2003年成功地从人脐带中分离得到来源更为丰富、且细胞增殖活性和成骨分化能力更高的hUC-MSC,这无疑为干细胞治疗的基础和临床应用研究开辟了一片全新的领地。
众所周知,为有效地对植入体内的干细胞活动进行监测,判断其存活状态和转归,对输注的干细胞进行体外标记以便示踪势在必行。早期使用比较多的标记和示踪方法有生物染料法和放射性核素显影法等[4-6];但以上两种方法都有自身局限性,生物染料可能在移植入的细胞死亡后漏出,再被周围宿主细胞摄取从而形成假相;基于BrdU的放射性核素显影法的缺陷在于植入的细胞无论是否存活,都可以被检测到[14]。报告基因法以外源报告基因的成功表达和相应的活体检测技术为基础,是近年发展起来并迅速得以优化并广为应用的新细胞标记和示踪技术体系。传统的报告基因法一般在拟标记失踪的细胞内引入单一的外源GFP或荧光素酶的表达,但鉴于二者各自的优缺点,如荧光素酶表达的体外和活体检测需额外底物,但其体内失踪信号较GFP表达的活体检测时更为特异;而GFP的表达则可很方便地在荧光显微镜下直接观察。本研究中,以慢病毒载体系统为介导,成功地实现了GFP和荧光素酶在hUCMSC中的共表达,这不仅易化了其相关体外研究的实时动态监测(荧光显微镜观察);也极大地方便了通过荧光素酶底物法的活体内转归的特异性示踪。此外,初步的表型分析也表明,慢病毒感染并不会造成体外培养的hUC-MSC形态的明显改变;同时GFP和荧光素酶共表达慢病毒感染并不会导致细胞周期调控相关蛋白Cyclin D1、Cyclin E1 和p21WAF1/CIP1mRNA表达水平的明显改变,表明外源GFP和荧光素酶的共表达对体外培养的hUC-MSC生长增殖等表型也无显著影响。
综上,本研究建立的hUC-MSC外源GFP和荧光素酶共表达技术体系在规避二者示踪研究中缺点的同时也可有效地结合二者的优点,从而将极大地方便其体内外相关的基础和临床前动物水平的研究。诚然,慢病毒载体系统本身的安全性尚待更进一步的研究以资阐明。
1 Baksh D,Yao R,Tuan RS.Comparison of proliferative and multilineage differentiation potential of human mesenchymal stem cells derived from umbilical cord and bone marrow[J].Stem Cells,2007,25(6):1384-1392.
2 Uccelli A,Moretta L,Pistoia V.Mesenchymal stem cells in health and disease[J].Nat Rev Immunol,2008,8(9):726-736.
3 Micci MA,Learish RD,Li H.Neural stem cells express RET,produce nitric oxide,and survive transplantation in the gastrointestinal tract[J].Gastroenterology,2001,2l(4):757-766.
4 刘述,谢瑶,陈系占,等.小鼠胚胎干细胞植入大鼠脑内分化的研究[J].中国临床康复,2003,7(16):2258-2259
5 Mcdonald JW,Liu XZ,Qu Y,et al.Transplanted embryonic stem cells survive,differentiate and promote recovery in injured rat spinal cord[J].Nature medicine,1999,5(12):1410-1412.
6 杨顺良,谭建明.肾脏疾病的干细胞治疗[J/CD].中华细胞与干细胞杂志:电子版,2011,1(2):120-128.
7 Nauta AJ,Fibbe WE.Immunomodulatory properties of mesenchymal stromal cells[J].Blood,2007,110(10):3499-3506.
8 Uccelli A,Pistoia V,Moretta L.Mesenchymal stem cells: a new strategy for immunosuppression?[J].Trends Immunol,2007,28(5):219-226.
9 Uccelli A,Moretta L,Pistoia V.Mesenchymal stem cells in health and disease[J].Nat Rev Immunol,2008,8(9):726-736.
10 Tan J,Wu W,Xu X,et al.Induction therapy with autologous mesenchymal stem cells in living-related kidney transplants: a randomized controlled trial[J].JAMA,2012,307(11):1169-1177.
11 Akiyama K,Chen C,Wang D,et al.Mesenchymal-stemcell-induced immunoregulation involves FAS-ligand-/FAS-mediated T cell apoptosis[J].Cell Stem Cell,2012,10(5):544-555.
12 哈承志,王大伟.脐带间充质干细胞在骨组织工程中的应用进展[J].中国组织工程研究,2012,16(1):158-162.
13 Romanov YA,Svintsitskaya VA,Smirnov VN.Searching for alternativesources of postnatal human mesenchymal stem cells:candidate MSC-like cells from umbilical cord[J].Stem Cells,2003,21(1):105-108.
14 关云谦,陈彪,刘平,等.干细胞脑内移植有效标记研究:绿色荧光蛋白质粒标记的应用价值[J].中国临床康复,2004,8(13):2506-2508
