普城沙雷氏菌splI及spsI基因突变株的构建
2013-12-03丁丽娜刘晓光
葛 军,丁丽娜,刘晓光
(江苏大学生命科学研究院,镇江212013)
1970年Nealson等研究一种海洋发光细菌费氏弧菌(Vibrio fischeri)时发现,这种在液体环境中生长的细菌只有细胞浓度达到一定数量时,才会产生发光作用[1]。细菌的生物发光与细菌的种群密度紧密相关,而这种现象是受到群体感应(Quorum-sensing,QS)的控制。自从发现了费氏弧菌LuxR/LuxI的群体感应现象,我们知道了细菌不是单独的个体,它通过产生小分子的信号进行交流。当细菌量较少时,它产生的信号不能被其他细菌感知,但是随着细菌浓度的增加,信号浓度增加,当达到一定阈值时,细菌能够感应到周围环境中自身或其他细菌的数量变化,并通过信号分子启动相关基因的表达,改变和协调它们之间的行为,共同展示出它们的某些生理特性,从而表现出单个细菌无法从事的某些生理功能和调节机制,这种行为就是群体感应[2]。细菌群体感应可以产生不同的信号分子,调节多种功能,如影响毒力因子的产生,共生现象,细胞的传播与分布,质粒的结合和转移,生物膜的形成等,同时,QS还可以调控多种胞外酶和次生代谢物的产生,如蛋白酶、几丁质酶、吲哚乙酸、抗生素、嗜铁素等的生物合成[3-5]。许多革兰氏阴性菌利用N-乙酰基高丝氨酸内酯 (N-acylhomoserine lactones,AHLs)作为胞间信号分子协调细菌群体基因的表达。在革兰氏阴性细菌中群体感应的调控机制需要两种组分参与:LuxI蛋白与LuxR蛋白。其中LuxI蛋白是AHL合成酶,负责信号分子的合成,而LuxR蛋白是信号受体,形成受体-自体诱导物复合体,当该复合体与目的基因启动子结合,就能激活该基因的转录[6-7]。
S.plymuthica菌株G3是分离自小麦内茎的植物内生细菌[8],具有生防因子的潜能。前期研究我们已经鉴定了G3菌株中存在2个QS系统SplIR和SpsIR,采用AHL信号淬灭(Quorum quenching,QQ)的策略,表明QS参与全局调控多种生防表型,且正调控生物膜形成,但对泳动运动性几乎没有影响[8-9]。然而两个QS系统SplIR和SpsIR之间的关系是相互平行、相互拮抗,还是上下游关系,还有待进一步研究。因此本研究以S.plymuthica G3菌株为模式细菌,通过基因替换、同源重组策略构建了splI和 spsI的突变体及互补菌株,并进行了表型分析和验证。为进一步阐明QS调控网络全局调控S.plymuthica生防相关表型的机制奠定基础。
1 材料与方法
1.1 本实验所用菌株、质粒及引物见表1。

表1 实验中用到的菌株,质粒和引物Table 1 Strains,plasmids and primers used in this study
1.2 主要实验试剂
pMD18T-simple等载体、各种限制性内切酶、T4 DNA连接酶等购自Takara和Fermentas。基因组DNA和质粒提取试剂盒,以及PCR产物纯化试剂盒购自Axygen Biosciences Inc。氨苄青霉素(Amp)的终浓度为 100 μg/mL,庆大霉素(Gm)终浓度为 25 μg/mL,氯霉素(Cm)终浓度为25 μg/mL,利福平(Rif)终浓度为 40 μg/mL,链霉素(Sm)终浓度为50 μg/mL,四环素(Tc)终浓度为 25 μg/mL。
LB(Luria-Bertani broth)培养基:胰蛋白胨10 g,酵母浸膏粉5 g,氯化钠10g,加水至1 L。101bf/in2(6.895×104Pa)高压下蒸汽灭菌20 min,常温储存。LA(LB agar)培养基通过在LB中添加1.5%琼脂粉固化获得。
1.3 方法
1.3.1 splI基因的克隆
利用软件DNAStar设计引物splIR-F和splIR-R(见表1)。G3基因组DNA的提取按试剂盒使用说明书操作,使用引物对splIR-F/R进行PCR扩增,PCR反应体系为:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min 30 s,30个循环;72℃ 10 min。PCR产物纯化后与pMD18T-simple连接,于16℃ 反应4 h,42℃ 热击转化E.coliJM109感受态细胞。涂布于含 Amp、IPTG、X-gal的LA平板上,37℃ 过夜培养。挑取白色菌斑获得pMD18T-simple-splI,并进行菌落PCR鉴定。
1.3.2 △splI、△spsI突变体的构建及筛选
挑取阳性菌落提取质粒 pMD18T-simple-splI,用SalI酶切DNA片断,插入Gm抗性基因 (由SalI酶切质粒 p34S-Gm所得),获得质粒 pMD18T-simple-splIGm。再通过PCR回收得到2222bp splI-Gm的基因片段后平端化,插入经SmaI酶切的自杀性载体pDM4,获得重组质粒pDM4-splI-Gm,转化大肠杆菌S17-1,37℃过夜培养。挑选菌落进行PCR和酶切验证。
因为G3和C48菌株的splI和spsI基因序列具有100% 同源性。本实验直接使用贾金丽构建的C48菌株spsI突变体的自杀性质粒 S17-1/pDM4-spsI-Sm[14]。挑取阳性菌落S17-1/pDM4-splI-Gm、S17-1/pDM4-spsISm在37℃,野生菌G3在28℃摇床中200 r/min条件下过夜培养,经双亲配合,分别涂布于Rif、Cm、Gm与Rif、Cm、Sm抗性平板上,培养48 h;挑取单菌落于10%蔗糖板上划线,进一步挑取单菌落,筛选在Cm平板上不生长,而在Gm平板上生长的克隆,表明已发生双交换,即得到S.plymuthica G3的splI、spsI基因突变菌株。
1.3.3 △splI、△splI突变体的验证
提取突变株△splI、△spsI的基因组DNA,以基因组DNA为模板进行PCR验证;然后将PCR产物克隆到pMD19-T载体,挑选阳性克隆测序验证。
1.3.4 互补菌株的构建
构建互补菌株的供体 S17-1/pUCP26-spsI、S17-1/pUCP26-splIR 也由贾金丽完成[14]。经与△spsI、△splI突变菌株双亲配合得到具有四环素抗性的△spsI、△splI的互补菌株△spsI/pUCP26-spsI、△splI/pUCP26-splIR。
1.3.5 相关表型的检测
表型检测包括AHL信号产生、蛋白酶活性和泳动性分析。具体方法见参考文献[9]。
2 结果
2.1 splI、spsI突变体的构建及筛选
质粒 pMD18T-simple-splI经 SalI酶切后,插入经SalI酶切的800 bp Gm抗性基因,获得pMD18T-simplesplI-Gm;阳性质粒平端化后与经SmaI酶切的自杀性载体pDM4连接,得到自杀性重组质粒pDM4-splI-Gm(图1)。通过PCR验证筛选阳性克隆。如图2所示,用G3基因组为模板,PCR得到未插入Gm片段基因片段splI(1422bp)及spsI(733bp);分别以splI和spsI突变体基因组为模板,,PCR得到插入Gm成功后的阳性质粒片段splI-Gm(2222bp)以及spsI-Gm(2700bp)。

分别以 S17-1/pDM4-splI-Gm、S17-1/pDM4-spsI-Sm为供体菌,野生型菌株G3为受体菌,经过双亲接合转移及同源重组,分别筛选出在Cm平板上不生长,而在Gm或Sm平板上生长的克隆,即得到S.plymuthica G3的splI、spsI基因突变菌株△splI、△splI。并通过 PCR和测序验证。
2.2 突变对AHL信号产生的影响
利用报告菌株Chromobacterium.violaceum CV026(紫色杆菌)划线检测其AHL信号,48 h进行表型观察。结果如图3所示,splI、spsI突变菌株及空载体对照菌株释放的信号分子相比野生型G3都减弱,但是减弱的效果不是很明显。更精确地信号检测需要运用液质联用质谱tandem mass spectrometry coupled to liquid chromatography(LC-MS/MS)技术进行定量分析验证。

图3 splI(A)及spsI(B)对AHL信号产生的影响Fig 3 Detection AHLs of splI(A)and spsI(B)by CV026
2.3 突变对蛋白酶活性的影响
很多细菌的QS系统已经被报道参与调节次级代谢产物和胞外酶如蛋白酶、几丁质酶等。通过蛋白酶活性检测分析发现,△splI、△spsI突变体的蛋白酶水解圈与野生菌G3相比,蛋白酶活性明显减少,表明SplI、SpsI作为激活子,正调控蛋白酶的产生。对△splI、△spsI互补菌株进行蛋白酶检测,发现互补菌株蛋白酶活性恢复到野生型水平,但空白对照没有明显变化(图4)。

图4 splI(A)及spsI(B)对蛋白酶活性的影响Fig 4 Protease activity of splI(A)and spsI(B)
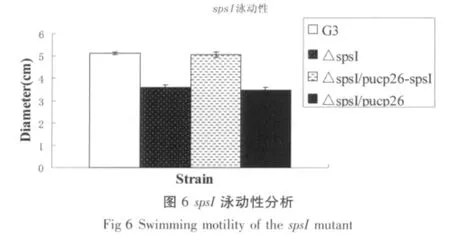
2.4 泳动性分析
Swimming motility(泳动运动)主要依靠极化鞭毛,运动性与细菌侵染力和定殖有关,这种运动可以在低琼脂培养基上观测到。在28℃培养12 h后,观测G3、△splI、△spsI以及互补菌株和空白对照的运动情况,然后测出运动距离,最后利用统计学分析。由图5可以看出splI突变后,与野生型相比运动效果加强,达到极显著水平(p<0.001),说明splI负调控G3的运动性。而由图6可知当spsI突变后,运动明显减弱,与野生型相比也达到了(p<0.001)极显著水平,说明spsI正调控G3的运动性。

3 讨论
自从在费氏弧菌中发现第一个群体感应(QS)调控元件以来,随着对细胞信号传导的深入了解,微生物作为单个细胞却行使多细胞功能的研究成为探索的热点。在过去的几十年,在许多的革兰氏阴性菌发现了QS。在这些细菌中QS系统主要调控毒力因子、运动性、结合转移、生物膜的形成、生长抑制和次级代谢产物的合成等,次级代谢产物主要是抗生素、嗜铁素、蛋白酶、几丁质酶等。群体感应系统受AHLs信号浓度的调控,进而调节细菌中一些特定基因表达[1-4,7]。
已有的研究表明在菌株C48中SplI负责产生所有3种类型的AHL信号分子,占主导地位;SpsI产生的信号分子较少,只负责产生非取代基的AHL信号。所以当splI突变时,相比spsI突变对蛋白酶活性,生物膜的形成量和对板栗疫病菌抑制作用更明显,同时只残留痕量AHL信号。同时splI突变后明显抑制硝吡咯菌素的产生[10,14]。在本实验中,当 splI、spsI单独突变时信号分子减弱不是很明显,与C48菌株中以SplI为主导的情况有所不同,其分子机理还有待于进一步研究。而G3菌株splI突变后导致运动性增强;spsI突变引起运动性明显降低表明SplI和SpsI差异调控G3菌株的泳动运动性,两者作用相互抵消的最终结果可能导致双突变对运动性没有明显影响,尚需实验验证。这与已报道的G3菌株AHL信号淬灭没有明显影响运动性[9]的结果并不冲突。
总之,目前对于S.plymuthica G3中SplI/SplR和SpsR/SpsI QS系统的了解还很少。本实验为继续构建splI和spsI双突变,以及通过报告基因融合分析等进一步研究QS网络中基因的功能和相互作用机制奠定基础。
[1]Hanzelka B L,Parsek M R,Val D L,et al.Acylhomoserine lactone synthase activity of the Vibrio fischeri AinS protein[J].J Bacteriol,1999,181(18):5766-5770.
[2]Wang Y J,Huang J J,Leadbetter J R.Acyl-HSL signal decay:intrinsic to bacterial cell-cell communications[J].Adv Appl Microbiol,2007,61:27-58.
[3]Reading N C,Sperandio V.Quorum sensing:the many languages of bacteria[J].FEMS Microbiol Lett,2006,254(1):1-11.
[4]Winzer K,Williams P.Quorum sensing and the regulation of virulence gene expression in pathogenic bacteria[J].Int J Med Microbiol,2001,291(2):131-143.
[5]Czajkowski R,Jafra S.Quenching of acyl-homoserine lactone-dependent quorum sensing by enzymatic disruption of signal molecules[J].Acta Biochim Pol,2009,56(1):1-16.
[6]Parsek M R,Val D L,Hanzelka B L,et al.Acyl homoserine-lactone quorum-sensing signal generation[J].Proc Natl Acad Sci U S A,1999,96(8):4360-4365.
[7]Williams P,Winzer K,Chan W C,et al.Look who's talking:communication and quorum sensing in the bacterial world[J].Philos Trans R Soc Lond B Biol Sci,2007,362(1483):1119-1134.
[8]Liu X,Jia J,Atkinson S,et al.Biocontrol potential of an endophytic Serratia sp.G3 and its mode of action[J].World J Microbiol Biotech,2010,26:1465-1471.
[9]Liu X,Jia J,Popat R,et al.Characterisation of two quorum sensing systems in the endophytic Serratia plymuthica strain G3:differential control of motility and biofilm formation according to life-style[J].BMC Microbiol,2011,11(1):26.
[10]Liu X,Bimerew M,Ma Y,et al.Quorum-sensing signaling is required for production of the antibiotic pyrrolnitrin in a rhizospheric biocontrol strain of Serratia plymuthica[J].FEMS Microbiol Lett,2007,270(2):299-305.
[11]McClean K H,Winson M K,Fish L,et al.Quorum sensing and Chromobacterium violaceum:exploitation of violacein production and inhibition for the detection of N-acylhomoserine lactones[J].Microbiol,1997,143(12):3703-3711.
[12]Mousseau Y,Leclers D,Faucher-Durand K,et al.Improved agarose gel assay for quantification of growth factor-induced cell motility[J].Biotechniques,2007,43(4):509-516.
[13]Dennis J J,Zylstra G J.Plasposons:modular self-cloning minitransposon derivatives for rapid genetic analysis of gram-negative bacterial genomes[J].Appl Environ Microbio,1998,64(7):2710-2715.
[14]贾金丽.Serratia plymuthica群体感应系统鉴定及其信号淬灭研究[D].江苏大学硕士论文,2010.
