1,25-二羟基维生素D3抑制脂肪细胞分化作用的研究*
2013-12-03关晓慧王宝利
关晓慧 王 君 郭 菲 周 杰 王宝利
骨髓间充质干细胞是骨髓中除了造血干细胞之外的另一类干细胞,具有定向或多向分化的潜能,在特定的诱导条件下可以向成骨细胞、脂肪细胞、软骨细胞、肌细胞及神经细胞等组织细胞分化。正常生理状态下,间充质干细胞具有向脂肪细胞和成骨细胞相等的分化潜能。在某些病理状态下,成骨或成脂的某一方面调控占优势,通常会削弱间充质干细胞向另一方向分化的能力,存在着此消彼长的关系[1-2]。1,25-二羟基维生素D3[1,25(OH)2D3]是体内主要的钙磷调节激素,其可通过调节肠道和肾脏对钙磷的吸收和重吸收、骨钙的转移来调控矿物质的生理平衡,促进骨的矿化和生长[3]。此外,生理剂量的1,25(OH)2D3可抑制成骨细胞增殖、促进成骨细胞分化[4-5]。本研究观察了1,25(OH)2D3对脂肪细胞分化的影响,并初步探讨其作用机制。
1 材料与方法
1.1 材料 间充质干细胞系C3H10T1/2由本室保存。1,25(OH)2D3、1-甲基-3-异丁基-黄嘌呤(IBMX)、地塞米松和胰岛素购自Sigma;胎牛血清、BME、胰酶、α-MEM等为Invitrogen公司产品;RNA提取试剂盒、蛋白提取试剂盒为天根公司产品;β连环素(β-catenin)抗体购自Epitomics公司;引物由上海Invit⁃rogen公司合成。
1.2 方法
1.2.1 前脂肪细胞C3H10T1/2的培养与分化 在37℃、5%CO2的条件下,用含10%FBS和100 U/mL青霉素、链霉素的BME培养基培养间充质干细胞系C3H10T1/2。当细胞达到80%汇合时,将细胞接种于6孔板中,待细胞汇合1 d后,加入含有0.5 mmol/L IBMX、10-7mol/L地塞米松、10 mg/L胰岛素和10%FBS的α-MEM培养基培养72 h后,再换以含10 mg/L胰岛素、10%FBS的α-MEM培养48 h。
1.2.2 细胞的分组与处理 C3H10T1/2细胞分为6组(每组4孔),分别为对照组、诱导分化组和4个不同剂量(依次为10-9、10-8、10-7、10-6mol/L)的1,25(OH)2D3处理组(依次命名为VD3处理组1~4)。其中对照组加入溶媒,诱导分化组加入脂肪细胞诱导分化试剂进行诱导分化(如1.2.1所述),1,25(OH)2D3处理组除了加入脂肪细胞诱导分化试剂外,分别予以10-9、10-8、10-7、10-6mol/L 1,25(OH)2D3处理。
1.2.3 油红O染色以及细胞计数观察脂肪细胞的分化情况 将诱导5 d的细胞用PBS洗涤后,依次用4%多聚甲醛固定15 min;蒸馏水漂洗1 min;60%异丙醇孵育1~2 min;油红O染色5 min;蒸馏水漂洗干净。显微镜下观察各组脂肪细胞的分化情况,拍照并计数;然后计算成脂率(脂肪细胞数/总细胞数)及RF(处理组成脂率/对照组成脂率),分析脂肪细胞的分化情况。
1.2.4 RT-PCR检测脂肪细胞特异性转录因子和表征基因表达 细胞总RNA提取按照天根总RNA提取试剂盒说明书进行。采用Thermo逆转录试剂盒将2 μg RNA合成为cDNA第1链。运用primer 5软件设计脂肪细胞特异性转录因子过氧化物酶体增殖物激活受体(PPAR)γ、CCAAT增强子结合蛋白(C/EBP)α、脂肪细胞表征因子aP2以及Wnt/β-catenin信号通路抑制因子分泌性卷曲相关蛋白1(sFRP1)的引物,引物序列见表1。RT-PCR反应体系:cDNA 3 μL,上下游引物(10 μmol/L)各1 μL,2×Sybr Green PCR Master Mix 10 μL,去离子水补充至20 μL。反应条件:95℃2 min预变性,95℃变性20 s,57℃退火20 s,72℃延伸20 s,共进行40个循环。采用融解曲线法分析PCR产物,以排除引物二聚体的干扰。采用2-∆∆Ct法计算各实验组目的基因相对于对照组的表达量,其中∆Ct=目的基因Ct值-β-actin Ct值。
1.2.5 Western blot检测β-catenin蛋白表达 消化收集细胞,加入适量蛋白裂解液,冰上放置20 min,10 000×g离心15 min,取上清,用BCA方法测定蛋白浓度。分别取各组蛋白30 μg进行10%SDS-PAGE电泳,将蛋白转移到NC膜上,脱脂奶粉封闭2 h,与一抗孵育过夜,TBST洗涤4次,每次10 min后,加入辣根过氧化物酶标记的二抗孵育2 h,TBST洗涤4次,每次10 min后,采用ECL化学发光试剂盒检测印迹结果。

Table 1 Primer sequence of genes表1 各基因引物序列
1.3 统计学方法 采用SPSS 17.0统计软件分析,计量资料数据以均数±标准差(x±s)表示。多组间均数比较采用单因素方差分析,多重比较采用LSD-t检验。Plt;0.05为差异有统计学意义。
2 结果
2.1 1,25(OH)2D3对脂肪细胞分化的影响 对照组前脂肪细胞只有6.00%分化成脂肪细胞,诱导分化组可见80.15%的细胞分化成脂肪细胞;1,25(OH)2D3处理后,分化的脂肪细胞显著减少(均Plt;0.01),并呈现剂量依赖关系,见表2。

Table 2 Comparison of adipocyte differentiation between different treated cells表2 各组细胞中脂肪细胞分化率的比较(n=6,x±s)
2.2 RT-PCR检测目的基因表达 与对照组比较,诱导分化组脂肪细胞特异性转录因子PPARγ、C/EBPα及脂肪细胞表征因子aP2的mRNA表达显著增加,分别达到对照组的11.69倍、11.44倍和28.18倍,Wnt/βcatenin信号通路抑制因子sFRP1 mRNA亦显著增加,达到对照组的4.52倍(均Plt;0.01)。1,25(OH)2D3处理后PPARγ、C/EBPα、aP2和sFRP1mRNA表达显著减少,并呈现剂量依赖关系,见表3。
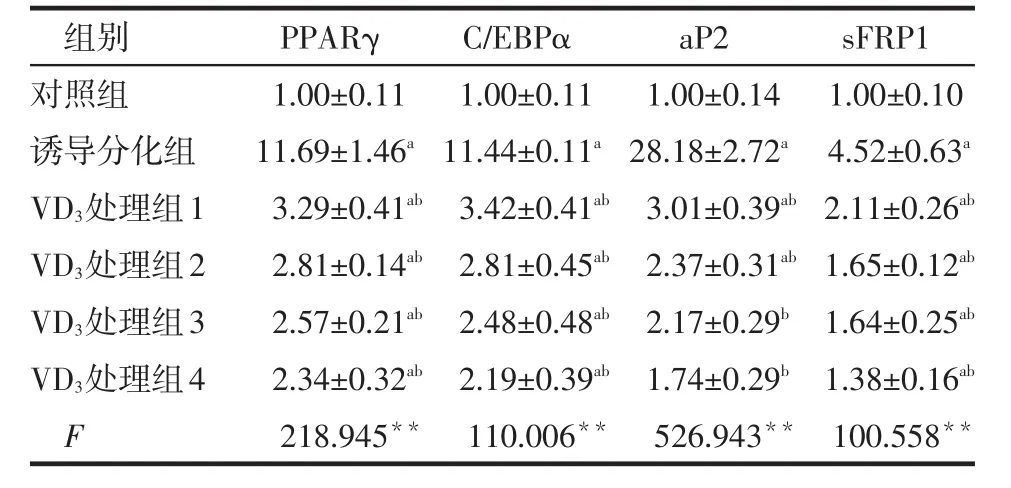
Table 3 Relative expression levels of PPARγ,C/EBPα,aP2 and sFRP1 mRNA in different groups of cells表3 各组细胞中PPARγ、C/EBPα、aP2和sFRP1 mRNA相对表达情况 (n=6,x±s)
2.3 Western blot检测β-catenin蛋白的表达 对照组、诱导分化组、1,25(OH)2D3处理组(10-6mol/L组)中β-catenin/β-actin比值依次为0.98±0.07、0.48±0.04、0.83±0.03,差异有统计学意义(F=87.61,Plt;0.01)。与对照组比较,诱导分化组β-catenin蛋白表达水平显著下降(Plt;0.01);1,25(OH)2D3处理后,β-catenin蛋白表达水平显著升高(Plt;0.01),见图1。

Figure 1 Effects of 1,25(OH)2D3on β-catenin protein expression in C3H10T1/2图1 1,25(OH)2D3对C3H10T1/2中β-catenin蛋白表达的影响
3 讨论
脂肪细胞和成骨细胞来源于相同的祖细胞-间充质干细胞,因而脂肪细胞和成骨细胞分化之间存在着此消彼长的关系。骨髓间充质干细胞向脂肪细胞分化过程中C/EBPs和PPARγ等转录因子起了关键性作用,其中PPARγ的作用尤为显著[6]。C/EBPs家族属于脂肪细胞特异性转录因子,包括α、β、δ3种异构体,它们分别在脂肪细胞分化的不同时期表达[7]。其中,C/EBP β和 C/EBP δ在前脂肪细胞分化早期表达较高,可以诱导C/EBPα和PPARγ的表达(PPARγ和C/EBPα的启动子上均含有C/EBP的结合位点),到分化晚期C/EBP β表达降低而C/EBP δ几乎不表达,C/EBP α在分化晚期开始表达,它可以转录激活许多脂肪细胞特异性基因如aP2,从而进一步促进前脂肪细胞的分化。PPARγ是一类由配体激活的脂肪细胞特异性核转录因子,属于Ⅱ型核激素受体超家族,在决定细胞命运、脂类物质生物合成、炎症和胰岛素敏感性等方面有重要功能[8]。间充质细胞中PPARγ被激活后可以抑制Runx2和Osterix等成骨细胞特异性转录因子表达,因而成骨细胞分化减弱而脂肪细胞分化加强。相反,PPARγ2基因失活突变也可以打破骨髓间充质细胞成骨/成脂分化的平衡,造成脂肪细胞分化障碍而成骨细胞分化增强,小梁骨量增加[9]。
1,25(OH)2D3是维生素D在体内的最终活性成分,其在调控骨形成以及骨发育中起重要作用。Boyan等[4]研究发现1,25(OH)2D3处理成骨细胞分化时,成骨细胞特异性转录因子Runx2、Osterix等表达增加,成骨细胞分化增强。与此同时,成骨细胞的增殖受到抑制。
本研究中,受脂肪细胞诱导分化试剂的影响,间充质细胞中PPARγ和C/EBPα表达量急剧增加,脂肪细胞表征因子aP2也显著升高。1,25(OH)2D3处理后PPARγ、C/EBPα及aP2的mRNA表达显著减少。与此一致,在脂肪细胞诱导分化试剂的作用下,间充质细胞分化为具有大量脂肪滴的脂肪细胞,而1,25(OH)2D3的处理强烈阻断脂肪细胞的生成。
经典Wnt通路通过上调成骨分化相关基因Runx2、DIx5或Osterix促进骨髓间充质干细胞发育为成骨细胞,而成脂细胞的活化需要经典的Wnt信号通路的失活[10-11]。本研究中1,25(OH)2D3下调C3H10T1/2细胞中sFRP1 mRNA的表达,而β-catenin蛋白表达水平明显升高,表明1,25(OH)2D3可能通过下调sFRP1基因表达,继而激活β-catenin信号通路,从而阻断脂肪细胞分化。
[1]董学君,孙荷,张国荣,等.骨髓间充质干细胞分化潜能研究进展[J].中国细胞生物学学报,2010,32(1):49-55.
[2]Sivasubramaniyan K,Lehnen D,Ghazanfari R,et al.Phenotypic and functional heterogeneity of human bone marrow-and amnion-de⁃rived MSC subsets[J].Ann N Y Acad Sci,2012,1266:94-106.
[3]Yoshida T,Stern PH.How vitamin D works on bone[J].Endocrinol Metab Clin North Am,2012,41(3):557-569.
[4]Boyan BD,Chen J,Schwartz Z.Mechanism of Pdia3-dependent 1α,25-dihydroxy vitamin D3 signaling in musculoskeletal cells[J].Ste⁃roids,2012,77(10):892-896.
[5]Gilbert RP,Guyenne P,Liu Y.Modeling of the kinetics of vitamin D3 in osteoblastic cells[J].Math Biosci Eng,2013,10(2):319-344.
[6]Tang QQ,Lane MD.Adipogenesis:from stem cell to adipocyte[J].Cold Sprin Harb Perspect BiolAnnu Rev Biochem,2012,81(1):715-736.
[7]Kadowaki T,Yamauchi T,Waki H,et al.Adiponectin,adiponectin re⁃ceptors,and epigenetic regulation of adipogenesis[J].Cold Spring Harb Symp Quant Biol,2011,76:257-265.
[8]Astapova O,Leff T.Adiponectin and PPARγ:cooperative and inter⁃dependent actions of two key regulators of metabolism[J].Vitam Horm,2012,90(1):143-162.
[9]Zhang C.Molecular mechanisms of osteoblast-specific transcription factor Osterix effect on bone formation[J].Beijing Da Xue Xue Bao,2012,44(5):659-665.
[10]李萍华,刘钰瑜,崔燎.骨髓间充质干细胞成脂和成骨过程中wnt信号通路的调控[J].中国组织工程研究与临床康复,2010,14(10):1749-1754.
[11]Chirstodoulides C,Lagalth UC,Sethi JK,et al.Adipogenesis and WNT singalling[J].Trends Endocrinal Metab,2009,20(1):16-24.
