17-AAG对MCF-7细胞增殖的抑制作用及对STAT3和VEGF表达的影响
2013-12-03肖丽君赵恩宏赵爽高艺铭郭璐许倩
肖丽君,赵恩宏,赵爽,高艺铭,郭璐,许倩
(承德医学院1.免疫教研室;2.附属医院肿瘤外科;3.基础医学研究所,河北 承德06 7020)
乳腺癌的发病率和死亡率逐年升高,侵袭和转移是乳腺癌患者死亡的主要原因。热休克蛋白90(heat shock protein 90,HSP90)可与乳腺癌细胞中的多种信号分子和激酶结合形成复合物,参与调控乳腺癌的侵袭和转移[1]。17-烯丙胺-17-脱甲氧格尔德霉素(17-allylamino-17-desmethoxy-geldanamycin,17-AAG)可强烈抑制HSP90,从而通过降解客户蛋白、诱导肿瘤凋亡、干扰细胞周期等抑制肿瘤细胞的生长、侵袭和转移。研究表明,17-AAG抗乳腺癌作用显著[2]。本研究拟观察17-AAG对乳腺癌MCF-7细胞增殖的抑制作用及对细胞信号转导和转录活化蛋白3(signal transducer and activator of transcriptions3,STAT3)和血管内皮生长因子(vascular endothelial growth factor,VEGF)mRNA 和蛋白表达的影响,旨在为17-AAG抗乳腺癌作用探寻新的作用靶点。
1 材料与方法
1.1 材料
1.1.1 细胞及试剂:人乳腺癌MCF-7细胞株由承德医学院附属医院中心实验室馈赠。DMEM培养基(美国GIBCO BRL公司);胎牛血清(浙江天杭生物科技有限公司);MTT(美国Peprotech公司);Trizol总RNA提取试剂(美国Invitrogen公司);RT-PCR(AMV)试剂盒(日本TaKaRa公司);引物及内参(上海生物工程技术有限公司);溴化乙锭(美国GIBCO BRL公司);STAT3单克隆抗体(美国Epitmics公司);VEGF、β-actin单克隆抗体(美国 Santa Cruz公司);辣根酶标记羊抗兔和羊抗鼠IgG(美国KPL公司);ECL超敏发光液(北京普利莱基因技术有限公司)。
1.1.2 仪器:090-135.001倒置显微镜(德国Leica公司);Sorvall/Biofuge fresco高速冷冻离心机、150培养箱(德国Heraeus公司);MK3酶标仪(芬兰雷勃公司);Icycler PCR仪(美国Bio-Rad公司);96孔、6孔细胞培养板(美国Corning公司)。
1.2 方法
1.2.1 细胞培养:用含10%胎牛血清的DMEM培养基(添加1 mmol/L丙酮酸钠,2 mmol/L谷氨酰胺,100 U/L青霉素及链霉素)于37℃、5%CO2培养箱中培养MCF-7细胞,每3 d换液1次,并传代培养,培养细胞至对数生长期。
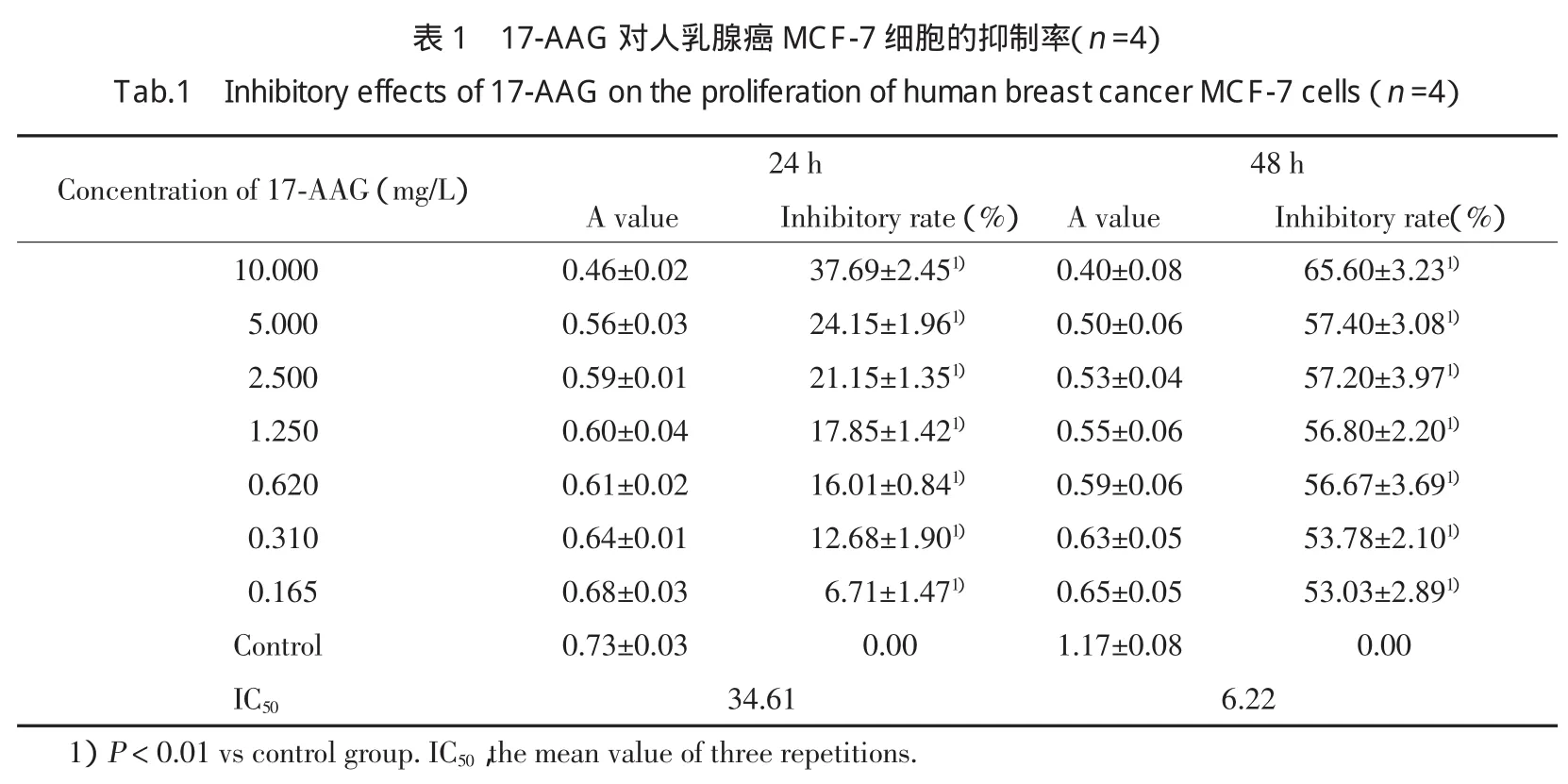
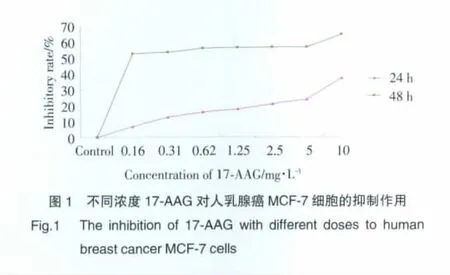
1.2.2 MTT法测定细胞增殖情况:取对数生长期细胞,0.25%胰酶消化,制成单细胞悬液。计数,离心,调整细胞浓度为5×104/mL。加入96孔板(190μL/孔),37℃、5%CO2培养箱中培养24 h。向实验组细胞加入17-AAG(终浓度:0.165、0.310、0.620、1.250、2.500、5.000、10.000 mg/L),每个浓度设5 个复孔,同时设立对照组(不加药)和空白对照组(不加细胞及培养液)。培养24h及48h后,加入MTT(5g/L,10μL/孔)。培养4 h后,弃上层培养液,加入二甲基亚砜150 μL/孔,震荡10 min,待蓝色结晶完全溶解后,在酶标仪492、540、650 nm波长处检测各孔OD值。计算17-AAG对肿瘤细胞的生长抑制率=(1-OD实验组/OD对照组)×100%,做图获得剂量反应曲线,计算半数抑制浓度(IC50)。
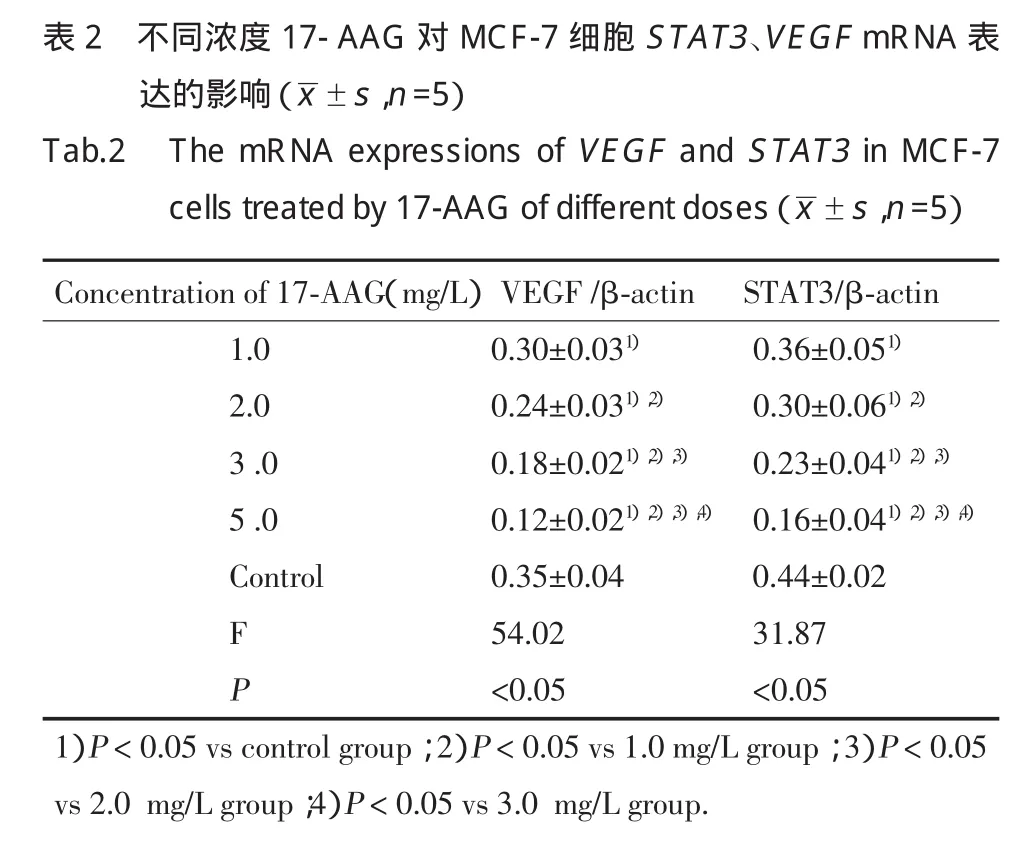
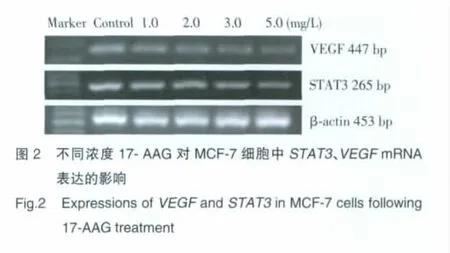
1.2.3 RT-PCR检测17-AAG作用后人乳腺癌MCF-7细胞株STAT3、VEGFmRNA的表达:取对数生长期细胞,0.25%胰酶消化,制成单细胞悬液,调整细胞浓度为5×104/mL,加入6孔板(3 mL/孔),37℃、5%CO2培养箱中培养48 h后,加入17-AAG(终浓度:1.0、2.0、3.0、5.0 mg/L),每个浓度设5 个复孔,同时设立对照组(不加药组)。终止培养后,每孔加入500 μL Trizol提取液提取细胞总RNA,参照RTPCR试剂盒说明书进行操作,STAT3基因引物:上游:AGCGGGAAATCGTGCGTGAC,下游:ACATCTG CTGGAAGGTGGAC,扩增产物447 bp;VEGF基因引物:上游:ATCACGAAGTGGTGAAGTTC,下游:TGCTGTAGGAAGCTCATCTC,扩增产物265 bp;内参照β-actin基因引物:上游:AGCGGGAAATCGTG CGTGAC,下游:ACATCTGCTGGAAGGTGGAC,扩增产物453 bp。cDNA合成反应条件:30℃10 min,42℃30 min,99 ℃5 min,5 ℃5min;PCR 扩增反应条件:STAT3:94 ℃2min,94 ℃30 s,58 ℃30s,72 ℃ 45 s,28 个循环;VEGF:94 ℃2min,94 ℃30 s,62 ℃30 s,72 ℃ 45 s,28 个循环;β-actin:94 ℃2min,94 ℃30s,58℃30 s,72℃1min,28个循环。取 PCR 产物行2%琼脂糖凝胶电泳(120 V,30 min),拍照观察。用Quantity One软件进行图像灰度分析。每组实验至少重复5次,计算目的基因与内参照β-actin灰度比值。
1.2.4 Western blot检测STAT3、VEGF蛋白的表达:取对数生长期细胞,0.25%胰酶消化,调整细胞浓度为5×104/mL,加入6孔板(3 mL/孔),37℃、5%CO2培养箱中培养48 h后,加入17-AAG(终浓度:1.0、2.0、3.0、5.0 mg/L),每个浓度设5 个复孔,同时设立对照组(不加药)。48 h后终止培养,PBS洗细胞2次,加入预冷的细胞裂解液,冰上裂解20 min,4℃、12000 r/min离心20 min,收集上清,蛋白定量。取50 μg蛋白行8%SDS-聚丙烯酰胺凝胶电泳,转膜,含5%脱脂奶粉TBS-T溶液封闭,室温下与兔抗人STAT3、VEGF单克隆抗体(1︰300稀释)孵育,再与相应的HR-PO抗Ig抗体耦联物(1︰2000稀释)孵育,以上各步骤间用TBS-T洗膜。ECL显影,洗片。以β-actin(1︰100稀释)作内参照。用Quantity one分析软件测定图像条带灰度值,计算STAT3与VEGF的相对含量(STAT3、VEGF蛋白条带灰度值/内参照β-actin蛋白条带灰度值)。
1.3 统计学分析
2 结果
2.1 17-AAG对MCF-7细胞增殖的影响
MTT结果显示:0.165~10.000 mg/L17-AAG对乳腺癌MCF-7细胞有显著的抑制作用,且有明显的量效关系;体外作用48 h细胞增殖抑制率(IC50均值6.22)优于24 h(IC50均值34.61)。见表1,图1。
2.2 不同浓度17-AAG对MCF-7细胞STAT3、VEGFmRNA表达的影响
RT-PCR结果显示:17-AAG作用48 h后,实验组MCF-7细胞中STAT3、VEGFmRNA的表达水平降低,呈浓度依赖性。实验组与对照组、各实验组之间比较,差异均有统计学意义(P<0.05)。见表2,图2。
2.3 不同浓度17-AAG对MCF-7细胞STAT3、VEGF蛋白表达的影响
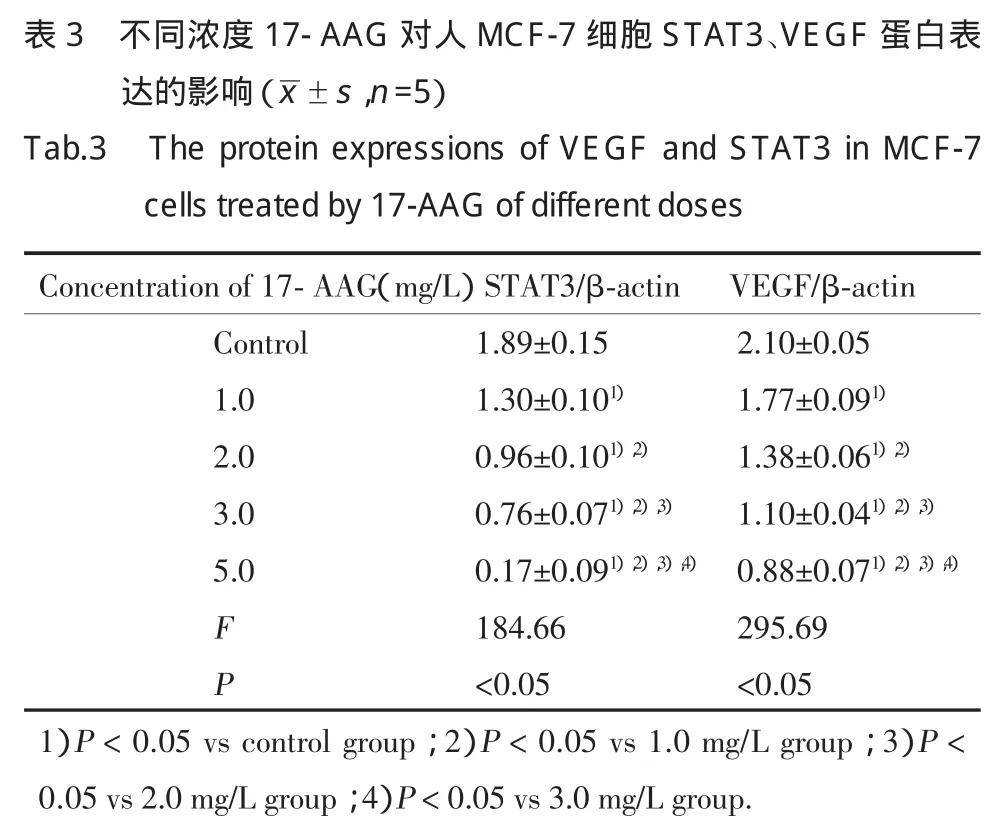
Western blot 结果显 示:1.0、2.0、3.0、5.0 mg/L17-AAG作用48 h后,各实验组细胞STAT3、VEGF蛋白的表达量逐渐降低,呈浓度依赖性。实验组与对照组、各实验组之间两两比较,差异均有统计学意义(P<0.05)。见表3,图3。
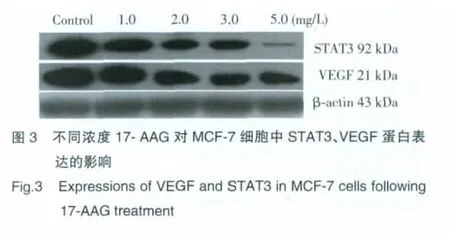
3 讨论
目前已证实STAT3在多种人类恶性肿瘤组织及细胞系中存在高表达[3,4]。研究表明,当 STAT3 发生持续性激活时,一系列与细胞增殖、分化、凋亡等密切相关的基因出现异常的高表达,细胞向恶性转化[5]。STAT3可能是1种癌基因,它参与的信号转导途径异常可能在肿瘤的侵袭、转移中起重要作用[6]。STAT3可通过调节多种激酶作用,破坏E-钙黏着蛋白/b-链蛋白复合物,使b-链蛋白的酪氨酸磷酸化后从细胞膜释放,使细胞间黏附能力下降,肿瘤细胞更易于脱离原发灶,从而促进肿瘤转移[7]。
肿瘤细胞侵袭转移到邻近组织及远处器官是1个多步骤的复杂的过程。肿瘤血管新生是肿瘤浸润转移必不可少的环节。VEGF是一种参与机体血管生成的细胞因子,也是迄今研究最多且最深入的肿瘤新生血管标志分子。它的启动子位于-38 bp到-2274 bp,具有低氧诱导因子1、激活蛋白、早期生长应答因子l及STAT-3等多个因子的结合位点。VEGF的表达受诸多因素的调控,最近的研究表明,STAT3能直接调控VEGF的转录[8],持续激活STAT3能诱导VEGF的表达,导致肿瘤新生血管形成;用STAT3的显性负性突变体或反义寡核苷酸阻断STAT3信号通路能抑制由Src和IL-6介导的VEGF的表达上调,从而抑制肿瘤的生长与侵袭转移。阻断STAT3的激活能抑制内皮细胞的迁移及微血管的形成[6]。提示VEGF/STAT3信号通路的激活可能是促进肿瘤新生血管形成的关键因素之一。
17-AAG是HSP90的抑制剂,可通过与HSP90特异性结合降解其客户蛋白而发挥抗肿瘤作用。17-AAG的抗肿瘤(如乳腺癌、黑色素瘤等)研究已进入Ⅱ期临床试验[2,9]。17-AAG在抗侵袭和抗肿瘤血管新生方面的确切机制尚缺乏深入研究。Cheong等[10]报道,异泽兰黄素可以通过阻断胃癌MKN-45细胞的STAT3通路而抑制VEGF表达。本研究结果显示:1.0、2.0、3.0 及5.0 mg/L17-AAG 作用人乳腺癌MCF-7细胞株12、24、48 h后,细胞内 STAT3和VEGFmRNA及蛋白表达均下调,且具有时间和浓度依赖性,尤其对STAT3的下调作用显著。提示17-AAG可能通过阻断STAT3通路而下调VEGF的表达,进而产生抗肿瘤血管新生作用。未来我们将对STAT3通路的上游或下游是否还存在其他直接或间接调控VEGF表达的因子进行进一步深入的研究。
[1]Zagouri F,Sergentanis TN,Gazouli M,et al.HSP90,HSPA8,HIF-1 alpha and HSP70-2 polymorphisms in breast cancer:a case-control study[J].Mol Biol Rep,2012,39(12):10873-10879.
[2]Modi S,Stopeck A,Linden H,et al.HSP90 inhibition is effective in breast cancer:a phase II trial of tanespimycin (17-AAG) plus trastuzumab in patients with HER2-positive metastatic breast cancer progressing on trastuzumab [J].Clin Cancer Res,2011,17(15):5132-5139.
[3]Lui VW,Wong EY,Ho Y,et al.STAT3 activation contributes directly to Epstein-Barr virus-mediated invasiveness of nasopharyngeal cancer cells in vitro[J].Int J Cancer,2009,125(8):1884-1893.
[4] Kunigal S,Lakka SS,Sodadasu PK,et al.Star3-siRNA induces Fasmediated apoptosis in vitro and in vivo in breast cancer[J].Int J Oncol,2009,34(5):1209-1220.
[5]Sen B,Saigal B,Parikh N,et al.Sustained are inhibition results in signal transducer and activator of transcription3(STAT3)activation and cancer cell survival via altered Janus.activated kinase-STAT3 binding[J].Cancer Res,2009,69(5):1958-1965.
[6]Page BD,Ball DP,Gunning PT.Signal transducer and activator of transcription3 inhibitors:a patent review[J].Expert Opin Ther Pat,2011,21(1):65-83.
[7] Rivat C,Rodrigues S,Bruyneel E,et al.Implication of STAT3 signaling in human colonic cancer cells during intestinal trefoil factor3 (TFF3)and vascular endothelial growth factor-mediated cellular invasion and tumor growth[J].Cancer Res,2005,65(1):195-202.
[8]CascioS,FerlaRD,AndreaA,etal.Expressionofangiogenic regulators,VEGF and leptin,is regulated by the EGF/PI3 K/STAT3 pathway in colorectal cancer cells[J].J Cell Physiol,2009,221(1):189-194.
[9]Pacey S,Gore M,Chao D,et al.A Phase II trial of17-allylamino,17-demethoxygeldanamycin (17-AAG,tanespimycin)in patients with metastatic melanoma[J].Invest New Drugs,2012,30(1):341-349.
[10]Cheong JH,Hong SY,Zheng Y,et al.Eupatilin inhibits gastric cancer cell growth by blocking STAT3-mediated VEGF expression[J].J Gastric Cancer,2011,11(1):16-22.
