观察三氯六氨络合钴对DNA凝聚的影响
2013-12-01陈文娟何林李程顺华杨光参王艳伟
陈文娟,何林李,程顺华,杨光参,王艳伟
(温州大学 物理与电子信息工程学院,浙江 温州325035)
1 引 言
动态光散射技术(Dynamic light scattering,DLS)是一种建立在颗粒动力学信息与其发出的散射光的涨落关系上的方法,能有效测量亚微米和纳米级颗粒粒度[1].自从Cummins等人在1964年首次成功将DLS应用于实验研究中后,人们陆续将目光投注在DLS上,DLS技术得到不断补充完善并发展为成熟的测量技术.在当前现有的颗粒粒度检测技术中,DLS技术具有准确、快速、可重复性好、检测时间短、成本低、对样品量要求很小等优点,被广泛应用于颗粒测量、生物工程、药物学以及微生物等领域,尤其在高分子与生物大分子的溶液特性、分子内部运动状态及生物大分子的凝聚等领域显示了广泛的应用前景[2-4].
原子力显微镜(AFM)克服了扫描隧道显微镜(STM)对样品要求的限制,扩大了应用范围[5].AFM利用微悬臂上的探针做力传感器,针尖与样品之间作用力的变化使悬臂震动,导致射到悬臂上面的激光的反射光发生偏转,探测器将偏转量记录下转化成电信号,在控制器做信号处理转换成样品形貌图像,AFM在各研究领域特别是生物大分子(DNA、蛋白)及特性(DNA凝聚等)研究中得到广泛应用.
DNA凝聚是1个或者几个DNA分子由自由伸展状态坍缩到更加紧凑的有序结构的过程.导致DNA凝聚的凝聚剂有很多,比如三价或者更高价的离子、阳离子多肽、组蛋白、乙醇等[6].DNA凝聚在DNA包装成染色质的过程有很广泛的生物应用性,是基因传输与转录中重要的运输工具[7-9].一般认为,多价离子导致DNA凝聚的凝聚机制是多价离子中和了DNA磷酸根的负电荷,从而使DNA片段的排斥力减小,静电吸引力增强,引起DNA链的坍缩,从而形成更加紧凑的结构.物理学家研究DNA性质及DNA与凝聚剂的作用机制的的重要研究手段有DLS技术[10]及 AFM 技术[11]等,通过测量其凝聚后粒径的大小及凝聚的形态变化来分析凝聚剂与DNA的相互作用机制及凝聚过程的粒径分布模式等.
我们在近现代物理实验教学中用DLS及AFM技术测量DNA与凝聚剂相互作用后粒径大小及凝聚过程形态变化和分布模式等为设计内容,开设了综合设计型研究前沿实验,实验中所用样品,可由学生自己动手准备,这不但有助于学生熟悉、掌握基础的样品准备方法,还能更好地掌握DLS及AFM技术的基本原理和应用.
2 实验原理
2.1 DLS的实验原理
DLS是测量光强随时间起伏变化规律的手段,如果纳米粒子在溶液中处于无规则的布朗运动,这种无规则的运动使散射光强度在时间上表现为平均光强附近的随机涨落,它是由各个散射粒子发出的散射光场相干叠加而成的.悬浮液中的颗粒由于受到了周围做布朗运动分子的不断撞击,而不停地进行随机运动,在激光的照射下,运动颗粒的散射光强也将产生随机的波动,而且波动的频率与颗粒的大小有关,在一定角度下,颗粒越小,涨落越快.通过计算涨落变化的时域自相关函数,就可以得到影响变化的颗粒粒径信息.因此,DLS法也称为光子相关光谱法[12].
当一束单色平行光照射溶液样品时,遇到做布朗运动的球形粒子,产生散射光,散射光强随时间涨落,颗粒运动的速度越快,散射光强变化就越快,光强的自相关函数为
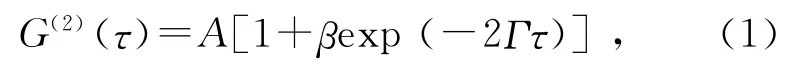
其中,A 为光强自相关函数G(2)(τ)的基线,β为约束信噪比常量,A和β都与实验条件有关,Γ为瑞利线宽.除了布朗运动能够导致散射光强随时间涨落外,其他如环境等因素也能够影响颗粒散射光强的涨落.在存在布朗运动为唯一因素时,

式中,D为颗粒的平移扩散系数,q为散射光波矢的幅值,q=sin,其中n为溶剂折射率,θ为散射角,λ0为入射光在真空中波长.如果样品颗粒为球形,则根据Stokes-Einstein理论可以得到D的计算公式为

其中kB为玻尔兹量常量,T为绝为温度,η为溶液黏度,d为粒子直径.通过(3)式可以计算出被测样品颗粒的粒径.
2.2 AFM的实验原理
在AFM的系统中,使用微小悬臂来感测针尖与样品之间的相互作用,此作用力会使微悬臂摆动,当摆动形成时,会使照在悬臂末端的激光的反射光位置改变而造成偏移量,激光检测器会记录此偏移量,也会把此时的信号传给反馈系统,以利于系统做适当的调整,最后再将样品的表面特性以影像的方式呈现[13].
原子力显微镜与样品间的相互作用以范德华力为主,其作用势能一般用Lennard-Jones势能函数表示:
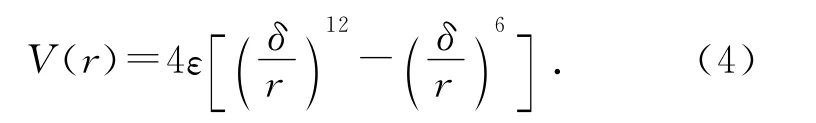
式中,r是两原子的核间距,δ是势能为0时原子核间距,ε是势阱深度,是势能曲线上最低点势能的绝对值.当悬臂尖端的原子与样品靠近,开始时吸引力起主导作用,随着距离的减小,二者之间的吸引力与排斥力将趋于平衡,当两原子进一步靠近时,范德华力以斥力为主.
3 实验材料与方法
3.1 DLS实验的材料与方法
实验选用的λ-DNA购于New England Biolabs公司,原始浓度为500mg/L,保存液为1×TE缓冲液(10mmol/L Tris-HCl和 1mmol/L EDTA,pH=8.0).用于配置样品的超纯水是由美国Millipore公司超纯水系统处理生产的.凝聚剂三氯六氨络合钴购买于Sigma公司,使用时用超纯水稀释,最终浓度分别为1,2.5,5,7.5,10,15μmol/L.最后样品中λ-DNA 的最终浓度为1mg/L.
DLS实验使用的仪器为英国马尔文的Zetasizer Nano-ZS90.由 He-Ne激光器(波长为632.8nm)发出的光入射到装有DNA与钴离子混合溶液的矩形高纯度石英样品池,在散射角为90°的方向用探测器接收散射光,散射光经信号数字相关器处理后最终被送到计算机进行数据分析和计算.实验条件:样品室内温度25℃,溶剂水的折射率n=1.330,水的黏度η=0.887 2mPa·s.样品采样持续时间为300s.实验结果用给定的软件Zetasizer Nano-ZS90software输出.
3.2 AFM实验的材料与方法
λ-DNA及超纯水的来源同上,λ-DNA的最终浓度也为1mg/L.云母片切割成边长为1cm的正方形,用双面胶粘在圆形铁片上,利用其作为衬底制备样品.凝聚剂三氯六氨络合钴用超纯水稀释,最终浓度分别为30,60,100,150μmol/L.AFM型号为岛津公司的SPM-9600,探针购买自Nanoworld,悬臂弹性系数为42N/m,共振频率为320kHz.模式采用气态的轻敲模式,图像采集的扫描频率为2Hz,像素为512×512.图片使用时经过平滑去噪处理以提高对比度.
实验过程首先用超纯水把钴离子稀释到预计浓度,混合均匀后加入DNA,使DNA的最终浓度为1mg/L.用移液器取约15μL稀释的DNA溶液,滴在新解理的云母片上面,沉积3min,然后用约200μL纯水冲洗,氮气吹干,放入干燥器2h以上,待扫描.
4 结果与讨论
4.1 DLS的实验结果与讨论
在DLS实验过程中通过改变样品的培育时间与Co(NH3)3+6的浓度来观察DNA与多价离子相互作用后粒径的改变情况.由于多价离子能够使DNA发生凝聚,所以混合后的粒径就会变小,具体的实验结果通过给定的软件输出,直接给出样品的半径,相关的实验结果如表1所示,其中每个粒径(半径)为5次测量的平均值,每次测量值都是仪器显示的统计平均的最终结果,分析模式采用单峰的分析模式,而且有一定的峰宽.所有数据的测量不确定度为±3nm.

表1 粒径测量数据
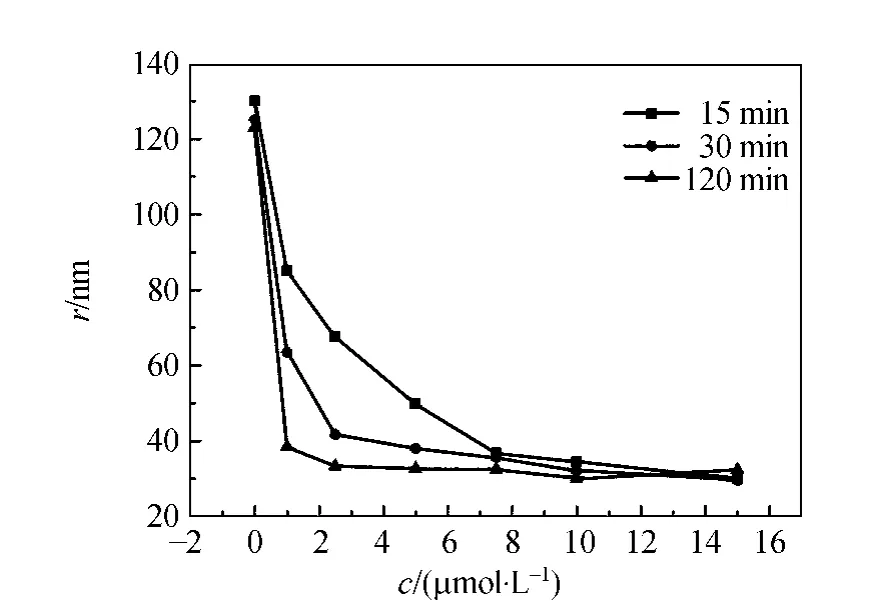
图1 不同样品培育时间的Co(NH3)3+6粒径-浓度曲线

图2 不同Co(NH3)3+6 浓度的粒径-培育时间曲线
由图1可以看出培育时间为15min时,增大Co(NH3)3+6浓度,测得的λ-DNA粒径会慢慢减小,然后趋于稳定.再进一步增加培育时间为30min时,λ-DNA 的粒径随着 Co(NH3)3+6浓度的增加会相对较快地趋于稳定.当培育时间为120min时,随着Co(NH3)3+6浓度的增加,λ-DNA的粒径几乎不会发生太大改变,而是与Co(NH3)3+6浓度很小时的粒径相似,只有很小的变化.通过3条曲线对比可知,培育时间120min后,DNA几乎处于凝聚状态,粒径已经变化不大.由图1的结果可知Co(NH3)3+6导致的DNA凝聚过程需要一定的反应时间,作用过程中Co(NH3)3+6逐渐与DNA磷酸基上的负电荷进行中和,这个过程并不是极短时间内完成的.所以样品培育时间越长,DNA链上负电荷被中和越多,DNA凝聚就越严重,当培育时间达120min时,DNA在很低的Co(NH3)3+6浓度下,就会处于凝聚状态,所以DNA的粒径随着培育时间的再增加不会发生大改变.而且在粒径的分析时采用单峰的分布模式进行处理,即认为在同一个多价离子浓度下,如果样品混合均匀、操作正确,所有DNA从自由舒展构象到凝聚构象变化中处于同一过程,当然有个别情况构象不相同,这就要考虑单峰分布模式有一定峰宽.实验中取单峰分布情况的数据,最后统计平均最终粒径结果.
从图2中可以看出,Co(NH3)3+6浓度低于7.5μmol/L时,不同培育时间测得的λ-DNA粒径相差较大,DNA粒径随着培育时间的增加而慢慢减小,在培育60min后,都会慢慢趋于稳定.当Co(NH3)3+6浓度提升到大于等于7.5μmol/L时,不同培育时间的λ-DNA粒径的差距较小,曲线开始靠近,DNA粒径相差不大,在培育时间很短的情况下粒径就几乎达到33nm.可见培育时间作为影响λ-DNA凝聚的一个因素外,凝聚剂的浓度也是影响DNA凝聚的重要因素.高浓度的凝聚剂能够促使磷酸基上的负电荷更快地被中和,所以达到稳定的最小粒径需要更少时间.
4.2 AFM的实验结果与讨论
在AFM实验中,取了培育时间为30min的4个钴离子浓度进行实验,直接观察多价离子与DNA作用后凝聚形态的变化情况,如图3所示,可见钴离子导致DNA凝聚的最终形态一般是花一样的构象.
由图3可以看出:随着钴离子浓度的增加,DNA的凝聚越来越严重.此部分实验与DLS比较导致DNA凝聚的钴离子浓度要偏大,因为在AFM实验中云母表面带负电也会中和多价离子,所以多价离子必须一部分被吸附在云母表面,其余部分才用来凝聚DNA,那么导致DNA凝聚的离子浓度就要更大才有效果.而且用AFM的实验结果进一步证明DLS中粒径的分析采用单峰的分布模式是正确的,也就是说DNA从松散构象到凝聚构象转化过程中一般所有的DNA都处于同一形态,如图3所示.也有个别情况构象不同,如图3(a),可以看见没有凝聚的自由舒展的DNA,原因可能是操作过程中水冲或者氮气吹所导致,但是基本构象不会相差很大,即单峰的分析模式还是要考虑一定的峰宽,前面的DLS实验结果就是采用单峰分析模式的最终统计平均结果,一般样品分布均匀,操作规范,不会出现同一凝聚剂浓度下一部分处于全松散,一部分处于高度凝聚状态的情况.
在多价阳离子与DNA作用的过程中,Co(NH3)3+6只有在中和DNA磷酸骨架负电荷达到89%以上才能引起DNA凝聚.实验数据说明该过程受凝聚剂浓度和样品培育时间等因素的影响,结果用DLS技术得到充分的证明.多价离子导致的DNA凝聚过程是快速而且同步的过程,即结构的转变是在同一时间、同一浓度下基本一致.AFM的图像直观地显示出这一现象.当然使用DLS及AFM技术进行粒度测量和形态的测量时不可避免地受到噪声影响,最终测得的颗粒粒径和形态都存在一定的噪声误差.如样品池的使用,样品的均匀混合度、环境温度的控制和仪器的事先预热及实验的操作等都不可避免地引起实验的误差,在实验过程中都要引起注意.

图3 不同Co(NH3)3+6浓度下DNA凝聚的AFM图像
5 结束语
用DLS及AFM技术探究Co(NH3)3+6诱导DNA凝聚过程中粒径变化和凝聚形态变化,实验结果表明影响DNA凝聚的因素有样品的培育时间和凝聚剂的浓度等.该方法在医学、海洋生物学、物理、化学等科学研究领域已得到深入应用.将该实验引入近代物理实验教学中,可以提高学生的动手能力和综合分析能力,同时有助于拓宽学生的知识层面,提升学生对物理学和生物学交汇领域的认知.
[1]杨晖,郑刚,王雅静.用动态光散射现代技术谱估计法测量纳米颗粒[J].光学 精密工程,2010,18(9):1996-2001.
[2]郭永彩,杨阳,高潮,等.动态光散射在烟气颗粒粒径分析中的应用[J].光电工程,2008,35(8):78-82.
[3]刘桂强,杨冠玲,何振江,等.动态光散射光在颗粒检测中的应用[J].中国粉体技术,2005,11(3):19-25.
[4]张华东,娄本浊.动态光散射实验中散射光偏振状态的研究[J].光散射学报,2008,20(3):218-222.
[5]Binnig G,Quate C,Gerber C.Atomic force micro-scope[J].Physical Review Letters,1986,56(9):930-933.
[6]Bloomfield V A.DNA condensation[J].Current Opinion in Structural Biology,1996,6(3):334-341.
[7]Pelta J,Durand D,Doucet J,et al.DNA mesophases induced by spermidine:structural properties and biological implications[J].Biophysical Journal,1996,71(1):48-63.
[8]Raspaud E,Durand D,Livolant F.Interhelical spacing in liquid crystalline spermine and spermidine-DNA precipitates[J].Biophysical Journal,2005,88(1):392-403.
[9]Hud N V,Vilfan I D.Toroidal DNA condensates:unraveling the fine structure and the role of nucleation in determining size[J].Annual Review of Biophysics and Biomolecular Structure,2005,34:295-318.
[10]Besteman K,Van Eijk K,Lemay S G.Charge inversion accompanies DNA condensation by multivalent ions[J].Nature Physics,2007,3:641-644.
[11]Danielsen S,Vårum K M,Stokke B T.Structural analysis of chitosan mediated DNA condensation by AFM:influence of chitosan molecular parameters[J].Biomacromolecules,2004,5(3):928-936.
[12]尚玉峰,蒋达娅,肖井华,等.动态光散射实验[J].物理实验,2004,24(10):9-11.
[13]冉诗勇,王艳伟,杨光参.原子力显微镜扫描成像DNA分子[J].物理实验,2011,31(11):1-4.
