高碳水化合物条件下鼠肌GLUT4表达与CaMK/HDAC5关系的研究
2013-11-30刘建武万家川李良刚
刘建武,万家川,李良刚
(成都体育学院 运动医学系,成都 610041)
高碳水化合物条件下鼠肌GLUT4表达与CaMK/HDAC5关系的研究
刘建武,万家川,李良刚*
(成都体育学院 运动医学系,成都 610041)
观察Caffeine诱导骨骼肌细胞GLUT4表达的潜在分子调控机制是否是Caffeine-Ca2+-CaMKⅡ-HDAC5信号通路。8周龄雄性Wistar大鼠42只,随机分为高碳Caffeine组(HGC)、高碳KN62组(HGK)、低碳Caffeine组(LGC)和低碳KN62组(LGK),每组12只。分别给予不同饮食加Caffeine或KN62刺激。检测CaMKⅡ(Thr286)位点、HDAC5(Ser498)位点和HDAC5(Ser259)位点磷酸化水平以及GLUT4蛋白表达水平。与HGC组相比LGC组GLUT4蛋白表达、CaMKⅡ(Thr286) 、HDAC5(Ser498)HDAC5(Ser259)磷酸化水平都显著增加性高于HGC组和LGK组。无论是在低碳还是在高碳浓度下骨骼肌细胞GLUT4蛋白表达变化都对应着上游CaMKⅡ蛋白位点(Thr286)磷酸化水平和下游HDAC5蛋白位点(Ser498)和(Ser259)磷酸化的变化,所以CaMKⅡ调节GLUT4表达的机制至少涉及到CaMKⅡ征用转录抑制子HDAC5。
葡萄糖转运蛋白4;钙调蛋白依赖性蛋白激酶;组蛋白去乙酰化酶5
糖尿病目前被认为是威胁人类健康的重大疾病之一。胰岛素抵抗(IR)是糖尿病发病的重要机制,特别是Ⅱ型糖尿病。胰岛素抵抗的关键影响部位在骨骼肌。葡萄糖是一个极性分子,不能自由地穿梭细胞膜的磷脂双分子层结构,需要葡萄糖转运蛋白(Glucose Transporter, GLUT)的转运才能进入细胞,所以葡萄糖转运蛋白4(GLUT4)蛋白表达水平在很大程度上限制了骨骼肌摄取葡萄糖的速率,骨骼肌内仅因过量表达GLUT4就能够全面改善和逆转糖尿病鼠胰岛素抵抗的各项症状。因此研究GLUT4蛋白表达机制具有重要意义。高碳浓度会减弱骨骼肌细胞内GLUT4的表达,而低碳能加强它的表达。利用此特征我们通过高碳饮食诱导Wistar大鼠骨骼肌形成胰岛素抵抗模型,而低碳和禁食能够获得Wistar大鼠骨骼肌形成胰岛素敏感模型。并给予Ca2+特殊激动剂Caffeine和CaMK特殊抑制剂KN62刺激,观察在高/低碳浓度下骨骼肌细胞内GLUT4的表达变化是否发生骨骼肌细胞内CaMKⅡ(Thr286)位点、HDAC5(Ser498)和HDAC5(Ser259)位点磷酸化水平的对应变化。进一步探讨和GLUT4表达可能分子机制,为开发新型表观遗传学分子靶点药物以及提高运动能力提供理论依据。
1 材料和方法
1.1 实验动物
雄性Wistar大鼠48只,8周龄,体重(180±24.2) g,由四川大学华西医学中心实验动物中心提供。标准啮齿目动物分笼喂养,鼠粮由四川大学华西医学中心实验动物服务站提供。保证通风条件良好,室温控制在28~31 ℃,相对湿度40%~60%,自然光照。
1.2 实验试剂和器材
GLUT4抗体购于 Abcam、HDAC5(Ser498)和HDAC5(Ser259)抗体购于北京博奥森,CAMKⅡ(Thr286)抗体购于宜百康生物科技股份有限公司,辣根标记羊抗鼠和羊抗兔IgG、GADPH购于北京中杉,化学显色剂购于Santa cruz biotechnology,Caffeine 购于 Enzo Life Sciences,DMSO 购于Sigma,KN62 购于 Cayman Chemical,BCA蛋白定量试剂盒购自Pierce公司,磷酸化蛋白、全蛋白提取试剂盒由南京凯基生物科技发展有限公司提供。
1.3 研究方法
1.3.1 实验设计
所有大鼠适应性饲养期间均给予普通标准鼠粮和蒸馏数,适应性饲养后随机分为高碳Caffeine组(HGC)、高碳KN62组(HGK)、低碳Caffeine组(LGC)和低碳KN62组(LGK),每组12只。饮食干预前为排除大鼠体内本身糖原干扰,所有大鼠均给予一次5%负荷的负重力竭游泳刺激。负重力竭游泳刺激后高碳组均给予高碳食物和5%蔗糖水饮用水,72 h后高碳KN62组腹腔注射KN62(0.1 mg/kg,浓度为10 μmol/L,溶解于DMSO),KN62刺激30 min后再次腹腔注射Caffeine(5 mg/kg,4 mmol/L,溶解于DMSO)Caffeine刺激后分2 min、24 h 2个时间段断颈处死提取腓肠肌组织样本;高碳Caffeine组直接腹腔注射Caffeine,Caffeine刺激后分2 min、24 h 2个时间段断颈处死提取腓肠肌组织样本;低碳组负重力竭游泳刺激后给予低碳食物和蒸馏水48 h加禁止食24 h,低碳Caffeine组同样给予Caffeine刺激,低碳KN62组Caffeine刺激前30 min腹腔注射KN62,Caffeine刺激后分2 min、24 h 2个时间段各断颈处死6只提取腓肠肌组织样本。
1.3.2 蛋白提取与测定
磷酸化蛋白和全蛋白提取按照南京凯基生物科技发展有限公司的磷酸化蛋白和全蛋白提取试剂盒说明提取。磷酸化蛋白和全蛋白浓度均采用BCA法测定。
1.3.3 蛋白表达与磷酸化水平测定
采用western blotting检测蛋白表达。首先对蛋白样品进行变性处理。将蛋白样品和5*loading buffer 4∶1混匀,震荡,然后沸水中煮沸5~10 min即可完成变性处理。根据BCA测定的蛋白浓度,提前计算好上样量。实验结果采用Bio-rad image lab图像分析系统进行分析。
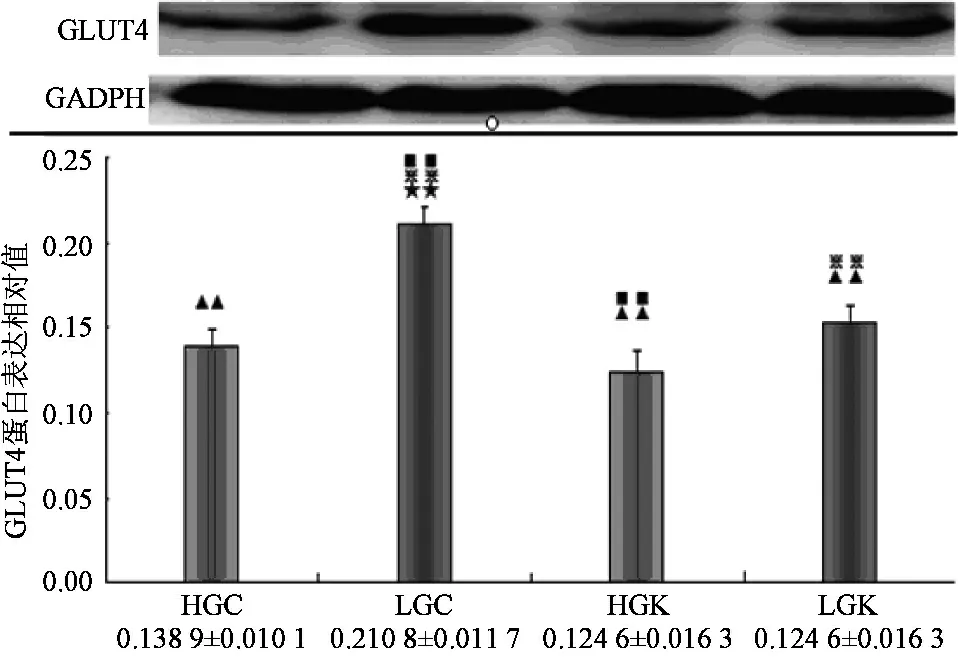
Compare to HGC,★:plt;0.05★★:plt;0.01;Compare to lGC,▲:plt;0.05▲▲:plt;0.01;Compare to HGk,※:plt;0.05※※:plt;0.01;Compare to lGk,■:plt;0.05■■:plt;0.01图1 GLUT4在各实验刺激下的蛋白表达
1.3.4 数理统计法
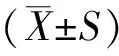
2 结果
2.1 GLUT4在各实验刺激下的蛋白表达
如图1所示,低碳Caffeine组较各组均存在显著性差异,证明低碳和Caffeine均可上调GLUT4的表达,而且两者效果上存在一定叠加。高碳Caffeine组(HGC)GLUT4蛋白表达水平显著性低于低碳Caffeine组(LGC)plt;0.01,较高碳KN62组(HGK)pgt;0.05无明显差异。表明高碳确实可延迟GLUT4的表达,其效果甚至可掩盖Caffeine对GLUT4表达的促进作用。高碳KN62组(HGK)GLUT4蛋白表达水平低于高碳Caffeine组(HGC),虽无显著性差异pgt;0.05;低碳KN62组(LGK)显著性低于低碳Caffeine组(LGC)plt;0.01。表明提前给予KN62刺激可下调GLUT4的表达。
2.2 CaMKⅡ(Thr286)在各实验刺激下蛋白表达
Compare to HGC,★:plt;0.05★★:plt;0.01;Compare to lGC,▲:plt;0.05▲▲:plt;0.01;Compare to HGk,※:plt;0.05※※:plt;0.01;Compare to lGk,■:plt;0.05■■:plt;0.01图2 CaMKⅡ(Thr286)在各实验刺激下蛋白表达
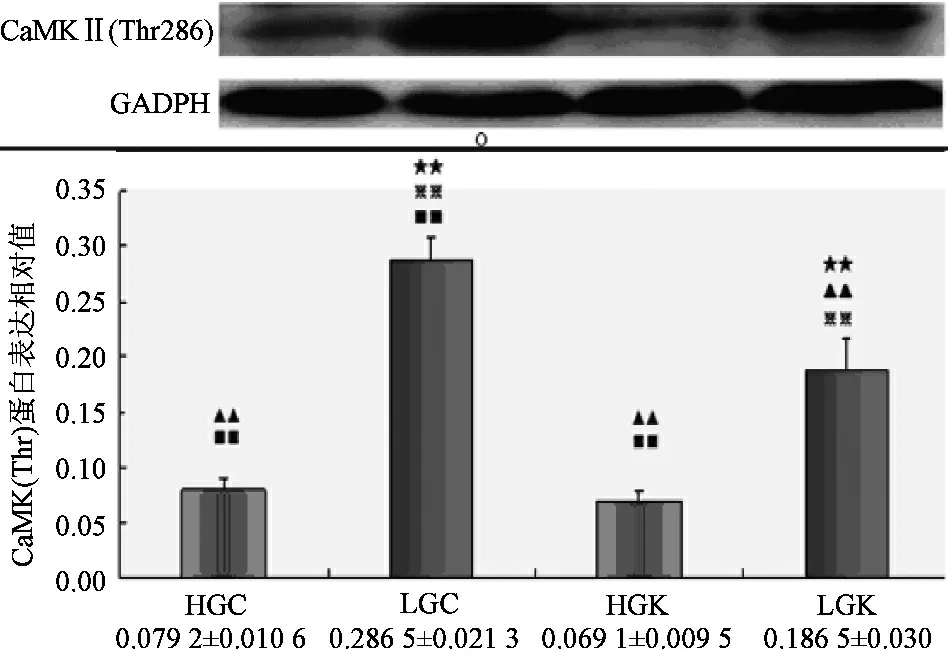
Compare to HGC,★:plt;0.05★★:plt;0.01;Compare to lGC,▲:plt;0.05▲▲:plt;0.01;Compare to HGk,※:plt;0.05※※:plt;0.01;Compare to lGk,■:plt;0.05■■:plt;0.01图3 HDAC5(Ser498)在各实验刺激下蛋白表达
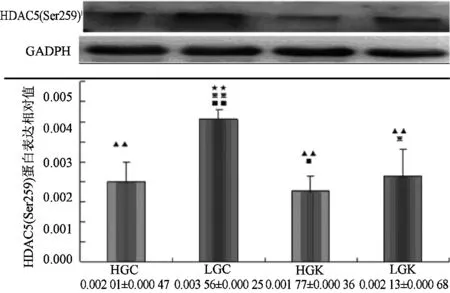
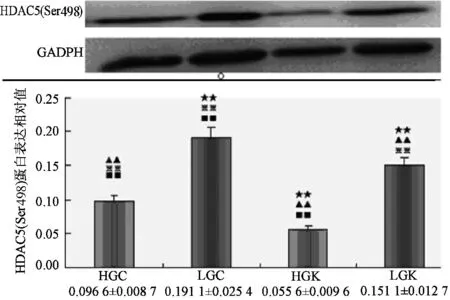
Compare to HGC,★:plt;0.05★★:plt;0.01;Compare to lGC,▲:plt;0.05▲▲:plt;0.01;Compare to HGk,※:plt;0.05※※:plt;0.01;Compare to lGk,■:plt;0.05■■:plt;0.01图4 HDAC5(Ser259)在各实验刺激下蛋白表达
如图2所示,低碳Caffeine组(LGC)较高碳Caffeine组(HGC)CaMKⅡ(Thr286)磷酸化水平上调2.62倍。低碳KN62组CaMKⅡ(Thr286)磷酸化水平是高碳Caffeine组(HGC)2.35倍。预示着高碳显著性抑制CaMKⅡ(Thr286)的磷酸化。低碳Caffeine组(LGC)较低碳KN62组上调0.536倍。高碳Caffeine组(HGC)和高碳KN62(HGK)CaMKⅡ(Thr286)磷酸化水平几乎相同,两者无显著性差异。表明低碳环境下Caffeine可激活CaMKⅡ(Thr286),而提前给予KN62刺激减缓或抵消Caffeine对CaMKⅡ(Thr286)影响,高碳刺激同样可达到这种效果。另外数据显示,低碳Caffeine组(LGC)显著性高于高碳KN62组(HGK),其CaMKⅡ(Thr286)磷酸化水平是高碳KN62(HGK)的4.15倍。低碳KN62组(HGK)是高碳KN62(HGK)的2.70倍。说明Caffeine和低碳可共同影响CaMKⅡ(Thr286)磷酸化。
2.3 各组HDAC5(Ser498)和(Ser259)磷酸化水平
如图3和图4所示,高碳Caffeine组(HGC)的HDAC5(Ser498)和(Ser259)磷酸化水平显著性高于高碳KN62组(HGK),低碳Caffeine组显著性高于低碳KN62组,p值均小于0.01,表明Caffeine刺激下HDAC5(Ser498)和(Ser259)被激活,而KN62减弱这一效果。而高碳Caffeine组(HGC)显著性低于无论低碳Caffeine组显还是低碳KN62组,p值均小于0.01。意味着高碳可很大程度上抑制HDAC5(Ser498)的磷酸化,相反低碳则在一定程度上上调HDAC5(Ser498)和(Ser259)的磷酸化水平。另外低碳Caffeine组的HDAC5(Ser498)和(Ser259)磷酸化水平也显著高于高碳KN62组(HGK)plt;0.01,说明Caffeine可联合低碳共同调节HDAC5(Ser498)和(Ser259)磷酸化。低碳Caffeine组(LGC)显著性高于其他各组plt;0.01,表明Caffeine和低碳刺激可共同上调HDAC5(Ser498)和(Ser259)磷酸化水蛋白表达。
3 讨论
3.1 Caffeine和KN62对CaMKⅡ影响
Ca2+对细胞的调节是通过Ca2+与钙结合蛋白的作用而发挥不同的生理功能。钙结合蛋白有2类:一类是真正的Ca2+受体蛋白,这种蛋白本身无活性,如钙调素(CaM);另一类为钙调节酶如PKC,α酮戊二酸脱氢酶,磷脂酶C,磷脂酶A2等。钙调素(CaM)细胞内主要Ca2+的受体蛋白,Ca2+的许多功能都是通过CaM完成的。静息细胞质中Ca2+浓度约为0.1 μmol/L,当细胞受到刺激或神经冲动后,细胞膜Ca2+通道开放,细胞外Ca2+内流,同时内质网和线粒体内贮存的Ca2+释放出来,胞浆Ca2+浓度上升, 当浓度增加到1 μmol/L以上时,Ca2+就会与CaM结合形成Ca2+-CaM复合物。Ca2+-CaM复合物可激活很多酶,其中就包括CaMKⅡ。Caffeine刺激可以引起肌肉细胞内Ca2+浓度升高,其深层机制很可能与L型电压门控钙离子通道有关。运动刺激同样可以引起肌肉细胞内Ca2+浓度升高,而且有大量报道显示运动/肌肉收缩可上调CaMKⅡ(Thr286)的磷酸化表达。因此Caffeine也可通过Ca2+-CaM复合物激活CaMKⅡ。KN62全名1-[N,O-二(5-异喹啉磺酰基)-N-甲基-L-型酪氨酸]-4-苯基哌嗪,作用是CaMKⅡ特异性抑制剂。KN62可与CaM结合位点相互作用,阻碍CaM与CaMKⅡ的结合,进而抑制CaMKⅡ的磷酸化。因为KN62不能直接作用于CaMKⅡ,所以它不能抑制已经磷酸化的CaMKⅡ的活性而只能抑制未被激活的CaMKⅡ。本研究低碳组的结果表明:Caffeine可上调CaMKⅡ(Thr286)的磷酸化水平,而提前运用CaMKⅡ特殊抑制剂KN62可减缓或抵消这种效果。实验的结果与其他文献的结果一致,表明由Caffeine引起的细胞内Ca2+升高能够有效地激活CaMKⅡ蛋白激酶。
3.2 CaMKⅡ是否参与高和低碳水化合物影响的GLUT4蛋白表达
CaMKⅡ目前已被证实参与GLUT4蛋白表达调控,但是这些研究主要集中在CaMKⅡ的抑制剂和激动剂方面。有关高碳和低碳对CaMKⅡ的影响的直接证据较少。本实验结果显示高碳Caffeine组(HGC)的CaMKⅡ(Thr286)磷酸化水平显著低于低碳Caffeine组(LGC)(plt;0.01)。而且高碳Caffeine组(HGC)与高碳KN62组(HGK)无显著差异pgt;0.05, 高碳CaMKⅡ(Thr286)蛋白表达的抑制效果甚至可掩盖或抵消Caffeine对CaMKⅡ磷酸化的影响。也就是说高碳对GLUT4表达的延迟影响很可能是通过对CaMKⅡ的抑制作用引起的。
在本研究中LGC CaMKⅡ(Thr286)磷酸化水平显著高于其他各组,证明了CaMKⅡ确实参与了低碳影响的GLUT4蛋白表达。但低碳KN62组(LGK)显著低于低碳Caffeine组(LGC),表明KN62可抑制CaMKⅡ(Thr286)的磷酸化水平。
3.3 CaMKⅡ的变化是否引起HDAC5的变化
组蛋白的乙酰化和去乙酰化是基因表达的中枢调控机制。研究发现:基础状态下组蛋白的去乙酰化状态主要由HDAC5 蛋白维持。HDAC5的去乙酰化可使组蛋白赖氨酸残基侧链带上正电荷,而DNA主链本身带负电荷,因此HDAC5的去乙酰化作用可使组蛋白和DNA主链紧密结合,阻碍转录因子与靶基因启动子区域DNA结合位点结合,从而抑制了靶基因的转录。而HDAC5 与14-3-3 蛋白伴侣结合后的转移出核,相反可解除对转录因子对靶基因转录活性抑制。所以提高HDAC5的岀核速率就可加速基因表达。离体研究[6]结果表明:HDAC5 的出核速率高度正相关于HDAC5的磷酸化水平,特别是HDAC5(Ser259)和HDAC5(Ser498) 2个位点的磷酸化。那么CaMK能否磷酸化HDAC5?在神经元研究中发现,IIa类HDACs的HDAC4和HDAC5的岀核活动依赖于CaMK蛋白活动。
本研究发现HDAC5(Ser259 )和HDAC5(Ser498)的磷酸化水平与CaMKⅡ(Thr286)的磷酸化水平存在高度的相关关系。CaMKⅡ(Thr286)表达相对较高的组,其HDAC5(Ser498)和HDAC5(Ser259)的表达也相对较高;而CaMKⅡ(Thr286)表达相对较低的组,HDAC5(Ser498)和HDAC5(Ser259)也呈现较低水平。在低碳组,Caffeine刺激不仅能使低浓度葡萄糖组骨骼肌细胞内CAMKⅡ的Thr 286位点磷酸化水平增加1.26倍,还能够使低浓度葡萄糖组骨骼肌细胞内的HDAC5蛋白的Ser498位点与Ser259位点磷酸化水平增加1.06倍和1.25倍;另一方面,高浓度葡萄糖确实际能够抑制由Caffeine刺激引起的CAMKⅡ磷酸化,同时也能够抑制由Caffeine引起的HDAC5蛋白Ser498位点与Ser259位点磷酸化水平增加。实验结果证实CAMKⅡ蛋白与HDAC5蛋白关系密切,这提示在由Caffeine引起的细胞信号事件中HDAC5可能是CAMKⅡ信号途径中的一个关键性蛋白[2]。
3.4 CaMKⅡ及HDAC5的变化是否引起骨骼肌细胞GLUT4表达变化
GLUT4转录基因的开放受控于GLUT4基因启动子上游顺式作用元件与转录因子的相互作用。在转基因动物研究中发现多个物种的GLUT4基因启动子都存在2个保守序列,MEF2结合位点(位于启动子上游顺式作用元件-464至-473区域)和GEF结合位点(启动子上游顺式作用元件-712至-742区域)。MEF2绑定结合在GLUT4基因启动子顺式作用元件上并可募集抑制性结合蛋白,通过抑制性结合蛋白抑制GLUT4基因的表达。
HDAC5因其对组蛋白的去乙酰化作用,抑制了很多基因的转录。近年来研究发现,运动诱导的GLUT4基因和蛋白表达伴有组蛋白的乙酰化,表明HDAC 5很可能就是MEF2调控GLUT4基因表达所募集的抑制性蛋白。Han等[3]发现MEF2可与HDAC5结合,并在HDAC5找到了MEF2的结构域,证明了GLUT4的基因表达调控很可能是通过MEF2绑定结合在GLUT4基因启动子顺式作用元件上并可募集HDAC5实现的。因此HDAC5在细胞核内的浓度对GLUT4基因表达至关重要。增加HDAC5在细胞核内的浓度就会抑制GLUT4基因的表达;研究[4]报道骨骼肌细胞中敲出HDAC5就能够增加GLUT4的表达和葡萄糖摄取。McGee等[5]细胞离体外实验发现:加入野生型HDAC5表达质粒增加HDAC5的表达就能够很大程度抑制GLUT4基因的表达。而增加HDAC5磷酸化水平促进HDAC5的岀核,减少HDAC5细胞核内的浓度就会可上调GLUT4基因和蛋白的表达。本研究中中HDAC5磷酸化水平相对较高的组,其GLUT4蛋白的表达也相对较高,也证实了这一点。
3 结语
Caffeine能够显著引起骨骼肌细胞GLUT4蛋白表达,且Caffeine组的CaMKⅡ(Thr286)的磷酸化水平与HDAC5(Ser498)和HDAC5(Ser259)磷酸化水平是完全成正相关关系;而抑制剂KN62组的实验结果显示KN62能够显著抑制CaMKⅡ(Thr286) 磷酸化,这一磷酸化改变就同时伴有HDAC5(Ser498)和(Ser259)位点磷酸化水平与GLUT4表达水平显著降低的变化。实验结果从正反两个方向上证实了运动模拟信号Caffeine,即Ca2+信号能引起的骨骼肌细胞GLUT4的表达可能是通过Caffeine-Ca2+-CaMKⅡ-HDAC5信号通路机制。
[1] GUO L,STRIPAY J L,ZHANG X,et al,CaMKIα regulates AMP Kinase-Dependent, TORC-1-Independent autophagy during lipopolysaccharide-induced acute lung neutrophilic inflammation[J].J Immunol,2013,190(7):3 620-3 628.
[2] 李良刚.Ⅱ型组蛋白去乙酰化酶可能参与收缩骨骼肌葡萄糖转运蛋白4基因表达的转录调节[J].中国运动医学杂志,2007(6):763-766,743.
[3] HAN A,PAN F,JANES C,et al.Sequence-specific recruitment of transcriptional co-repressor cabin 1 by myocyte enhancer factor-2[J].Nature,2003,422:730.
[4] 李良刚,陈槐卿.CaMK和AMPK信号通路能共调收缩信号诱导的骨骼肌细胞GLUT4基因转录[J].生物化学与生物物理进展,2009(4):471-479.
[5] MCGEE S L,VANDENDEREN B J,HOWLETT K F,et al.AMP-activated protein kinase regulates GLUT4 transcription by phosphorylating histone deacetylase 5[J].J Diabetes,2008,57(4):860-867.
RelationshipbetweenGLUT4ExpressionandCaMK/HDAC5inRatSkeletalMuscleunderDifferentCarbohydrates
LIUJianwu,WANJiachuan,LILianggang*
(Department of Sports Medicine, Chengdu Sport University, Chengdu 610041,China)
To find out whether the effect of Caffeine on regulating the GLUT4 expression was related with Caffeine-Ca2+- CaMKⅡ-HDAC5 signal pathway. 48 male Wistar rats which were 8-week-old were randomly divided into four groups (n=12), named as HGC group, HGK group, LGC group and LGK group. The rats were fed with different diet and induced by Caffeine or KN62. And CaMKⅡ(Thr286)、HDAC5(Ser498) and HDAC5(Ser259)phosphorylation and GLUT4 protein expression were tested by western blotting. Compared with the LGK group, both CaMKⅡ(Thr286) and HDAC5(Ser259) and HDAC5(Ser498)phosphorylation increased significantly in skeletal muscle cells in LGC group. Compared with the LGK and LGC group, CaMKⅡ(Thr286)、HDAC5(Ser498) and HDAC5(Ser259)phosphorylation decreased obviously in HGC and HGK group. Meanwhile, the changes of CaMKⅡ(Thr286)、HDAC5(Ser498) and HDAC5(Ser259)phosphorylation in HGC group had no significant difference with that in HGK group. Therefore (1) Caffeine could remarkably increase the expression of GLUT4, and increase the CaMKⅡ(Thr286)、HDAC5(Ser498) and HDAC5(Ser259)phosphorylation and exist a remarkably positive correlation. While KN62 could significantly decrease the CaMKⅡ(Thr286)、HDAC5(Ser498) and HDAC5(Ser259)phosphorylation and the expression GLUT4. They demonstrated that the effect of Ca2+signal which was induced by Caffeine on increasing the expression of GLUT4 was possibly related with Caffeine-Ca2+- CaMKⅡ-HDAC5 signal pathway. (2) Whatever the rats were fed with, the expression of GLUT4 was corresponded with CaMKⅡ(Thr286)、HDAC5(Ser498) and HDAC5(Ser259) in skeletal muscle cells. So the effect of CaMKⅡon regulating the expression of GLUT4 in skeletal muscle was related with inducing HDAC5 and regulating its (Ser 498) site and(Ser 259)site.
GLUT4;CaMK;HDAC5
2013-11-07
国家自然科学基金项目“CaMK通过HDAC5转录运动诱导性骨骼肌细胞GLUT4基因的调控机制研究”(30971417/C140501)
刘建武(1988- ),男(汉族),山东临沂人,在读硕士研究生,研究方向:运动体能、运动营养及细胞能量代谢基因与蛋白表达调控机制研究。
李良刚(1960- ),男(汉族),四川成都人,教授,博士,研究方向:运动体能、运动营养及细胞能量代谢基因与蛋白表达调控机制研究,通信作者邮箱:554905620@qq.com。
R587.1
A
2095-5383(2013)04-0005-05
