干细胞制品临床前药效学及安全评价研究概况
2013-11-30汪巨峰霍艳王庆利王佑春
汪巨峰,霍艳,王庆利,王佑春
Back 等[1]1968年报道骨髓移植治疗湿疹血小板减少伴免疫缺陷症以来,细胞制品作为一种很有价值的资源一直用于治疗多种疾病。由于干细胞具备自身更新和分化的能力,其衍变而来的临床用生物制品可能具有与其本身不同的生物学特征,故干细胞制品是一种不同于基础细胞的生物制品。目前,对此类干细胞制品的生物学特性及临床应用价值仍处于研究探索阶段,但对不同类别的干细胞制品的研究探索程度不同,例如,间充质干细胞(mesenchymal stem/stromal cells,MSCs)/基质干细胞、造血干细胞等已有大量临床前研究和临床使用的报道[2-4],而人胚胎干细胞(human embryonic stem cells,hESCs)或诱导性多功能干细胞(induced pluripent stem cells,iPSCs)目前还缺乏足够的临床前资料,尚未进入临床使用。虽然许多临床观察结果令人鼓舞,而且新的治疗领域不断扩展,但干细胞的临床应用仍存在一定的安全风险。本文结合近年来干细胞的临床前研究,对干细胞制品的治疗效果和安全风险等进行综述。
1 干细胞的定义和类别
干细胞是一类具有自我更新能力,即形成子代细胞核多系分化能力的细胞,同时干细胞还具有增生的能力,通常可分为胚胎干细胞、成体干细胞和诱导多能干细胞[5]。
1.1 胚胎干细胞
胚胎干细胞(embryonic stem cells,ESCs)属多能性细胞,能分化成机体的任何一种功能细胞,可通过其细胞表面的标志物来区分其特性。在体外系统中可通过外源因子或基因调节等方式来调控其分化,但采用体外方法分化而成的细胞具有一定的多相性。
1.2 成体干细胞
成体干细胞(somatic stem cells)为胎儿或出生后已发育的组织器官中向特定组织细胞分化的前体细胞。又可以分为:①造血干细胞(hematopoietic stem cells,HSCs):为组织特异的干细胞,可分化成所有的血细胞、骨髓细胞和淋巴细胞等,这类干细胞在胎盘和脐带血中的含量与成人骨髓中相近,在成人体内造血干细胞主要存在于骨髓中,在外周血液和肝、脾、肌肉等组织中偶尔有少量存在。②间充质干细胞(MSCs):主要来源于骨髓基质和脂肪组织,往往具有特殊的表面抗原表达和多细胞系的分化潜力,如可分化为成脂、成骨和软骨细胞,而在体外培养条件下亦可分化为肌腱细胞、骨骼肌细胞、星型胶质细胞及神经元。③神经干细胞(neural stem cells,NSCs)等特定组织的前体细胞:分化能力有限,正常情况下形成单细胞。如神经元、皮肤、肺、肌肉及肠道等细胞,它们只有有限分化能力,只进行正常组织更新和交替活动。

表1 不同干细胞的特性
1.3 诱导多能干细胞
诱导多能干细胞(iPSCs)是一种由机体中已分化的细胞经基因重编程所诱导产生的、具有多向分化能力的干细胞。它具有胚胎干细胞的许多特征,其细胞分化能力与所用躯体成年细胞类别和年龄等有较大的关系。不同类别干细胞的生物学特性归纳总结于表 1。
2 干细胞制品目前已开展的临床研究的范畴
近年来以干细胞为主的细胞治疗研究发展迅速,在治疗退行性疾病、缺血性心脑血管疾病、骨关节疾病、免疫系统疾病及移植物排斥反应、肝硬化、糖尿病等领域已启动了多项临床试验研究。主要包括:①心脏病:主要是修复损伤的心肌,目前仍处于早期研究阶段。有临床报道患者用自己的心脏干细胞和骨髓干细胞治疗后心脏功能有一定的改善,心肌的坏死疤痕开始修复。另外,骨髓干细胞、脐带血干细胞、脂肪组织的干细胞等均能促进血管增生形成新的血管,有助于缺血心肌的恢复[2,6-8]。②眼病:来源于角膜的角膜缘干细胞可通过重组角膜皮层有效地改善角膜病变患者的视力。干细胞对眼黄斑病变及干性黄斑退变也有一定的作用[9-10]。③糖尿病:目前研究工作者主要是通过使用患者自身的干细胞分化成胰腺的 β 细胞,从而分泌胰岛素来治疗 I 型糖尿病[11]。④神经系统:如脊髓损伤、帕金森症和阿尔茨海默病等,自 2009年 1月 23日美国 FDA 首次批准使用人胚胎干细胞对脊椎损伤患者进行临床治疗后,已有不少临床试验在不同国家展开,而帕金森症和阿尔茨海默病的临床有效性有待进一步证实[12]。
表2 总结了近年来美国干细胞制品的临床试验状态。结果表明,目前干细胞制品主要是在临床 I 期(即安全性研究)和 II 期(进一步安全性和有效性研究)。而试验所用干细胞制品大都来源于骨髓、造血系统和间充质干细胞,其治疗效果往往难以确定。干细胞的修复损伤组织功能在一些实验条件下不一定发挥较大的作用,其治疗效果有可能是通过非特异性的细胞营养作用而产生的[3]。

表2 美国干细胞制品处于临床试验不同阶段的比例
3 干细胞制品的药效学研究
20 世纪 50年代首次报道干细胞用于治疗小鼠放射性损伤以来[13],细胞制品的多种疗效已在临床前动物模型中得到证实。本文以心血管系统为例重点介绍干细胞的临床前药效学研究。
3.1 干细胞制品对缺血性心脏病治疗效果的评价
2010年 10月,美国 FDA 正式颁发了“心脏病细胞治疗的指导原则”(Guidance for Industry:Cellular Therapy for Cardiac Disease)[14],对临床前药效学的评价作了相关的规定,尤其是对动物模型的选择、干细胞给药方式、细胞数和时程作了相应的介绍。虽然临床上的药物治疗和冠状动脉血管再灌已改善心脏病患者的生存率,但对失去功能或死亡的心肌细胞,却无法逆转或修复。目前,干细胞制品临床试验主要是用于心肌缺血的治疗,其目的就是通过干细胞促进心肌组织和新血管增生来重塑心肌的生理功能和生物电活性。主要特征为:①通过减少心室的收缩末端容积(end-systolic volume,ESV)来改善左室射血分数,提高心室的生理功能;②间充质干细胞的疗效高于其他类别的干细胞制品;③每次治疗干细胞总数在 107~108之间效果较为理想;④动物种系对实验结果无明显影响,一般以大动物为主,多数实验是用猪来进行的;⑤给药途径的不同并不影响实验结果,如冠脉给药、心肌注射等给药方式所获结果相似;⑥冠脉左前降枝结扎引起的心肌梗死和慢性心肌梗死模型是干细胞治疗心脏病的首选动物疾病模型;⑦另外,研究还表明,给药8 周后在大动物身上干细胞的疗效明显减弱,并且随着时间的延长干细胞制品的治疗效果呈减弱趋势。与对照组相比舒张末压虽然无明显变化,但心脏的总体功率得到改善,提示干细胞加强心肌收缩力。而间充质干细胞的效果明显优于骨髓单核细胞等,表明 MSCs 可能在体内分化成新的心肌细胞并促进原心肌细胞释放生长因子等,从而促进新的血管生成、减少细胞凋亡[6,12,15-17]。具体结果见表 3。
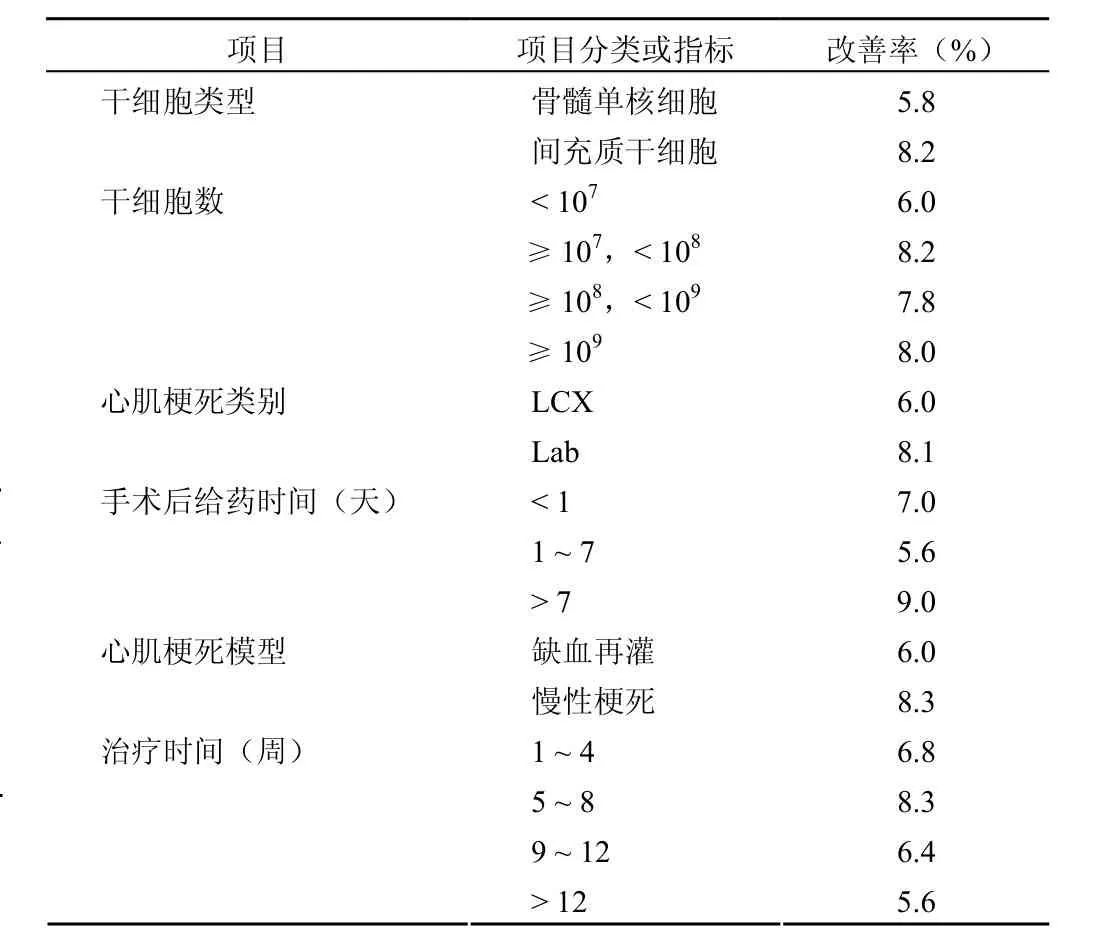
表3 心脏左室射血分数的改善率
3.2 临床前药效研究的总体原则
虽然目前干细胞制品缺乏临床前药效学评价的统一标准,但世界各国基本认同下述原则:①选择接近于人类疾病症状的实验动物模型。②根据干细胞的特性和治疗病症的情况,可能需要用多种动物模型才能更好地了解治疗效果和安全性。③有些临床需要的特殊给药方式在小动物试验中很难实现。此外,若采用临床相似用量,小动物亦较难达到,因此通常情况下首选大动物。④在研究干细胞制品的排斥性时,应考虑使用免疫抑制的动物。⑤为提高干细胞在机体内的生存时间,往往也会使用免疫抑制剂。但应该注意到免疫抑制动物模型有可能会影响实验结果,甚至影响动物中、长期的健康和生存率。⑥当动物模型不能完全反映人类疾病的病理生理过程时,其他的替代模型和体外实验应重点考虑。⑦若无法找到替代动物模型,应考虑制备动物来源的同种干细胞来进行实验研究。⑧在设计实验类别、时段和范围等时还应考虑到干细胞制品的特性和存活时间。⑨考虑可能的作用机制、疾病的周期长短和给药方式等因素。特殊时也要考虑补加一些实验来证实给药输送装置是否对干细胞制品有影响[3, 5, 15, 17-19]。
4 干细胞制品的临床前安全评价
4.1 干细胞制品临床前安全评价要点
通过体外条件大量产生的干细胞进入机体后可能会变得无效,甚至会产生严重的副作用,如肿瘤、严重的免疫反应或形成不需要的组织等。目前,干细胞治疗面临的主要挑战是有效性和安全性。干细胞制品是用于疾病状态下的实验动物或人体,机体对干细胞制品的影响可能大于其对机体的作用。当干细胞输入机体后,由于细胞自身内部的不同再加上细胞所处外部环境的差异,都有引发干细胞变异的可能,从而产生不可预见的安全风险,故对干细胞制品的安全性应给予高度的关注。另外,由于干细胞制品在机体内存留时间通常较长,应特别注意干细胞给药后的存活、移走、状态改变甚至代谢等情况。在实验研究中还要注意干细胞制品在机体内的生物分布,其能帮助我们了解干细胞在体内靶器官和非靶脏器的滞留,这对解释可能的毒性部位和在靶器官的有效细胞数目提供科学依据[5, 12, 15, 17, 19-21]。
4.2 干细胞制品的临床前安全评价的相关指导原则
我国在 2008年 9月颁发了《人体细胞治疗研究和制剂质量控制技术指导原则》对细胞制品的来源分类、制备、质量控制、临床前试验即安全性和有效性等均作出一个共性要求。随后,于 2010年 5月颁发了《治疗用生物制品非临床安全性技术审评一般原则》,阐述了我国对治疗用生物制品的安全性评价原则。其评价的主要内容和具体要求与化学药物类似,主要为:①生物活性测定/药效学试验;②一般药理学试验;③急性毒性试验;④长期毒性试验;⑤免疫原性/毒性试验;⑥生殖毒性试验;⑦遗传毒性试验;⑧致癌性试验;⑨局部耐受性试验;⑩药代/毒代试验。但对干细胞制品目前一般不建议做药代、毒代实验。2013年 3月卫生部对干细胞制品的临床前研究颁发了《干细胞制剂质量控制及临床前研究指导原则(试行)》,这是我国最新的针对干细胞制品的研究指导原则。
另外,美国 FDA 及 ICH 等均对生物制品的安全性作了相应的要求[14,22-23]。临床前动物毒性研究是评价干细胞制品安全性的基本的、也是必需的步骤。临床前毒性研究所得的安全资料将是决定干细胞制品用于临床试验的主要依据。同时也能为临床试验提供可能的特殊毒性的监测信息。
4.3 干细胞制品的临床前安全评价一般原则
干细胞制品的临床前安全评价一般可分为两部分:①生物制品要求进行的常规毒性评价:一般包括行为观察、临床指征的变化、死亡率、体重、摄食量、血液生化测定、尿常规分析、眼科检查和组织病理检查等。②非靶组织或部位毒性:包括生物分布、致瘤性及免疫原性。
4.3.1 生物分布 研究发现,大约只有 1% 的干细胞将蓄积在体内相应的靶器官,而绝大多数细胞因其粒径或其表面黏附受体等原因在肺部滞留,还有少部分因通过前毛细血管时在血流中被吸附或损失。故干细胞制品的一个极为重要的安全性考虑就是其在体内的生物分布,研究其生物分布可追踪干细胞制品在体内的状态、分化和在靶组织与非靶组织的存留[5,15,17]。目前,大都采用干细胞体外标记后再移植入体内的方法来追踪干细胞在体内的状况。文献报道使用超顺磁性氧化铁(SPIO)纳米颗粒标记兔肌腱干细胞,通过核磁共振(MRI)技术能有效地观察到肌腱干细胞参与受损肌腱的修复和再生。将肌腱干细胞与 50 mg/ml 的 SPIO 一起培养,通过 qRT-PCR 和免疫组化等方法对干细胞生长等指标进行监测。实验结果表明,肌腱干细胞的标记成功率高达98%,与未标记对照干细胞相比,细胞的生长、分化及诱导分化等功能没有明显的不同。同时,干细胞的标志物,如核干细胞因子、Nanog 和 Qct-4A 等也没有受到影响。上述结果说明,SPIO 标记没有改变干细胞的存活状态、分化等,可以作为一种较常用的检测干细胞在机体内生物分布的工具[3, 5, 24-25]。
目前干细胞生物分布的检测方法有[25-29]:①胞浆标记物:常用的主要有 Hoechst 和 Dil 等荧光色素,主要用于细胞的追踪。但随着细胞的分裂,标记物会等分给两个子细胞,子细胞的荧光强度也随着下降。根据观察到的荧光只能判断干细胞的存在,而难以判断干细胞的形态和存活情况。②核酸标记:最常用的有 5-溴脱氧嘌呤核苷(BrdU)标记法。其标记和检测方法简便,准确性及标记率高,是反映干细胞增殖及跟踪干细胞的理想指标。但标记干细胞若发生死亡,其释放的 BrdU 则可掺入到干细胞循环 S 期的任何细胞,从而难以区分移植细胞和宿主细胞。③光学成像标记:常用的有生物发光成像(biolminstcence/maging,BLI)和荧光成像,但由于定位困难、光穿透力有限,该方法不适于大动物,只用于小动物实验性成像的研究。④单光子发射计算机层摄影术(single photon emission computer tomography,SPECT)和正电子发射断层显像(positron emission tomography,PET),主要用于干细胞的细胞动力学和增殖研究。⑤核磁共振细胞成像显影,优点是可观察干细胞的动态迁徙过程,空间时间分辨率高,对比度好,有利于观察、追踪活体细胞。
4.3.2 致瘤性 形成异体组织或肿瘤是干细胞制品的一个主要安全关注点,而来源于植入干细胞所形成的异体组织或肿瘤是可以通过临床前毒性评价来监测的。干细胞制品的致肿瘤性取决于以下几个方面的因素,即干细胞的来源、操作影响和注射给药部位或途径。另外,干细胞分化状态、多能或细胞系定型及培养条件等均对致肿瘤性有一定的影响。致瘤性一般被认为是多能性干细胞,即 iPSC 和 hESC 的自己特性,而躯体干细胞如 MSC、HSC 等的致瘤性相对较小。干细胞制品致瘤易形成的部位主要在中枢神经系统、心脏和关节腔等组织连接部位。多能干细胞最易引起良性畸胎瘤、恶性畸胎瘤和继发性肿瘤。因人胚胎干细胞和诱导多能干细胞具有其自身特点,故比任何来源于胎儿或成年组织的干细胞具有更强的致瘤性。另外,延长干细胞体外培养时间有可能提高其遗传或表观遗传的变化,从而增加致瘤性风险。干细胞在体内存活时间越长,其致瘤性风险也相应提高。若干细胞植入体内后,在局部发挥作用而不迁移到其他组织,其致瘤风险相对变小[3,5,15,17,21,30]。故在评价干细胞制品的致瘤性时应考虑:①干细胞体外培养的时间;②用于形成细胞制品的干细胞类别;③最终细胞制品的分化状态;④预期干细胞植入体内后的存活期;⑤干细胞在体内的分布和迁移;⑥若形成异体组织或肿瘤可能的临床后果;⑦使用干细胞制品的临床前研究信息等。

表4 干细胞制品安全评价中常用的免疫缺陷实验动物

表5 实验干细胞制品临床前安全评价设计原理
在致瘤性安全评价动物模型的选择方面,应该考虑到干细胞有足够长的生存时间。一般推荐使用免疫抑制的啮齿类动物来进行[17]。Gilbert 和 Blau[20]报道,T 淋巴细胞、B 淋巴细胞和 NK 细胞缺乏小鼠给予干细胞后畸胎瘤的发生率比单一 T、B 细胞缺乏小鼠要高,且畸胎瘤生长更快。另外,一般都要求致瘤实验周期在 9~12 个月[17]。表 4 列举了目前在干细胞临床前研究中常用的免疫缺陷动物。
4.3.3 免疫原性 免疫原性亦是影响干细胞制品安全性的主要因素之一。自身来源的干细胞免疫排斥反应通常较低,但在体外培养过程中,外部环境的改变有可能会改变干细胞的一些特征,而引起宿主免疫效应。免疫原性受多种因素的影响,包括同源或非同源治疗、干细胞给予部位、细胞的成熟状态、反复给予和免疫性疾病等。免疫原性和免疫毒性对细胞制品而言是一个重要的安全问题。在进行免疫原性评价时还应充分考虑到动物模型与临床患者的差异。当将一个临床患者使用的干细胞制品输入到正常动物身上时,此干细胞就会成为一个外源异物[5,17-18]。
4.3.4 小结 综合上述,干细胞制品的临床前安全性研究是与其他生物制品相似的,可单独进行也可与致瘤性或生物分布实验整合到一起来进行[5,15,17]。其总体原则见表 5。
5 结语
目前,开展干细胞制品的临床前药效学和安全评价仍存在不少问题,面临极大的挑战,因为每种干细胞制品的治疗方式都是独特的,很难找到一种单一的固定模式来对其进行临床前有效性和安全性评价。随着越来越多的干细胞制品进入临床试验,开发适合的临床前安全性评价模型越来越引起人们的关注。建立科学的干细胞制品临床前研究策略,需要药物监管部门、制药企业和科研单位的共同努力。
[1] Back F, Albertini RJ, Joo P, et al.Bone-marrow transplantation in a patient with the Wiskott-Aldrich syndrome.Lancet, 1968, 292(7583):1364-1366.
[2] Mansour S, Vanderheyden M, De Bruyne B, et al.Intracoronary delivery of hematopoietic bone marrow stem cells and luminal loss of the infarct-related artery in patients with recent myocardial infarction.J Am Coll Cardiol, 2006, 47(8):1727-1730.
[3] Trounson A, Thakar RG, Lomax G, et al.Clinical trials for stem cell therapies.BMC Med, 2011, 9:52.
[4] Ali H, Bahbahani H.Umbilical cord blood stem cells - potential therapeutic tool for neural injuries and disorders.Acta Neurobiol Exp(Wars), 2010, 70(3):316-324.
[5] Herberts CA, Kwa MS, Hermsen HP.Risk factors in the development of stem cell therapy.J Transl Med, 2011, 9:29.
[6] van der Spoel TI, Jansen of Lorkeers SJ, Agostoni P, et al.Human relevance of pre-clinical studies in stem cell therapy: systematic review and meta-analysis of large animal models of ischaemic heart disease.Cardiovasc Res, 2011, 91(4):649-658.
[7] Loffredo FS, Steinhauser ML, Gannon J, et al.Bone marrow-derived cell therapy stimulates endogenous cardiomyocyte progenitors and promotes cardiac repair.Cell Stem Cell, 2011, 8(4):389-398.
[8] Copeland N, Harris D, Gaballa MA.Human umbilical cord blood stem cells, myocardial infarction and stroke.Clin Med, 2009,9(4):342-345.
[9] Tsubota K, Satake Y, Kaido M, et al.Treatment of severe ocular-surface disorders with corneal epithelial stem-cell transplantation.N Engl J Med, 1999, 340(22):1697-1703.
[10] Schwartz SD, Hubschman JP, Heilwell G, et al.Embryonic stem cell trials for macular degeneration: a preliminary report.Lancet, 2012,379(9817):713-720.
[11] Laino C.Type 1 diabetes treatment shows promise.(2012-08)[2013-10-14].http://diabetes.webmd.com/news/20120611/stem-cellstype-1-diabetes.
[12] Joers VL, Emborg ME.Preclinical assessment of stem cell therapies for neurological diseases.ILAR J, 2009, 51(1):24-41.
[13] Lorenz E, Uphoff D, Reid TR, et al.Modification of irradiation injury in mice and guinea pig by bone marrow injections.J Natl Cancer Inst,1951, 12(1):197-201.
[14] U.S.Department of Health and Human Services, Food and Drug Administration, Center for Biologics Evaluation and Research, et al.Guidance for Industry: cellular therapy for cardiac disease.(2010-10)[2013-10-14].http://www.fda.gov/downloads/BiologicsBloodVaccines/GuidanceComplianceRegulatoryInformation/Guidances/CellularandG eneTherapy/UCM164345.pdf.
[15] Frey-Vasconcells J, Whittlesey KJ, Baum E, et al.Translation of stem cells research: points to consider in designing preclinical animal studies.Stem Cells Transl Med, 2012, 1(5):353-358.
[16] Piccini JP, Whellan DJ, Berridge BR, et al.Current challenges in the evaluation of cardiac safety during drug development: translational medicine meets the critical path initiative.Am Heart J, 2009, 158(3):317-326.
[17] Sharpe ME, Morton D, Rossi A.Nonclinical safety strategies for stem cell therapies.Toxicol Appl Pharmacol, 2012, 262(3):223-231.
[18] European Medicines Agency.Reflection paper on stem cell-based medicinal products.(2011-01-14) [2013-10-14].http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2011/02/WC500101692.pdf.
[19] Goldring CE, Duffy PA, Benvenisty N, et al.Assessing the safety of stem cell therapeutics.Cell Stem Cell, 2011, 8(6):618-628.
[20] Gilbert PM, Blau HM.Engineering a stem cell house into a home.Stem Cell Res Ther, 2011, 2(1):3.
[21] Hentze H, Soong PL, Wang ST, et al.Teratoma formation by human embryonic stem cells: evaluation of essential parameters for future safety studies.Stem Cell Res, 2009, 2(3):198-210.
[22] U.S.Department of Health and Human Services, Food and Drug Administration, Center for Biologics Evaluation and Research.Guidance for industry: preclinical assessment of investigational cellular and gene therapy products, draft guidance.(2012-11)[2013-10-14].http://www.fda.gov/downloads/biologicsbloodvaccines/guidancecomplianceregulatoryinformation/guidances/cellularandgenet herapy/ucm329861.pdf.
[23] The International Conference on Harmonisation of Technical Requirements for Registration of Pharmaceuticals for Human Use.Preclinical safety evaluation of biotechnology-derived pharmaceuticals.(1997-07) [2013-10-14].http://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Safety/S6_R1/Step4/S6_R1_Guideline.pdf.
[24] Jackson JS, Golding JP, Chapon C, et al.Homing of stem cells to sites of inflammatory brain injury after intracerebral and intravenous administration: a longitudinal imaging study.Stem Cell Res Ther,2010, 1(2):17.
[25] Yang Y, Zhang J, Qian Y, et al.Superparamagnetic iron oxide is suitable to label tendon stem cells and track them in vivo with MR imaging.Ann Biomed Eng, 2013, 41(10):2109-2119.
[26] Gharaibeh B, Lavasani M, Cummins JH, et al.Terminal differentiation is not a major determinant for the success of stem cell therapy -cross-talk between muscle-derived stem cells and host cells.Stem Cell Res Ther, 2011, 2(4):31.
[27] Duan F, Wang MQ.Current status and prospect of labeling and tracking stem cells.Int J Med Radiol, 2009, 32(6):563-566.(in Chinese)段峰, 王茂强.干细胞标记示踪技术的研究进展.国际医学放射学杂志, 2009, 32(6):563-566.
[28] Tong L, Zhao H, He Z, et al.Current perspectives on molecular imaging for tracking stem cell therapy//Okechukwu FE.Medical imaging in clinical practice.Rijeka, Croatia: InTech, 2013:63-79.(2013-02-20) [2013-10-14].http://cdn.intechopen.com/pdfs/40177/In Tech-Current_perspectives_on_molecular_imaging_for_tracking_ste m_cell_therapy.pdf.
[29] Sun JS, Li B, Gong YK.Research progress in labeling and tracing technique of bone marrowmesenchymal stem cells.Chin J Tissue Eng Res, 2012, 16(6):1107-1110.(in Chinese)孙江森, 李彪, 龚跃昆.骨髓间充质干细胞标记及示踪技术的研究与进展.中国组织工程研究, 2012, 16(6):1107-1110.
[30] Cunningham JJ, Ulbright TM, Pera MF, et al.Lessons from human teratomas to guide development of safe stem cell therapies.Nat Biotechnol, 2012, 30(9):849-857.
