吲哚美辛联合X线照射对人急性髓系白血病HL-60细胞的增殖抑制作用
2013-11-29顾俊莲戴玉鑫佟力军孟令娜
王 波,顾俊莲,戴玉鑫,佟力军,孟令娜,李 扬
(1.内蒙古林业总医院病理科,内蒙古 呼伦贝尔 022150;2.吉林大学白求恩医学院病理生理学教研室,吉林 长春 130021)
放射治疗是恶性肿瘤的主要治疗方法,约70%的癌症患者在治疗过程中需要采用放射治疗,但由于放射治疗副作用大,预后不良,所以对于恶性肿瘤的联合治疗已经越来越引起人们的重视。解热镇痛抗炎药是一类具有抗炎、镇痛,多数还具有抗炎抗风湿作用的药物。近期研究[1-2]发现:这类药物不但能降低恶性肿瘤患病的危险性,而且能抑制乳腺癌和前列腺癌等多种恶性肿瘤细胞的增殖。吲哚美辛是具有代表性的一类解热镇痛抗炎药,国外研究[3]证实其对多种癌细胞具有抑制作用,但该药物联合放射治疗对人急性髓系白血病的治疗作用尚无相关报道。本实验研究吲哚美辛联合放射治疗处理人急性髓系白血病HL-60细胞,观察其对癌细胞的增殖抑制作用,为抗肿瘤研究提供依据。
1 材料与方法
1.1 细胞与主要试剂 HL-60细胞购自上海中科院细胞库,IMDM和胎牛血清购自Gibco公司,吲哚美辛购自Sigma公司,实时荧光定量PCR mix购自Takala公司,MTT和台盼蓝购自上海鼎国公司。
1.2 细胞培养 HL-60细胞培养于含10%血清的IMDM中,37℃、CO2孵箱中培养传代,次日传代,更换新鲜培养基。新鲜接种的细胞换成含2%血清的IMDM,同时加入不同浓度(0、20、40、60、80和100μmol·L-1)的吲哚美辛处理细胞。放射剂量根据文献选用3Gy进行放射治疗。放射处理条件:照射时在培养瓶下加垫厚度为2cm等效有机玻璃板,细胞在室温下用直线加速器上的6MV X线照射,单次照射剂量分别为3Gy,平均剂量率为180cGy·min-1。
1.3 MTT法检测细胞的增殖 取对数生长期的HL-60细胞,按每孔2×104接种于96孔板里,培养24h后,更换成含2%血清的IMDM,同时加入不同浓度(20、40、60、80和100μmol·L-1)的吲哚美辛处理细胞,每组设6个复孔,在37℃、CO2孵箱中培养48h,每孔加入20μL MTT,继续孵育4~6h,弃上清,加入150μL DMSO,轻轻混匀,于酶标仪470nm处测吸光度(A)值,计算细胞增殖抑制率,细胞增殖抑制率=(1-实验组A570值/对照组A570值)×100%。
1.4 台盼蓝染色法检测细胞活力 实验设不加吲哚美辛的对照组、80μmol·L-1吲哚美辛组、3Gy X线照射组和吲哚美辛(80μmol·L-1)联合照射(3Gy X线)组。细胞消化成单细胞悬液,采用0.4%台盼蓝染色并细胞计数,死细胞为蓝紫色,活细胞为透明色,重复3次,取平均值,计算细胞活力抑制率,细胞活力抑制率(%)= [1-(实验组A值-空白对照组A值)/(对照组A值-空白对照A值)]×100%。
1.5 RT-PCR检测 HL-60细胞中 mRNA的表达用TRIzol试剂提取细胞总RNA,采用dNTP、逆转录酶等将RNA逆转录成cDNA,取适量进行PCR反应。GAPDH 实时引物序列:Sense,5′-AGAAGGCTGGGGCTCATTTG -3′;Antisense,5′-AGGGGCCATCCACAGTCTTC-3′,设计30个循环,退火温度为58℃。PCNA实时引物序列:Sense,5′-GGTCCAGGGCTCCATCCT-3′;Antisense,5′-CCAGCAGGCCTCGTTGAT-3′,设计30个循环,退火温度为56℃。Caspase-3实时引物序列:Sense,5′-TAACCAGGTGCTGTGGAGTA-3′;Antisense,5′-GTGGAATTGATGCGTGATGT-3′,设计30个循环,退火温度为50℃。
1.6 统计学分析 采用SPSS 13.0统计软件进行统计分析,细胞增殖抑制率和细胞活力抑制率以表示,组间比较采用单因素方差分析。
2 结 果
2.1 吲哚美辛联合照射作用下HL-60细胞增殖抑制率的变化 MTT结果显示:与对照组比较,在3Gy X线照射下,80μmol·L-1吲哚美辛联合照射组细胞的增殖抑制率最高;与对照组比较,80、100和200μmol·L-1吲哚美辛联合照射组细胞的增殖抑制率明显增加,差异具有统计学意义(P<0.05)。见表1。
2.2 吲哚美辛联合照射作用下HL-60细胞活力抑制率的变化 与对照组比较,80μmol·L-1吲哚美辛联合3Gy X线照射组细胞活力抑制率明显增加,差异具有统计学意义(P<0.05)。见表2。
2.3 吲哚美辛联合照射作用下 HL-60细胞中PCNA和Caspase-3mRNA表达的变化 与对照组比较,80μmol·L-1吲哚美辛联合3Gy X线照射组HL-60细胞中PCNA mRNA表达明显降低(P<0.01),Caspase-3mRNA表达明显增加(P<0.01)。见图1和表3。
表1 不同浓度吲哚美辛联合照射作用下HL-60细胞的增殖抑制率Tab.1 The inhibitory rates of proliferation of HL-60cells after treated with different concentrations of indometnacin combined with radiation (n=6,,η/%)

表1 不同浓度吲哚美辛联合照射作用下HL-60细胞的增殖抑制率Tab.1 The inhibitory rates of proliferation of HL-60cells after treated with different concentrations of indometnacin combined with radiation (n=6,,η/%)
* P<0.05,**P<0.01compared with control group.
0±0.12 0±0.08 Indometnacin 40μmol·L-1+3Gy X-rays radiation 1.57±0.01 19.07±0.1260μmol·L-1+3Gy X-rays radiation 13.85±0.05 32.55±0.0780μmol·L-1+3Gy X-rays radiation 45.89±0.14** 56.13±0.09**100μmol·L-1+3Gy X-rays radiation 25.73±0.08* 32.03±0.0624h 48h Control(0μmol·L-1+3Gy X-rays radiation)Group Inhibitoryrate*
表2 吲哚美辛联合3Gy X线照射作用下HL-60的细胞活力抑制率Tab.2 The inhibitory rates of viabilities of HL-60cells after treated with indometnacin combined with radiation(n=6,,η/%)

表2 吲哚美辛联合3Gy X线照射作用下HL-60的细胞活力抑制率Tab.2 The inhibitory rates of viabilities of HL-60cells after treated with indometnacin combined with radiation(n=6,,η/%)
*P<0.05,**P<0.01compared with control group;△P<0.05compared with indometnacin group;#P<0.05compared with 3Gy X-rays radiation group.
Group Inhibitoryrate 24h 48h Control 15.24±3.21 12.68±3.59 Indometnacin(80μmol·L-1)34.34±2.16 30.02±5.473Gy X-rays radiation 59.42±2.43* 53.13±5.17*Indometnacin(80μmol·L-1)+3Gy X-rays radiation 78.35±4.13*△#75.42±3.91**△#
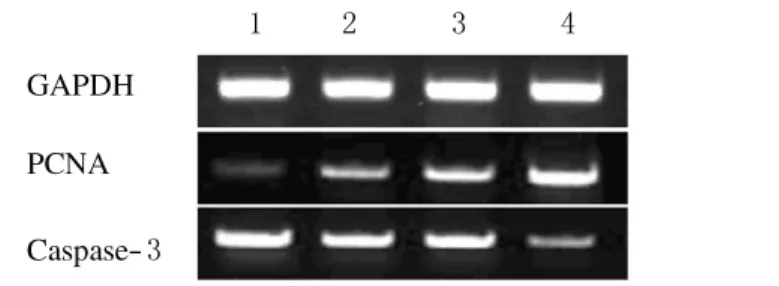
图1 吲哚美辛联合照射作用下HL-60细胞中PCNA和Caspase-3mRNA 的表达Fig.1 The expressions of PCNA and Caspase-3mRNA in HL-60cells after treated with indometnacin combined with radiation
3 讨 论
据统计,白血病约占肿瘤总发病率的3%,是儿童和青年中最常见的一种恶性肿瘤[4-6]。在世界各国中欧洲和北美白血病的发病率最高,其死亡率为3.2~7.4/10万人口。亚洲和南美洲发病率较低,死亡率为2.8~4.5/10万人口。白血病的治疗一直局限于放化疗,但不良反应多,已有文献报道白血病患儿因放疗引起粒细胞趋化、游走、吞噬及灭菌功能降低,感染发生率高。人照射的最低损伤限度为1Gy,而半数致死量(LD50)为4Gy,因此应严格避免急性过量照射引起的细胞损伤[7]。同时放疗还可引起严重的骨坏死,虽然有很多检测指标用以预防,但效果不是十分理想。所以单纯放疗使病情预后差,并严重影响患者的生存质量。吲哚美辛是一种最常见的非甾体抗炎药,文献[8-9]报道:常规服用吲哚美辛可以减轻喉癌以及多种恶性肿瘤的危险性,这可能与其减轻氧化损伤、减少肿瘤血管的再生和营养,降低肿瘤的转移率有关[10-11];且肿瘤患者术后应用吲哚美辛栓可改善细胞免疫功能[12]。相关研究[13]表明:吲哚美辛对抗癌症的机制可能与调节一些凋亡相关因子例如上调p53表达和bax/bcl-2比值或增强cox-2表达及诱发凋亡有关。人类急性T细胞白血病细胞系Jurkat细胞在维甲酰酚胺联合吲哚美辛治疗后通过凋亡诱导因子(apoptosis-inducing factor,AIF)-介导细胞死亡程序诱导细胞死亡[14]。吲哚美辛联合放疗在髋关节成形术后防止异位成骨方面比单独应用吲哚美辛具有更好的效果[15]。
表3 各组HL-60细胞中PCNA和Caspase-3mRNA的表达水平Tab.3 The expression levels of PCNA and Caspase-3mRNA in HL-60cells in various groups(n=6,)
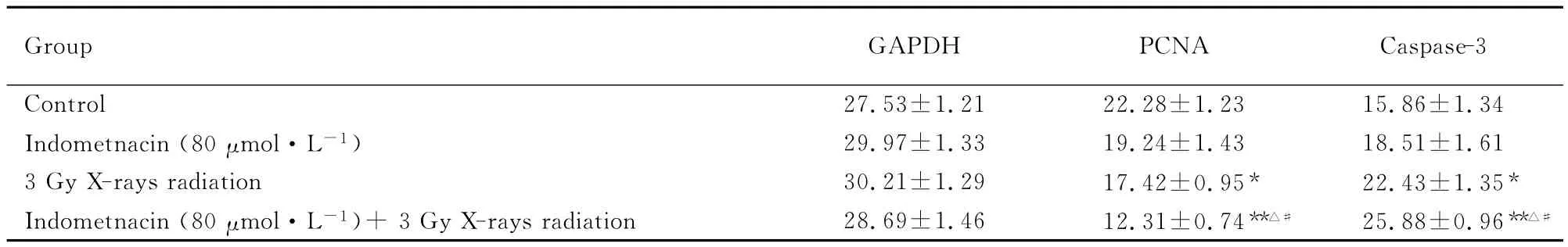
表3 各组HL-60细胞中PCNA和Caspase-3mRNA的表达水平Tab.3 The expression levels of PCNA and Caspase-3mRNA in HL-60cells in various groups(n=6,)
*P<0.05,**P<0.01compared with control group;△P<0.05compared with indometnacin group;#P<0.05compared with 3Gy X-rays radiation group.
Group GAPDH PCNA Caspase-327.53±1.21 22.28±1.23 15.86±1.34 Indometnacin(80μmol·L-1)29.97±1.33 19.24±1.43 18.51±1.613Gy X-rays radiation 30.21±1.29 17.42±0.95* 22.43±1.35*Indometnacin(80μmol·L-1)+3Gy X-rays radiation 28.69±1.46 12.31±0.74**△# 25.88±0.96**△#Control
本实验结果证实:吲哚美辛联合照射处理可明显抑制HL-60细胞的增殖,促进凋亡。实时定量PCR检测显示:核增殖因子PCNA在联合治疗组明显降低,凋亡最后执行因子Caspase-3表达在联合治疗组明显升高,表明吲哚美辛联合照射处理增强了癌症治疗效果。本实验结果提示:吲哚美辛联合照射处理能减轻长期单独照射带来的不良反应,对于白血病的治疗有潜在的应用前景。但具体的作用机制尚未明确,是否还有其他细胞调节因子参与需进一步研究证实。
[1]Harris RE,BeebeDonk J,Doss H,et al.Aspirin,ibuprofen,and other non-steroidal anti inflammatory drugs in cancer prevention:a critical review of non-selective COX2 blockade(review)[J].Oncol Rep,2005,13(4):559-583.
[2]Kralj M,Kopitanovis S,Kovacevic D,et al.Effect of the nonsteroidal anti-inflammatory drug indomethacin on proliferation and apoptosis of coloncarcinomacells[J].Cancer Res Clin Oncol,2001,127(3):173-179.
[3]Li LG,Xu HM.Inducible nitricoxide synthase,nitrotyrosine and apoptosis in gastric adenocarcinomas and their correlation with a poor survival [J].World J Gastroenterol,2005,11(17):2539-2544.
[4]Siegel R,Naishadham D,Jemal A.Cancer statistics[J].CA Cancer J Clin,2012,62(1):10-29.
[5]范宝岩,陈 亮,朱万安,等.HRCT在白血病肺部侵润中的诊断和鉴别诊断[J].中国实验诊断学,2011,15(12):2090-2092.
[6]王祥财,廖长风,张庭龙,等.Real Time PCR监测慢性粒细胞白血病bcr/abl融合基因的临床意义[J].中国实验诊断学,2011,15(10):1657-1659.
[7]Saito T.Acute radiation injury [J].Nihon Rinsho,2012,70(3):415-420.
[8]张连芝,孙吉凤,王少华.吲哚美辛对喉癌Hep-2细胞增殖与iNOS活性的影响[J].吉林大学学报:医学版,2008,34(2):251-253.
[9]Guckenberger M,Kavanagh A,Partridge M.Combining advanced radiotherapy technologies to maximize safety and tumor control probability in stage III non-small cell lung cancer[J].Strahlenther Onkol,2012,188(10):894-900.
[10]Franchi A,Gallo O,Paglierani M,et al.Inducible nitricoxide synthase expression in laryngeal neoplasia:correlation with angiogenesis [J].Head Neck Surg,2002,24(1):16-23.
[11]吕晓红,张 巨,张见影.大剂量一氧化氮合酶抑制剂在局灶性脑缺血中对神经细胞凋亡的影响[J].吉林大学学报:医学版,2004,30(2):270-273.
[12]杜文峰,杨道贵.术后应用吲哚美辛栓对胃肠道肿瘤病人免疫功能的影响[J].肠外与肠内营养,2012,19(1):32-37.
[13]Setia S,Vaish V,Sanyal SN,et al.Chemopreventive effects of NSAIDs as inhibitors of cyclooxygenase-2and inducers of apoptosis in experimental lung carcinogenesis [J].ANZ J Surg,2011,81(12):876-879.
[14]Hojka-Osinska A,Ziolo E,Rapak A,et al.Combined treatment with fenretinide and indomethacin induces AIF-mediated,non-classical cell death in human acute T-cell leukemia Jurkat cells [J].Biochem Biophys Res Commun,2012,419(3):590-595.
[15]Pakos EE,Tsekeris PG,Paschos NK,et al.Combined radiotherapy and indomethacin for the prevention of heterotopic ossification after total hip arthroplasty [J].Strahlenther Onkol,2009,185(8):500-505.
