黄原酸化交联壳聚糖树脂对Ag(Ⅰ)的吸附
2013-11-28张廷安吕国志豆志河张国权
曾 淼,张廷安,吕国志,豆志河,刘 燕,张国权
(东北大学 材料与冶金学院 多金属共生矿生态化利用教育部重点实验室,沈阳 110819)
银作为贵重金属具有独特的物理化学性质,广泛应用于照相、印刷、首饰、医疗等领域.随着世界经济的快速发展,银的消耗量不断增大,世界银储量日益减少[1].从含银废液中回收提取银,既能充分利用银资源,又能保护环境,是值得全世界重视的课题.现有的从废液中回收银的工艺主要有萃取法、置换法、吸附法和离子交换法等[2].壳聚糖是甲壳素的N-脱乙酰基产物[3],其分子上具有活泼氨基和羟基,可作为银离子吸附剂使用[4].另外,壳聚糖本身无毒、生物可降解性好、不易发生二次污染,在废水处理中具有独特优势[5,6].黄原酸化是指在碱性条件下以二硫化碳与醇反应的过程,广泛应用在提高纤维素[7~9]、锯末[10]、淀粉[11]等的吸附能力上.近年来,黄原酸化壳聚糖[12]由于具有较高的吸附性能日益得到关注.黄原酸化壳聚糖是经黄原酸化反应后的一类壳聚糖衍生物,由于其分子中的巯基与贵金属离子具有较小的螯合系数,因此,在贵金属离子的吸附方面有独特优势.本文首次采用微波辐射下制备的黄原酸化交联壳聚糖(XCCTS)对贵金属Ag(Ⅰ)进行了吸附,研究了 pH值和温度对XCCTS吸附性能的影响,并采用FT-IR和XRD对XCCTS吸附Ag(Ⅰ)前后的结构进行了表征,重点考察了XCCTS对水溶液中Ag(Ⅰ)的吸附动力学和热力学过程,计算了热力学参数.
1 实验部分
1.1 主要试剂和仪器
壳聚糖(CTS),脱乙酰度90%;环氧氯丙烷(ECH),分析纯;二硫化碳(CS2),分析纯;硝酸银(AgNO3),优级纯.
PJ21C-B1微波炉(改造),中国美的;SHY-2恒温水浴振荡器,金坛大地;PW3040/60型X射线衍射仪(XRD),荷兰帕纳克;WQF-410傅立叶变换红外光谱仪,北京瑞利;Prodigy全谱直读ICP发射光谱仪,美国利曼.
1.2 黄原酸化交联壳聚糖的合成
1 g壳聚糖粉末分散在100 mL质量分数为3%的NaOH溶液中,加入一定量的环氧氯丙烷,微波下反应3 min,待反应溶液恢复至常温后,过滤,用蒸馏水和乙醇清洗.将所得固体浸入50 mL质量分数为14%的 NaOH溶液中,并加入2 mLCS2,微波下反应3 min,待溶液恢复常温后,过滤,用蒸馏水、乙醇和丙酮清洗,干燥,得到的黄色固体即为所得黄原酸化交联壳聚糖树脂.反应过程中搅拌速度维持600 r/min.黄原酸化交联壳聚糖的结构式如图1所示,其分子上具有可以吸附金属离子的巯基和羟基.

图1 黄原酸化交联壳聚糖的结构式Fig.1 Structural formula of xanthated crosslinked chitosan
1.3 XCCTS对Ag(Ⅰ)的吸附实验
称取 AgNO3,配制并标定 100 mg·L-1Ag(Ⅰ)标准溶液.称取0.01 g黄原酸化交联壳聚糖加入到20 mL Ag(Ⅰ)溶液中,恒温振荡设定时间,采用ICP测定吸附后的Ag(Ⅰ)的质量浓度,根据公式(1)计算交联黄原酸壳聚糖对Ag(Ⅰ)的吸附量:

式中:V为Ag(Ⅰ)溶液的体积,L;m为交联黄原酸壳聚糖的质量,g;C0、C分别为吸附前后 Ag(Ⅰ)的质量浓度,mg·L-1;q为吸附量,mg·g-1.
2 结果与讨论
2.1 XCCTS的表征
图2为XCCTS在微波辐射下对金属离子Ag(Ⅰ)的吸附后的X-射线衍射图.相对于XCCTS的 XRD图谱,吸附 Ag(Ⅰ)后的 XCCTS在10.3(°)处的衍射峰几乎完全消失,20.0(°)处衍射峰的相对强度大幅度下降,形成了代表无定形聚合物的馒头峰.这说明吸附金属离子后的XCCTS的结晶性能降低,无定形程度增强,其对Ag(Ⅰ)吸附作用破坏了高分子链的对称性和规整性,破坏了晶型的结构,其分子内氢键作用减少,分子间的位阻变大,表明壳聚糖与金属离子之间形成了配位键,即Ag(Ⅰ)与XCCTS上的巯基和羟基的配位破坏了能使晶体结构稳定的氢键,导致XCCTS的结晶度下降.

图2 XCCTS吸附Ag(Ⅰ)前后的XRD光谱图Fig.2 XRD spectra of XCCTS before and after adsorption of Ag(Ⅰ)
图3为磺化交联壳聚糖吸附银离子前后的红外光谱图.由XCCTS的红外光谱图中可以看到,波数在3 440 cm-1左右的宽峰为O—H的伸缩振动吸收峰与N—H的伸缩振动吸收峰重叠而成的多重吸收峰;2 922 cm-1和2 881 cm-1处分别为甲基或次甲基的C—H伸缩振动吸收峰;1 660 cm-1处为酰胺的N—H弯曲振动吸收峰,1 160 cm-1处为C=S的伸缩振动吸收峰,1 090 cm-1处为醇的C—O的伸缩振动吸收峰;2 551 cm-1处为巯基的S—H伸缩振动吸收峰,673 cm-1处可能为C—S伸缩振动吸收峰.XCCTS吸附 Ag(Ⅰ)后,2 372 cm-1和 673 cm-1处 的 吸 收 峰 消 失,1 633 cm-1和1 090 cm-1处的吸收峰减小并发生迁移,这说明XCCTS上的羟基和巯基均参与反应,有效吸附了Ag(Ⅰ).

图3 XCCTS吸附Ag(Ⅰ)前后的红外光谱图Fig.3 FT-IR spectra of XCCTS before and after adsorption of Ag(Ⅰ)
2.2 pH值和温度对 XCCTS吸附Ag(Ⅰ)的影响
采用0.1 mol·L-1的 HNO3和质量分数为3%的NaOH调节Ag(Ⅰ)溶液的pH值,在微波辐射下用一定量的XCCTS吸附银溶液10 s,获得了不同pH值下的XCCTS对Ag(Ⅰ)的吸附容量.图4显示了XCCTS对Ag(Ⅰ)的吸附容量随溶液pH值发生的变化,在高酸度的条件下,吸附量随pH值升高而缓慢增大,pH=4时达到最大吸附量49.55 mg·g-1,而在 pH值 >4后吸附量急速下降,仅为23.89 mg·g-1.在较低的pH值条件下,氢离子浓度较高,溶液中Ag(Ⅰ)和H+在XCCTS的S和O位上存在竞争吸附.当溶液的pH升高时,氢离子浓度降低,Ag(Ⅰ)在吸附过程中占优势,优先被吸附,巯基和羟基均参与了与Ag(Ⅰ)的配位作用,形成XCCTS-Ag配合物,大大增加了XCCTS对Ag(Ⅰ)的吸附量.当pH过高时,银离子容易沉淀而且树脂与银离子的电子排斥作用也会使吸附量降低.
在pH=4时,研究了温度对XCCTS吸附容量的影响,结果如图5所示.在20~50℃之间,吸附量由 47.78 mg·g-1增长到 56.15 mg·g-1,吸附量随温度的升高而增长,显示了吸附过程为吸热反应.通常吸附过程包括两种过程,快速扩散和慢速螯合.温度的增长不仅增大了金属离子的扩散速度,使吸附剂获得大面积接触溶液中银离子的机会,还能增加吸附剂上的吸附官能团与银离子的螯合速度.
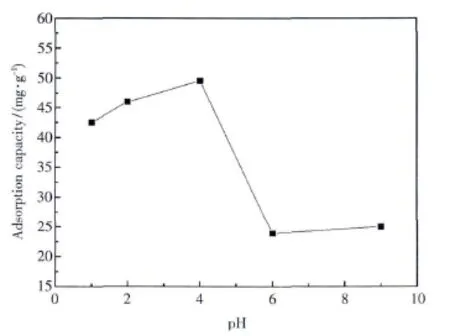
图4 pH值对XCCTS的Ag(Ⅰ)吸附容量的影响Fig.4 Effect of pH value on adsorption capacity of XCCTS for Ag(Ⅰ)
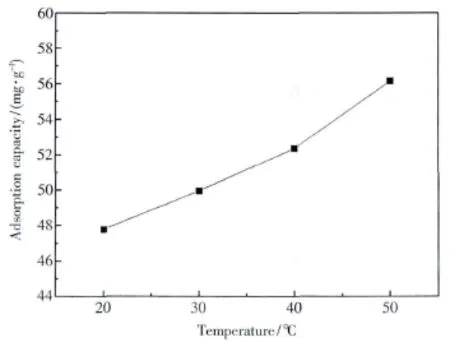
图5 温度对XCCTS的Ag(Ⅰ)吸附容量的影响Fig.5 Effect of temperature on adsorption capacity of XCCTS for Ag(Ⅰ)
2.3 吸附动力学
测定不同温度下不同时间的XCCTS对银离子的吸附量,并采用Lagergren一级速率方程和拟二级速率方程对吸附动力学数据进行分析,通过动力学方程可以评价控制吸附过程中的动力学机理并确定吸附过程的速率常数以及吸附剂对金属离子的平衡吸附量.
Lagergren一级速度方程的线性形式通常表示为:
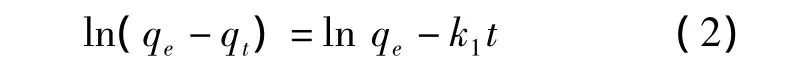
拟二级速率方程的积分方程表达式为:

式(2)和式(3)中,t为吸附时间,min;qt为 t时刻的吸附量,mg·g-1;qe为吸附达平衡时的吸附量,mg·g-1;k1为一级吸附速率常数,min-1;k2为二级吸附速率常数,g·mg-1·min-1.
根据动力学方程(2)和(3)分别对不同温度下的动力学实验数据进行线性回归处理,以ln(qe-qt)对 t作图,以 t·qt-1对t作图,得到相应拟合直线(图6,图7),由直线的斜率和截距可分别求得吸附速率常数和平衡吸附量,结果见表1.拟二级速率方程对实验数据的相关拟合系数相对较高,R2﹥0.99,而且在20~50℃内XCCTS对银的吸附均能用拟二级速率方程拟合.这表明吸附过程可能是化学吸附,贵金属阳离子和吸附剂之间的作用力应为配位螯合作用.虽然Lagergren一级速度方程的拟合系数R2也达到0.97以上,但是所得的平衡吸附时的qe与实际吸附量差距较大,因此认为并不符合一级速率方程.

图6 不同温度下ln(qe-qt)与t的关系曲线Fig.6 ln(qe-qt)-t curves at different temperatures
2.4 吸附等温特性
测定不同温度下不同平衡浓度时XCCTS对银离子的吸附量,并分别采用Langmuir方程和Freundlich方程这两种等温模型对实验得到的吸附等温线数据进行分析.

图7 不同温度下的t/qt与t的关系Fig.7 t/qt-t curves at different temperatures
式(4)和式(5)中,qe为吸附平衡时的吸附量,mg·g-1;q∞为最大吸附量,mg·g-1;Ce为吸附平衡时的质量浓度,mg·L-1;KL为 Langmuir吸附平衡常数,L·mg-1;KF为Freundlich吸附平衡常数,g-1·L1/n·mg(1-1/n);n 为 Freundlich 常数.
分别以qe-1对作图,以 lnqe对 lnCe作图,用Langmuir方程和Freundlich方程对平衡吸附实验数据进行线性回归处理,得到相应拟合直线(图8,图9),由直线的斜率和截距求得吸附平衡常数和最大吸附量,结果见表2.由拟合相关系数可见,吸附过程既符合Langmuir方程又符合Freundlich方程,但Langmuir拟合相关系数相对更大.吸附过程可能主要为单分子层吸附,吸附剂的表面具有均匀的吸附位.KL值随温度上升而增大,表明此吸附过程为吸热过程,属于化学吸附.最大吸附量在50℃时获得,为58.14 mg·g-1.Freundlich常数 n介于1 ~10之间,这表明吸附容易进行,XCCTS与银离子间的相互作用较强.
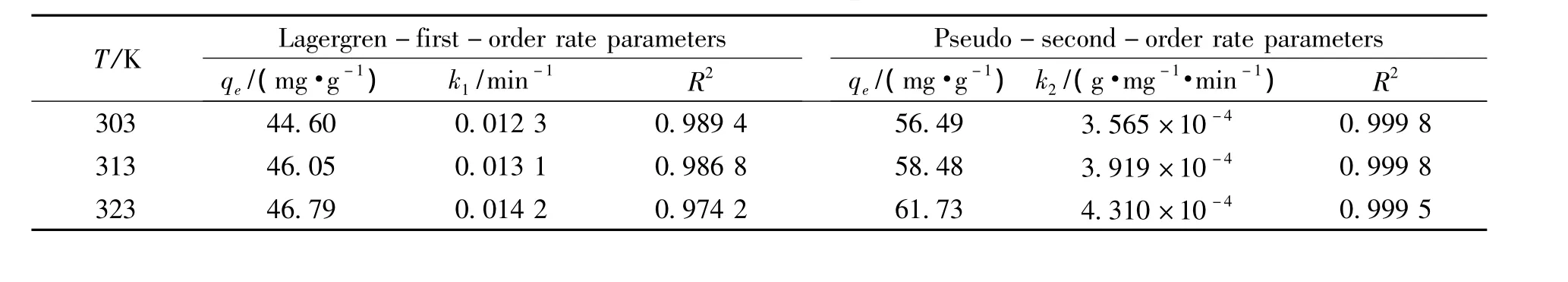
表1 不同温度下XCCTS对Ag(Ⅰ)吸附的Lagergren一级和拟二级动力学参数Table 1 Lagergren-first-order and pseudo-second-order rate parameters for the adsorption of Ag(Ⅰ)ions on XCCTS at different temperatures

图8 不同温度下对XCCTS吸附Ag(Ⅰ)的Langmuir拟合Fig.8 Langmuir plots for the adsorption of Ag(Ⅰ)on XCCTS at different temperatures

图9 不同温度下对XCCTS吸附Ag(Ⅰ)的Freundlich拟合Fig.9 Freundlich plots for the adsorption of Ag(Ⅰ)on XCCTS at different temperatures

表2 不同温度下XCCTS吸附Ag(Ⅰ)过程的Langmuir和Freundlich等温线参数Table 2 Langmuir and Freundlich isotherm parameters for the adsorption of Ag(Ⅰ)on XCCTS at different temperatures
2.5 热力学参数
在吸附过程中,通常采用热力学参数判定吸附是否可以自然发生,本文通过不同温度下的Langmuir常数KL来获得吸附过程的热力学参数,标准吉布斯自由能ΔGΘ,标准焓变ΔHΘ和标准熵变ΔSΘ可通过公式(6)和(7)获得.

以ln KL与1/T作图,并进行线性拟合,通过斜率和截距分别计算ΔHΘ和ΔSΘ(见图10).表3列出了标准吉布斯自由能变ΔGΘ,标准焓变ΔHΘ和标准熵变ΔSΘ的值.30~50℃下,ΔGΘ均为负值,这说明XCCTS对银离子的吸附过程是自发的;ΔHΘ>0显示吸附是吸热的,吸附能力随着环境温度的升高而增强.
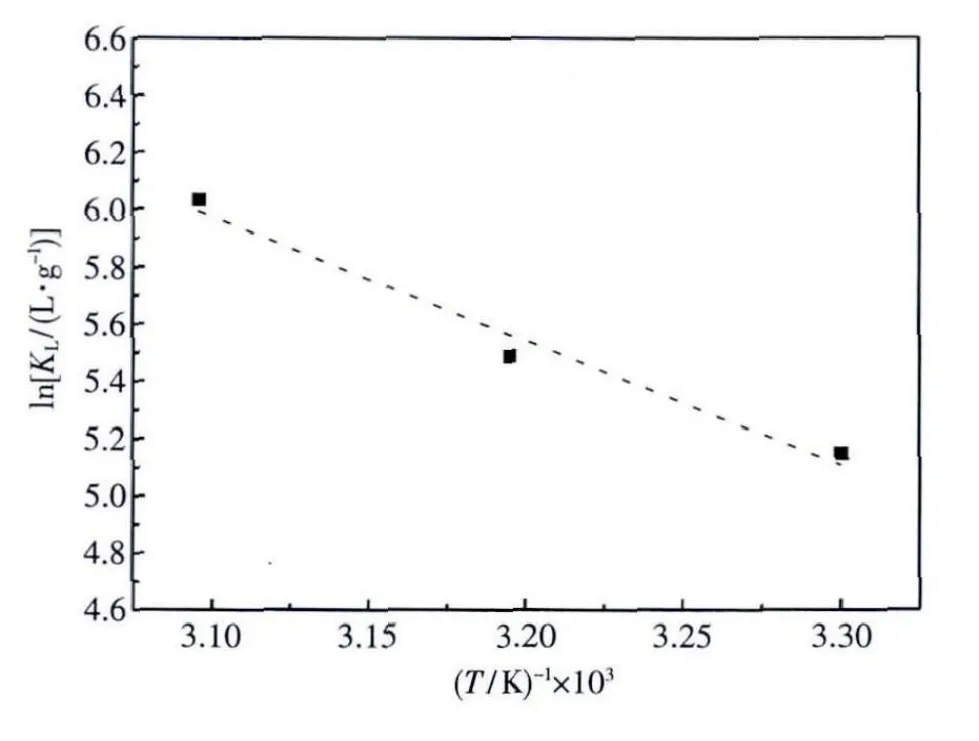
图10 XCCTS吸附Ag(Ⅰ)的ln KL-1/T拟合线Fig.10 Plots of ln KL-1/T for the adsorption of Ag(Ⅰ)on XCCTS

表3 XCCTS对Ag(Ⅰ)吸附的热力学参数Table 3 Thermodynamic parameters for the adsorption of Ag(Ⅰ)on XCCTS
3 结语
在黄原酸化交联壳聚糖树脂(XCCTS)对水溶液中Ag(Ⅰ)的吸附过程中,pH值和温度对XCCTS吸附 Ag(Ⅰ)有显著影响,pH=4.0和50℃时可获得最大吸附量.吸附动力学分析表明吸附过程符合拟二级速率方程,XCCTS对Ag(Ⅰ)的吸附为配位作用;热力学分析表明实验数据既符合Langmuir等温方程又符合Freundlich等温方程,对用Langmuir方程拟合的相关系数相对更大,吸附过程可能主要为单分子层吸附,吸附剂的表面具有均匀的吸附位.在20~50℃下吸附过程是自发的吸热过程,属于化学吸附,XCCTS与银离子间的相互作用较强.
[1]黎鼎鑫,王永录.贵金属提取与精炼[M].长沙:中南大学出版社,2003:1-30.
(Li Dingxin,WangYonglu. Extractionand refiningof precious metals[M].Changsha:Central South University Press,2003:1 -30.)
[2]邱定蕃,徐传华.有色金属资源循环利用[M].北京:冶金工业出版社,1993:4-12.
(Qiu Dingfan,Xu Chuanhua.Recycling of non - ferrous metal resources[M].Beijing:metallurgical industry press,1993:4 -12.)
[3]蒋挺大.壳聚糖[M].北京:化学工业出版社,2001:14-67.
(Jiang T D.Chitosan[M].Beijing:Chemical Industry Press,2001:14 -67.)
[4] Fan L,Luo C,Lv Z,et al.Removal of Ag+from water environment usinga novel magneticthiourea-chitosan imprinted Ag+[J].Journal of hazardous materials,2011,194:193-201.
[5] Vama A,Deshpande S,Kebbedy J.Metal complexation by chitosan and its derivatives:a review[J].Carbohydrate Polymers,2004,55(1):77-93.
[6]Guibal E.Interactions of metal ions with chitosan-based sorbents:a review [J]. Separation and Purification Technology,2004,38(1):43-74.
[7]Wood J D,Oster J D.The effect of cellulose xanthate and polyvinyl alcohol on infiltration, erosion,and crusting at different sodium levels[J].Soil science,1985,139(3):243-249.
[8]Menefee E,Hautala E.Soil stabilisation by cellulose xanthate[J].Nature,1978,275(5680):530 -532.
[9]钟长庚,周冬京.用纤维素黄原酸酯去除硫酸锌浸出液中的重金属杂质[J].应用化学,2002,19(3):298-300.
(Zhong Changgeng,Zhou Dongjing.Removal of heavy metal impurities from zinc sulphate solutions with cellulose xanthate[J].Chinese Journal of applied chemistry,2002,19(3):298 -300.)
[10]孙春宝,邢奕,李秋华,等.木屑黄原酸酯的研制及在重金属废水处理中的应用[J].北京科技大学学报,2006,28(2):108-112.
(Sun C B,Xing Y,Li Q H,et al.Preparation of sawdust cellulose xanthate for the treatment of heavy metal wastewater[J].Journal of University of Science and Technology Beijing,2006,28(2):108 -112.)
[11] Sanjeev C,Tare V.Heavy metal- soluble starch xanthate interactions in aqueous environments[J].Journal of Applied Polymer Science,1999,71(8):1325 -1332.
[12] Zhu Y H,Hu J,Wang J L.Competitive adsorption of Pb(II),Cu(II)and Zn(II)onto xanthate-modified magnetic chitosan[J].Journal of Hazardous Materials,2012,221 - 222:155-161.
