透骨草提取物对人宫颈癌Hela细胞PI3k、Akt、mTOR蛋白表达的影响①
2013-11-28于秀艳王文龙刘晓峰曾常茜
于秀艳 王文龙 刘晓峰 曾常茜
(吉林省肿瘤医院,长春130012)
透骨草(Phryma Leptostachya L.var.asiatica Hara)为透骨草科植物的干燥全草入药,我们的前期研究发现,透骨草提取物对人宫颈癌细胞Hela细胞具有显著的增殖抑制作用,并可诱导Hela细胞凋亡,但其相关的分子机制尚未完全清楚[1,2]。本实验采用Western blot方法观察透骨草提取物对Hela细胞PI3k、Akt、mTOR蛋白表达的影响,进一步探讨透骨草提取物诱导Hela细胞凋亡的分子机制,旨在为透骨草提取物抗宫颈癌的进一步研究和开发提供实验依据。
1 材料与方法
1.1 药品、试剂及仪器 透骨草采自辽宁金州大黑山,经王心毓老先生鉴定为透骨草科植物(Phryma Leptostachya L.var.asiatica Hara);人宫颈癌 Hela 细胞购自吉林省肿瘤研究所;鼠抗人 PI3k、鼠抗人Akt、鼠抗人mTOR抗体、鼠抗人 β-actin抗体购自Cell Signaling Technology公司;RPMI1640、小牛血清和胰蛋白酶为美国Gibco公司产品;RIPA裂解液、超敏ECL化学发光试剂盒购自江苏碧云天生物技术有限公司;PVDF膜为Sigma公司产品;蛋白电转仪、垂直电泳仪、凝胶成像系统为美国Bio-Rad公司产品;DU640紫外分光光度计为美国Beckman公司产品。
1.2 透骨草提取物制备方法 加热回流提取法制备透骨草乙醇提取物:取干燥透骨草50 g,加8倍量75%乙醇,提取2小时,过滤,滤液水浴浓缩成干膏。
1.3 Hela细胞的培养和实验分组 Hela细胞用10%小牛血清的RPMI1640培养液,在37℃ 5%CO2的条件下培养,胰酶消化传代。待Hela细胞生长至对数生长期,进行实验。实验分组:透骨草提取物组加入终浓度为100 μg/ml透骨草提取物,对照组加入等体积含10%小牛血清的RPMI1640培养液。
1.4 Western blot方法检测 Hela 细胞 PI3k、Akt和mTOR蛋白表达水平 透骨草提取物组和对照组Hela细胞在37℃ 5%CO2的条件下培养48小时,分别收集透骨草提取物组和对照组的Hela细胞,PBS洗涤,加入细胞裂解液和蛋白酶抑制剂混匀,冰上裂解1小时,4℃12 000 r/min离心20分钟。收集上清,595 nm波长下用分光光度计测定样品OD值,根据OD值计算Hela细胞提取物的蛋白浓度。用细胞裂解液将透骨草提取物组和对照组蛋白稀释至等浓度,与2×上样缓冲液1∶1混合,100℃煮沸5分钟使蛋白变性。分别取透骨草提取物组和对照组蛋白60 μg,10%SDS-PAGE 凝胶电泳(80 V,30 分钟,150 V,90分钟),转至 PVDF 膜(200 mA,4℃,1小时)。用50 g/L脱脂牛奶封闭2小时。分别加入鼠抗人 PI3k、Akt、mTOR 抗体(1∶1 000)室温孵育 2 小时,TBST洗涤3次。分别加入羊抗鼠IgG-HRP抗体(1∶5 000)室温孵育2小时,TBST洗涤3次。加入ECL试剂A和B等体积混合,1分钟后将PVDF膜蛋白面朝下与此混合液充分接触。1分钟后,将膜移至保鲜膜上,去尽残液,曝光,显影,定影。胶片用凝胶图像处理系统分析目标带的分子量和净光密度值。
2 结果
透骨草提取物对Hela细胞PI3k、Akt、mTOR蛋白水平表达的影响结果见图1:PI3k蛋白分子量为85 kD,结果可见在85 kD位置出现阳性条带,而且与对照组相比,100 μg/ml透骨草提取物作用Hela细胞后,能够下调PI3k蛋白的表达(P<0.05);Akt蛋白分子量为60 kD,结果可见在60 kD位置出现阳性条带,而且与对照组相比,100 μg/ml透骨草提取物作用Hela细胞后,能够下调Akt蛋白的表达(P<0.05);mTOR蛋白分子量为289 kD,结果可见在289 kD位置出现阳性条带,而且与对照组相比,100 μg/ml透骨草提取物作用Hela细胞后,能够下调mTOR蛋白的表达(P<0.05)。上述结果表明透骨草提取物可以抑制Hela细胞PI3k、Akt和MTOR蛋白表达。
3 讨论
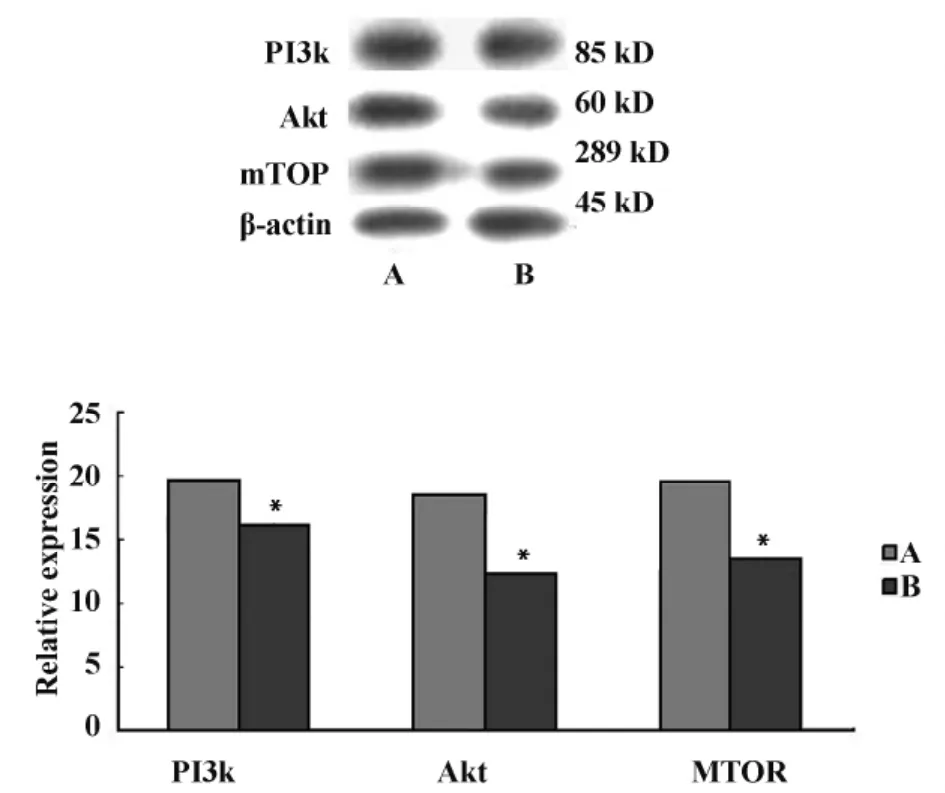
图1 透骨草提取物对Hela细胞PI3k、Akt、mTOR蛋白水平表达的影响Fig.1 Effect of Phryma Leptostachya L.var.asiatica Hara on the expressions of PI3k,Akt and mTOR proteins in Hela cells
越来越多的研究发现,PI3k、Akt和mTOR蛋白在宫颈癌的发生中起重要作用。磷脂酰肌醇-3羟基激酶(PI3k)是磷脂激酶家族中的重要成员,是由一个p110催化亚单位和一个p85调节亚单位组成的异源二聚体。Zhang等[3]报道宫颈癌细胞 PI3k蛋白表达显著增加。Jung等[4]研究发现8-(Tosylamino)喹啉能通过PI3k抑制宫颈癌进展。Wang等[5]研究发现一种19 kD磷蛋白 Stathmin能通过PI3k蛋白影响三氧化砷诱导的人宫颈癌细胞凋亡。Cui等[6]研究发现 MiR-125b能通过作用于 PI3kδ亚单位抑制宫颈癌细胞生长、促进宫颈癌细胞凋亡。上述研究表明PI3k蛋白与多种药物诱导宫颈癌细胞凋亡有关。本实验将100 μg/ml透骨草提取物作用于Hela细胞,首次发现透骨草提取物能够下调Hela细胞PI3k蛋白表达,表明PI3k蛋白可能与透骨草提取物诱导Hela细胞凋亡有关。
Akt是位于PI3k下游的一个重要丝苏氨酸激酶,是促进细胞生存和维持正常功能的关键信号分子。PI3k能特异性地催化磷脂酰肌醇3-位羟基磷酸化产生具有第二信使作用的磷酸化磷脂酰肌醇三磷酸(PIP3)。PIP3可与细胞内含有PH结构域的信号蛋白Akt和磷酸肌醇依赖性蛋白激酶1(PDKl)结合,促使PDKl磷酸化Akt蛋白的Ser308,从而导致Akt的活化[7]。Paul等[8]报道白屈莱碱通过可以通过AKT蛋白促进人宫颈癌HeLa细胞凋亡。Zhu等[9]3,3'-二吲哚基甲烷对人宫颈癌细胞的凋亡诱导作用与AKT通路有关。Singh等[10]研究报道茶多酚诱导人宫颈癌细胞细胞凋亡与抑制Akt活化有关。Lalaoui等[11]研究发现 TRAIL-R4通过 Akt促进人宫颈癌Hela增殖,抑制Hela细胞凋亡。由此可见Akt蛋白与多种药物诱导宫颈癌细胞凋亡有关。本实验将100 μg/ml透骨草提取物作用于Hela细胞,首次发现透骨草提取物能够下调Hela细胞Akt蛋白表达,表明Akt蛋白可能与透骨草提取物诱导Hela细胞凋亡有关。
mTOR是一种不典型的丝氨酸/苏氨酸激酶,属于PIKK家族成员,分子量大小为289 kD。mTOR激活后能通过影响核糖体S6蛋白激酶和真核细胞始动因子4E结合蛋白这两个蛋白合成的关键调节因子来影响细胞的生长和分化。Akt可直接活化mTOR蛋白从而影响宫颈癌细胞的存活和增殖[12]。Li等[13]研究发现mTOR抑制剂 AZD8055能抑制宫颈癌细胞增殖。Yih等[14]研究发现抑制Akt则能促进三氧化二砷诱导的宫颈癌细胞凋亡。这些研究提示mTOR蛋白与多种药物诱导宫颈癌细胞凋亡有关。本实验将100 μg/ml透骨草提取物作用于Hela细胞,首次发现透骨草提取物能够下调Hela细胞mTOR蛋白表达,表明mTOR蛋白可能与透骨草提取物诱导Hela细胞凋亡有关。
综上,透骨草提取物诱导Hela细胞凋亡可能通过PI3k/Akt/mTOR通路起作用,这为透骨草提取物抗宫颈癌作用的研究提供了理论和实验依据。有关PI3k/Akt/mTOR信号通路的调控机制很复杂,还有待于更深入的研究。
1 曾常茜,高 松,沈 阳et al.透骨草提取物对肿瘤细胞体外增殖的影响[J].辽宁中医杂志,2009;11(36):1952-1954.
2 于秀艳,曾常茜,高 松et al.透骨草提取物诱导人宫颈癌Hela细胞凋亡及其相关机制研究[J].中国免疫学杂志,2012;7(7):608-610.
3 Zhang X Y,Zhang H Y,Zhang P N et al.Elevated phosphatidylinositol 3-kinase activation and its clinicopathological significance in cervical cancer[J].Eur J Obstet Gynecol Reprod Biol,2008;139(2):237-244.
4 Jung Y,Yi Y S,Yoo D S et al.8-(Tosylamino)quinoline inhibits tumour progression through targeting phosphoinositide-3-kinase/Akt pathway[J].Pharmazie,2013;68(2):146-152.
5 Wang X,Ren J H,Lin F et al.Stathmin is involved in arsenic trioxide-induced apoptosis in human cervical cancer cell lines via PI3k linked signal pathway[J].Cancer Biol Ther,2010;10(6):632-643.
6 Cui F,Li X,Zhu X et al.MiR-125b inhibits tumor growth and promotes apoptosis of cervical cancer cells by targeting phosphoinositide 3-kinase catalytic subunit delta[J].Cell Physiol Biochem,2012;30(5):1310-1318.
7 Fayard E,Xue G,Parcellier A et al.Protein kinase B(PKB/Akt),a key mediator of the PI3k signaling pathway[J].Curr Top Microbiol Immunol,2010;346:31-56.
8 Paul A,Bishayee K,Ghosh S et al.Chelidonine isolated from ethanolic extract of Chelidonium majus promotes apoptosis in HeLa cells through p38-p53 and PI3k/AKT signalling pathways[J].Zhong Xi Yi Jie He Xue Bao,2012;10(9):1025-1038.
9 Zhu J,Li Y,Guan C et al.Anti-proliferative and pro-apoptotic effects of 3,3 '-diindolylmethane in human cervical cancer cells[J].Oncol Rep,2012;28(3):1063-1068.
10 Singh M,Singh R,Bhui K et al.Tea polyphenols induce apoptosis through mitochondrial pathway and by inhibiting nuclear factor-kappaB and Akt activation in human cervical cancer cells[J].Oncol Res,2011;19(6):245-257.
11 Lalaoui N,Morlé A,Mérino D et al.TRAIL-R4 promotes tumor growth and resistance to apoptosis in cervical carcinoma HeLa cells through AKT[J].PLoS One,2011;6(5):e19679.
12 Ji J,Zheng P S.Activation of mTOR signaling pathway contributes to survival of cervical cancer cells[J].Gynecol Oncol,2010;117(1):103-108.
13 Li S,Li Y,Hu R et al.The mTOR inhibitor AZD8055 inhibits proliferation and glycolysis in cervical cancer cells[J].Oncol Lett,2013;5(2):717-721.
14 Yih L H,Hsu N C,Wu Y C et al.Inhibition of AKT enhances mitotic cell apoptosis induced by arsenic trioxide[J].Toxicol Appl Pharmacol,2013;267(3):228-237.