谷氨酰胺转胺酶在毕赤酵母菌的初步表达
2013-11-26何冬兰王亚南
何冬兰,叶 程,王亚南,覃 桂
(中南民族大学生命科学学院,武汉430074)
20世纪90年代,国外学者首次通过微生物发酵获得谷氨酰胺转胺酶[1],掀起了该酶的生产热潮,微生物谷氨酰胺转胺酶(MTG),由于其在分子内或分子间特殊的交联作用,在食品、医疗、纺织等领域有广泛的应用,近年来对谷氨酰胺转胺酶的研究日益激烈,研究方向从该酶的应用领域逐步转向基因调控层面,探究提高该酶表达量或酶活性的方法.王坤等[2]将转谷氨酰胺酶酶原的基因序列进行密码子优化,降低其GC含量,提高了它在大肠杆菌中的表达水平.Marx C K等[3]利用随机突变技术研究重组谷氨酰胺转胺酶耐热稳定性和热敏感变体.
通过基因工程的方法可提高MTG酶活力.由于MTG在大肠杆菌中表达时会产生无活性的包涵体,需复性才能产生有活性的蛋白[4],故MTG在原核中表达存在较大的缺陷.毕赤酵母是真核生物,能加工表达蛋白,本实验构建了带有MTG基因的新型质粒pPIC3.5 k-MTG转入毕赤酵母中诱导表达,直接产生有活性的目的蛋白,为解决MTG生产成本过高、产量不能满足食品工业需求等实际问题提供初步依据.
1 材料与方法
1.1 材料和试剂
重组菌株pPIC3.5k-MTG/DH5α为本实验室构建,Pichia GS115由中南民族大学生物工程实验室提供.根据Streptomyces sp.H197基因序列,设计带酶切位点的上游引物(BamHI:CGTGGATCCGCCAGCGGCGGCGACGGGGAAA)和下游引物(EcoR I:CGGAATTCTTACGGCCAGCCCTGCTT),重组质粒PCR鉴定引物合成,引物序列如下:5'AOX1 Primer GACTGGTTCCAATTGACAAGC;3'AOX1 Primer GCAAATGGCATTCTGACATCC.
ExTaq酶、限制性内切酶EcoR I和 BamH I、蛋白marker(Takara公司),DNA Marker(BBI公司),凝胶回收试剂盒(Axygen公司),G418、D-山梨醇、生物素(Amrecso,进口分装).其他试剂均为进口或国产分析纯.
1.2 方法
1.2.1 重组质粒pPIC3.5k-MTG的提取、检测和线性化
挑取重组菌pPIC3.5k-MTG/DH5α单菌落接种到2 mL含有适当抗生素的低盐LB培养基中,于37℃剧烈摇荡下培养过夜[5].采用碱裂解法提取重组质粒.提取的重组质粒经0.8%凝胶电泳检测后,-20℃备用.PCR检测体系为25 μL,双酶切检测体系为10μL,37℃酶切4 h,2种检测结果皆用 SDSPAGE凝胶电泳检测[6].对重组质粒用Sac I酶切线性化,体系为 20 μL,含 10 × L buffer 2 μL,Sac I 1 μL,重组质粒 pPIC3.5k-MTG 8 μL,ddH2O 9 μL,37℃反应4h.反应完毕后,SDS-PAGE电泳检测回收,质粒存于-20℃备用.
1.2.2 毕赤酵母感受态细胞的转化
将80 μL毕赤酵母感受态细胞置于冰上,加入10μL回收的线性化重组质粒,冰上放置20 min,电击转化(2.0 kV,5 ms),加入1 mL冰预冷的山梨醇溶液将菌体混匀,转至1.5 mL EP管中.涂布MD平板上,每个平板 600 μL,30℃ 培养,直至单菌落出现[7,8].
1.2.3 Muts和 Mut+验证
将转化子分别点种于MM和MD培养基中,在MD平板正常生长而在MM平板上生长很小或不长的菌株为Muts型.
1.2.4 PCR 鉴定重组子
挑取单菌落于2 mL YPD培养基中30℃摇床培养过夜,收集菌体采用“煮-冻-煮”法提取酵母基因组,利用目的片段上游引物和下游引物加5'AOX1 Primer各配成25 μL体系PCR,含10×PCR反应缓冲液(含 Mg2+)2.5 μL,dNTP(10 mmol/L)0.5 μL,上下游引物(20 μmol/L)各 0.5 μL,Ex-Taq 酶(2.5 U/μL)0.5 μL,总 DNA 1.0 μL.检测目的片段是否插入和插入方向是否正确(体系同上).反应完毕后用0.8%琼脂糖凝胶电泳检测.
1.2.5 Muts表型重组酵母的诱导表达
挑选一单菌落,置于装有25 mL BMGY培养基的250 mL摇瓶中,于28~30℃,250~300 r/min培养至OD600=2~6(16~18 h),室温下1500~3000 g离心5 min,收集菌体,用BMMY重悬菌体(约100 mL),所得的菌液分别置于100 mL的摇瓶中,每瓶10mL,用双层纱布或粗棉布封口,于28~30℃,250~300 r/min摇床上继续生长.每24 h向各培养基中添加100%甲醇至终浓度为1.0%,培养96 h后分别取菌液样品1mL置于1.5 mL EP管中,14000 r/min离心 2~3 min,分别收集菌体.采用 SDSPAGE鉴定重组蛋白的表达,分析目的蛋白的表达量,取样时间0,24,48,72,96 h.
1.2.6 蛋白的检测、纯化和酶活测定
将取样用蜗牛酶破壁处理离心收集上清,加入上样缓冲液沸水浴5 min,离心.取20 μL点样,浓缩胶稳压90 V,25 min.分离胶稳压120V,60 min.电泳后剥胶,将凝胶小心放入固定液中固定15 min,再放入考马斯亮蓝染色液浸泡,室温水平摇床摇1~2 h.将凝胶浸泡入考马斯亮蓝脱色液中,室温水平摇床摇2~3 h,其间更换脱色液3~4次,观察蛋白电泳结果.将收集的样品装至透析袋1/3,每8 h更换一次透析液.更换3次后离心收集沉淀,透析后样品SDS-PAGE检测效果并利用 Grosswicz比色法[9]测定酶活:以N-a-CBZ-Gln-Gly为作用底物,以L-谷氨酸γ-单羟胺酸(氧肟酸)作标准曲线.一个单位MTG酶活单位(U/mL)定义为在37℃、pH 6.0的条件下反应l min生成1 mol氧肟酸的量.
2 结果
2.1 提取的重组质粒及验证
从培养的重组菌pPIC3.5k-MTG/DH5α提取重组质粒,用1%琼脂糖凝胶电泳,PCR和酶切验证,由图1可知提取的重组质粒大小约为10kb.
2.2 重组质粒的验证
对重组质粒鉴定采用上游引物和3'AOX1进行PCR得到位于1.5 kb附近的片段(见图2中7~10),证明重组质粒构建成功且方向正确.将提取的重组质粒进行EcoR I和BamH I双酶切,得到位于9 kb附近的pPIC3.5k质粒和1.2 kb附近的目的片段(见图3),进一步验证重组质粒构建成功.
2.3 重组质粒线性化
对重组质粒经行线性化,结果见图4,线性化后的重组质粒位于10 kb处左右,验证pPIC3.5k质粒中带有目的片段.
2.4 重组子Muts验证及PCR鉴定

图1 重组质粒pPIC3.5k/MTG电泳结果Fig.1 electrophoresis results of recombinant plasmids pPIC3.5k/MTG
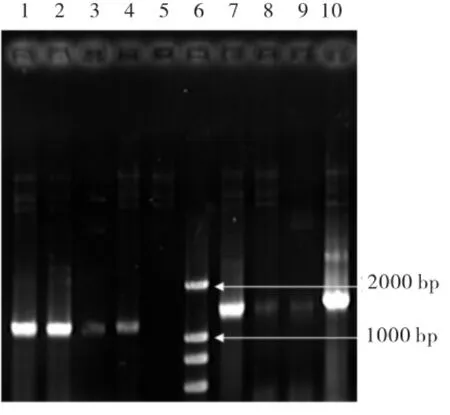
图2 重组质粒进行PCR验证结果Fig.2 PCR identification of recombinant plasmids

图3 对重组质粒进行双酶切验证结果Fig.3 Restriction identification of recombinant plasmid
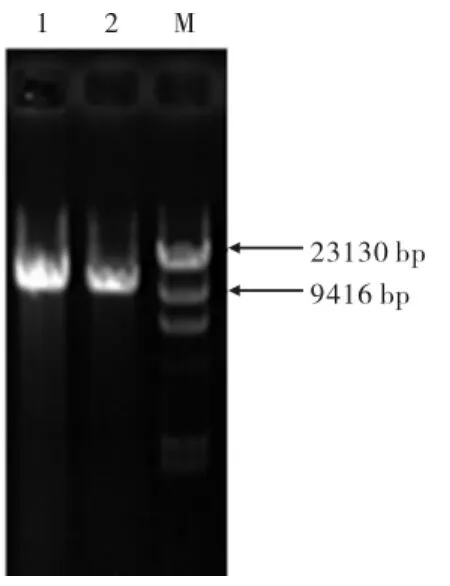
图4 重组质粒线性化验证Fig.4 Linearized identification of recombinant plasmid
将平板上的转化子接种到MM和MD培养基上,经过3d培养后,发现MM平板上的单菌落大于MD平板上的菌落,所以确定转化子为Muts型(见图5).对重组子进行上游引物+3’AOX进行PCR验证得到了目的片段,验证了重组子中插入了目的序列并且插入方向正确(见图6).

图5 重组子Muts的鉴定Fig.5 Identification of recombinant Muts

图6 重组子PCR鉴定结果Fig.6 PCR identification of recombinant
2.5 SDS-PAGE胶检测结果
通过SDS-PAGE电泳检测MTG重组蛋白位于37~50 kD之间(如图7),约在47 kD处,说明诱导表达出了目的蛋白.经TotalLab 2.0软件分析,利用1%甲醇诱导72 h后蛋白表达量最大.
2.6 透析纯化
表达蛋白透析纯化后结果由表8可见蛋白经透析纯化后蛋白量明显增加.

图7 不同诱导时间MTG表达的SDS-PAGE电泳分析Fig.7 Analysis of MTG protein by SDS-PAGE at different induction time

图8 透析纯化结果Fig 8 Results of dialysis purification
2.7 酶活的测定结果
由图8结果可知,蛋白样品经透析纯化后,经Total Lab 2.0凝胶分析软件分析蛋白浓度增加了2.35倍,将纯化后的蛋白测其 OD492=0.0181,稀释后据酶活计算公式得酶活(发酵液)为0.5013U/mL.
3 讨论
巴斯德毕赤酵母表达系统是近年来国内外广泛使用的一种新型表达系统,该表达系统除具有真核表达系统所具有的特点外,还具有成本低、产量高和利于规模化生产等优点[9].故将MTG基因转入毕赤酵母中进行表达直接产生有活性的目的蛋白,解决目前转谷氨酰胺酶生产成本过高、产量不能满足食品工业需求等问题,促进转谷氨酰胺酶的产业化生产与其在食品等工业中的广泛应用,透析纯化时pH要调到离蛋白样品等电点远些,防止产生沉淀,本实验成功获得含有目的基因的重组毕赤酵母菌并测定酶活,利用1%浓度甲醇对酵母菌表达微生物谷氨酰胺转胺酶进行诱导纯化后,目的蛋白浓度提高了2.35倍,酶活达到0.5013U/mL.为进一步优化重组菌表达条件,纯化蛋白和提高酶活研究进行了前期工作,为探索开发全新的谷氨酰胺转胺酶提供了客观的实验依据.
[1]Yan Guoliang,Du Guocheng,Li Yin,et al.Enhancement of microbial transglutaminase production by Streptoverticillium mobaraense:application of a two-stage agitation speed control strategy[J].Process Biochem,2005,40(2):963-968.
[2]王 坤,杨慧林,王 斌,等.转谷氨酰胺酶酶原在大肠杆菌中的重组优化表达[J].食品工业科技.2012,33(7):181-183,187.
[3]Marx C K,Hertel T C,Pietzsch M.Random mutagenesis of a recombinant microbial transglutaminase for the generation of thermostable and heat-sensitive variants[J].J Biotechnol,2008,136(3/4):156-162.
[4]何冬兰,张 莹,彭宝玉.重组谷氨酰胺转胺酶基因的原核表达研究[J].中南民族大学学报:自然科学版,2010,29(1):32-36.
[5]陈 莹,陈 菁,刘树滔,等.PTD2SOD融合蛋白的毕赤酵母表达载体的构建和表达[J].海峡药学,2007,19(7):10-12.
[6]丛 敏,靖学芳,刘振龙,等.pPICZα-synBPIm600酵母表达载体的构建和鉴定[J].首都医科大学学报,2004,25(1):35-39.
[7]Daly R,Hearn M T.Expression of heterologous proteins in pichia pastoris:a useful experimental tool in protein engineering and production[J].J Mol Recognit,2005,18(2):119-138.
[8]Li S,Sing S,Wang Z.Improved expression of Rhizopus oryzae α-amylase in the methylotrophic yeast pichia pastoris[J].Protein Expres Purif,2011,79(1):142-148.
[9]Tojo N,Miyagi I,Miura M,et al.Recombinant human fibrinogen expressed in the yeast pichia pastoris was assembled and biologically active[J].Protein Expres Purif,2008,59(2):289-296.
