铜离子对PrP 转基因线虫的影响
2013-11-24朱淼高跃李忠义鞠传静孟轲音王雄郝雯丽万家余陈志宝
朱淼,高跃,李忠义,鞠传静,3,孟轲音,王雄,郝雯丽,万家余,陈志宝
(1.黑龙江八一农垦大学生命科学技术学院,大庆 163319;2.军事医学科学院军事兽医研究所;3.吉林大学第四医院;4. 吉林大学农学部畜牧兽医学院)
当Prion 朊蛋白感染机体,我们称海绵状脑病或者朊病毒疾病。朊病毒疾病是具有传染性及致命性的一种神经系统变性混乱疾病,细胞内的朊蛋白(PrPC) 发生错误折叠后会转化为朊蛋白的亚型(PrPSC)[1],其组织病理学表现为:中枢神经会发生海绵性病变及淀粉样沉淀,并伴有空泡出现,胶质细胞增生等现象。PrP 的基因(PRNP)有20 多个突变位点,该位点突变后与朊病毒神经系统疾病密切相关。其中,PRNP 基因的102 位点突变(P102L)可导致吉斯综合征(Gerstmann-Straussler syndrome,GSS)的发生[2-4]。目前,对铜离子与朊蛋白的研究已经有了一些进展,Morrillas[5]等发现PrP 在细胞膜上有特定的构想,能与铜离子特异性结合;Pauly 和Harris 发现铜离子可以调节细胞膜上的PrP 的含量[6];Qin 等[7]通过实验发现当铜离子达到一定浓度时,能够促进PrPC向PrPSC转化,表现为β 折叠变多以及抗蛋白水解酶(PK)能力提高,由此可以推断铜离子达到一定浓度时,可能是引起PrP 致病的重要因素之一。
新秀丽线虫是已经被研究最为清楚的模型动物之一,其对周围环境变化较为敏感。由于其作为独立的个体生物,具有结构简单,生命周期短,在实验室易于培养等优点,使其成为国内外研究神经损伤模型的首选,例如帕金森疾病模型[8],阿尔茨海默病模型[9]等。实验主要用于研究不同浓度的铜离子对PrP线虫模型的影响。
1 材料与方法
1.1 试剂和仪器
氯化铜CuCl2(分析纯)溶于双蒸水配成浓度为10-2mol·L-1溶液后,使大肠杆菌OP50 配成终浓度分别为10-6mol·L-1,10-4mol·L-1及10-3mol·L-1三种浓度,放在4 ℃条件下保存。Western Blot 实验中的一抗为PrP 抗小鼠单克隆抗体1F11/E9,实验室购于Abcam 公司,二抗是山羊抗小鼠商品化抗体,实验室购自Sigma 公司,货号SAB4600238。配制M9 Buffer高压后使用。Bacto Agar 和Bacto Peptone 都是购自BD 公司,Cholesterol 是购自SIGMA 的产品。M-280是购自Invitrogen 公司,基因组DNA 试剂盒是购自AxyPrep,BCA 蛋白浓度测定试剂盒购自碧云天,生化培养箱型号HSP-250,冰箱型号BCD-279/HC,恒温培养振荡器型号ZHWY-200B,显微镜型号分别为ZSA301 和SZX16。显微注射仪eppendorf FemtoJet express。
1.2 构建转PrP 基因实验线虫
选取饲喂较好的L4 年龄段的野生性N2 线虫,用矿物油固定在干燥的2%琼脂糖平板上,用微量加样针分别抽取20 uL 的质粒混合物(dat-1 PrP+dat-1 GFP),利用显微注射仪小心地移动显微注射针和倒置显微镜载物台注射线虫腺管的有丝分裂区域,小心地用拾取针挑取在矿物油中游动的线虫,除去矿物油并放入OP50 培养液中,一个h 后将该虫移入另一个新鲜OP50 培养基皿中以去除残留的矿物油。
1.3 试验线虫的品系和来源
N2 为野生型线虫,质粒dat-1-PrP102Mut 和质粒dat-1-PrPWt 为实验室保存的,其中线虫W101 是转入质粒dat-1-PrPWt 的线虫,线虫W102 是转入质粒dat-1-PrP102Mut 的线虫。在没有特别说明的情况下,线虫都是生长在涂布有大肠杆菌OP50 的NGM培养基上,培养箱温度为20 ℃,相对湿度为40%[10-11]。
1.4 线虫PCR 鉴定和Western Blot 检测
先将质粒dat-1-PrP102Mut 和dat-1-PrPWt 显微注射到线虫N2 体内,待注射的线虫产下第一代子代,通过PCR 鉴定子代线虫的PrP 基因,确定基因的成功转入,首先取W101,W102 和N2 各一条分别作为模板,引物:上游5′-GATGCTGGTTCTCTTTGTG G-3′,下游5′-CCACTATCAGGAAGATGAGG-3′,经PCR 扩增后,进行核酸电泳检测,得到清晰的约750 bp 的核酸条带。同时通过超声破碎提取子代线虫的全蛋白,然后在李奇等人浓缩蛋白方法[12]的基础上加以改进,采用M-280 磁珠免疫共沉淀法将线虫中的PrP 表达蛋白进行浓缩,然后用Western Blot 进行检测。得到清晰的PrP 表达的一组介于20~37 kb的蛋白条带。
1.5 食物敏感性实验
实验采用了PRNP 的102 位点突变的基因转入线虫体内(W102),与转入正常PRNP 的线虫(W101)及野生型线虫(N2)做对比,研究在不同浓度铜离子情况下,对三种线虫的影响。首先对W101,W102,N2三种线虫进行同步化处理,先将含有不同浓度氯化铜的大肠杆菌OP50 和不含氯化铜的大肠杆菌OP50分别铺到NGM 板上,再挑选成年健壮的线虫,用Picker 粘取食物,将三种线虫分别粘到四种含有不同食物(分别是不含氯化铜的OP50 和含有氯化铜终浓度为10-6mol·L-1,10-4mol·L-1,10-3mol·L-1的OP50)的NGM 板上,生化培养箱中放置4 h 后,将其烫死,再过52 h 后,将其后代定为第0 d(D0)的线虫,并每隔一天用Picker 将线虫挑到一个新的板子上。分别在第0 d(D0),第2 d(D2),第4 d(D4),第6 d(D6)统计在不同食物中饲喂的三种线虫食物敏感性。具体做法如下:用M9 Buffer 冲洗每种线虫,将其放入食物的NGM 板子板上约一分钟左右,观察其在有实物中20 s 内的摆动次数,并记录。再以同样的方法统计线虫在无食物的NGM 板上20 s 内的摆动次数(每条线虫只能用一次)。每组线虫有三个重复,每个重复有40 条线虫。食物敏感性=(无食物中的摆动次数-有食物的中的摆动次数)/无食物中的摆动次数。
1.6 线虫生命周期实验
分别将三种线虫W101,W102,N2 放到4 种含有不同食物(分别是不含氯化铜的OP50 和含有氯化铜终浓度为10-6mol·L-1,10-4mol·L-1,10-3mol·L-1的OP50)的NGM 板上,然后对三种线虫进行同步化处理,方法如上,得到D0 期的同步线虫,并每隔一天用Picker 将线虫挑到一个新的板子上。并统计其死亡数。如果线虫不摆动,将其所在的NGM 板敲击桌面几次,如果此时线虫不动,再用头发轻轻触碰线虫头部,如果线虫依然不动,则认为该线虫死亡。每组线虫重复取40 条。
1.7 线虫产卵数统计实验
分别将三种线虫W101,W102,N2 放到4 种含有不同食物(分别是不含氯化铜的OP50 和含有氯化铜终浓度为10-6mol·L-1,10-4mol·L-1,10-3mol·L-1的OP50)的NGM 板上,培养一段时间后,挑选每组的成年健壮线虫,生化培养箱中放置24 h,将其烫死,再在生化培养箱中培养48 h 后,在显微镜下统计后代数目。每组重复取40 条线虫。
2 结果
2.1 PrP 转基因线虫W101 和W102 的构建
实验结果显示,经过PCR 鉴定发现,N2 没有目的条带,W101 和W102 均在750 Kb 处出现条带(如图1-A)。经过Western Blot 检测发现,N2 没有目的条带,W101,W102 及阳性对照鼠脑均出现PrP 的三条带,但线虫的PrP 位置与小鼠PrP 位置不同(如图1-B)。
2.2 不同浓度的铜离子对PrP 转基因线虫的食物敏感性的影响
研究采用不同浓度铜离子处理W101,W102,N2三种线虫,分别观察其对三种线虫的食物敏感性的影响。通过实验发现,饲喂不含CuCl2的OP50 的三种线虫,线虫W102 在D0,D2,D4,D6 四个时期的食物敏感性都比同时期的另两种线虫W101 和N2 低,而W101 比同时期的N2 低,并且随着年龄的增加,线虫W101 和W102 对食物的敏感性都明显在降低,在D6时降至最低(图2-A);当W101,W102,N2 三种线虫饲喂含有CuCl2浓度为10-6mol·L-1的OP50 时,在D0,D2 和D4 时期与饲喂不含CuCl2的OP50 组的线虫做对比,发现在10-6mol·L-1浓度时,对三种线虫的食物敏感性几乎没有影响;在成虫的衰老期D6 期,线虫W101 和W102 对食物的敏感性明显下降,并且W102 和W101 相比下降更显著。(图2-B)

图1 PCR 扩增和Western blot 分析Fig.1 Electrophoretic profile of PCR and analysis by Western blot
当W101,W102,N2 三种线虫饲喂含有CuCl2浓度为10-4mol·L-1的OP50 时,W101 对食物OP50 的敏感性,与CuCl2浓度为10-6mol·L-1相比,下降更显著。发现三种线虫在D0,D2,D4,D6 四个时期的食物敏感性都分别有所下降,但从D4 至D6 时期,W102 和W101 对食物的敏感性下降趋于明显,并且W102 和W101 相比下降更为明显。(图2-C)当W101,W102,N2 三种线虫饲喂含有氯化铜浓度为10-3mol·L-1的OP50 时,发现三种线虫在D0,D2,D4,D6 四个时期的食物敏感性急剧下降,而且野生型线虫N2 对食物敏感性的下降随着年龄的增加也变得更为显著,并且早从D2 时期开始,在三种线虫对食物敏感性都严重迟钝的情况下,W102 和W101 相比下降的更显著,直至线虫在成虫第D6 时期,对食物的反应降至只有3.85%,基本丧失对食物的敏感性。(图2-D)
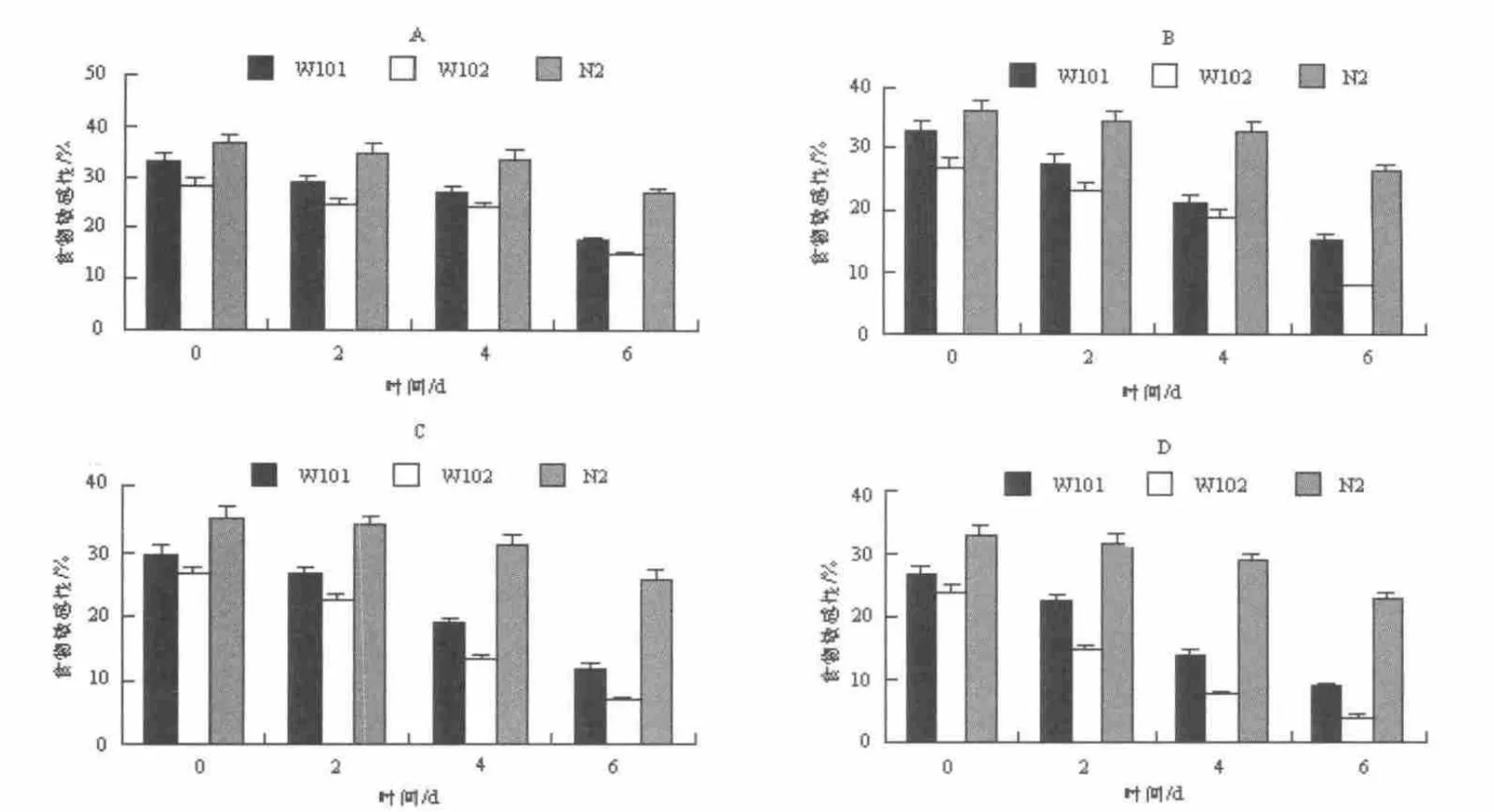
图2 食物敏感性试验Fig.2 Basal slowing response
2.3 不同浓度的铜离子对PrP 转基因线虫的生命周期的影响
研究采用不同浓度铜离子处理W101,W102 和N2 三种线虫,观察其对三种线虫生命周期的影响。通过实验发现,饲喂不含氯化铜的OP50 的三种线虫,线虫W101 比野生型线虫N2 生命周期有所缩短,而W102 缩短更为明显,平均生命存活仅为13 d(图3-A);当饲喂含有CuCl2浓度为10-6mol·L-1的OP50 时,W101,W102 存活率均明显下降,W101 的存活率从第12 d 开始下降,W102 平均生命周期缩短至12 d(图3-B)。当饲喂含有CuCl2浓度为10-4mol·L-1的OP50 时,发现三种线虫的生命周期都比饲喂CuCl2浓度为10-6mol·L-1食物的线虫有所减少,W101 和W102 的存活率从10 d 开始下降,并且生命周期缩短(图3-C)。当饲喂含有CuCl2浓度为10-3mol·L-1的OP50 时,线虫W101,W102 和野生型N2 的生命周期均开始明显缩短,特别是PrP 突变性线虫W102 的生命周期缩短至7~8 d(图3-D)。

图3 生命周期试验Fig.3 The experiment of life span
2.4 高浓度的铜离子处理线虫使其产卵数减少
研究采用不同浓度铜离子处理W101,W102,N2三种线虫,观察其对三种线虫产卵数的影响。通过实验发现,当饲喂CuCl2浓度为10-6mol·L-1对三种线虫几乎没有影响,只有W102 稍微有些下降。当CuCl2浓度为10-4mol·L-1时,发现三种线虫产卵数都有所下降,但W101 和W102 下降较为明显。当CuCl2浓度达到10-3mol·L-1时,三种线虫的产卵数量都达到最低,其中W102 平均每天产卵数降到30 只以下(图4)。

图4 产卵数试验Fig.4 The experiment of oviposition quantity
3 讨论
有研究报道铜离子参与了阿尔茨海默症的病理发生,但是实验中用了很高的铜离子浓度,高浓度的铜(10-3mol·L-1)在成虫后第8 d 显著地加重了阿尔茨海默症线虫模型(Abeta 线虫)的瘫痪行为,低浓度的铜(10-4mol·L-1)却减少了Abeta 线虫的瘫痪行为,更低的铜浓度(10-6mol·L-1)却没什么效果。同时研究发现用不同浓度的铜离子处理野生型线虫N2,却没有观察到瘫痪行为,这说明铜和阿尔茨海默症关键蛋白Abeta 要发挥显著的行为效果需要一个缓慢的时间,也证实了同浓度的高低影响Abeta 发挥毒性程度[13]。由于阿尔茨海默症和朊病毒疾病为蛋白引起的神经退行性疾病,以此为实验依据,选择了相应浓度的铜离子对朊病毒疾病的线虫模型进行实验,对重金属铜离子在朊病毒发病过程中产生的影响进行深入的研究。
动物的食物敏感性受机体的多巴胺神经元来支配[14],当线虫的食物敏感性下降,间接证明多巴胺神经元损伤。通过观察铜离子对PrP 转基因线虫的食物敏感性试验说明,首先高浓度的CuCl210-3mol·L-1会降低线虫对食物的敏感性,其原因可能是由于铜离子重金属本身产生的细胞毒性对多巴胺神经元通路造成损伤,并且随着饲喂铜离子浓度的下降,线虫的食物敏感性逐渐恢复正常。其次,通过该实验发现线虫的食物敏感性的降低与朊蛋白PRNP 也有一定的关系,在相同铜离子浓度情况下,野生型PRNP 转基因线虫W101 比自然野生型线虫N2 食物敏感性下降多,表明朊蛋白表达可能会造成机体多巴胺神经元通路的损伤,从而降低其对食物的敏感性,而线虫W102 对食物的敏感性下降最为明显,说明当PRNP 的102 位点突变时,多巴胺的神经损伤会更为明显。第三,通过实验发现,随着年龄增加,线虫对食物敏感性也会逐渐下降,这说明多巴胺神经元的损伤和退化与年龄因素有关,再次印证朊蛋白疾病本身是一种神经退行性疾病的说法。
通过实验可以发现,高浓度铜离子会减少线虫的寿命及产卵数,这可能是因为铜离子本身具有毒性的作用。此外,从数据中还可以发现,当PRNP 的102 位点突变时,数量减少得会更为明显,由此可以猜想,当PRNP 的102 位点突变时,可能对机体的存活产生影响,此时如果给予高浓度的铜离子时,将会产生叠加损伤的作用。
总之,在高浓度铜离子作用下,线虫的食物敏感性,生长周期及产卵数量都会降低,可能是由于高浓度的铜离子会产生毒性作用,但从实验结果中发现,在高浓度铜离子作用下,转入PRNP 的102 位点突变基因的线虫SGC226 受到的损伤更为严重,表明PrP的发病机制与铜离子有一定的联系,在铜离子浓度较高时,二者可能对线虫产生叠加损伤作用。近几年,越来越多的实验发现PrP 与铜离子的关系密切[15-16],实验主要是希望能够通过研究朊蛋白与铜离子,年龄,PRNP 的102 位点突变及多巴胺神经的关系,为未来朊病毒疾病的治疗提供一个的线索。此外,线虫模型由于其实验室操作简单,生命周期短,繁殖迅速等特点,已经成为研究许多疾病模型的首选,相信转基因PrP 线虫模型将对未来研究朊病毒疾病将具有实际的意义。
[1] Wang G H,Zhou X M,Yu B,et al. Cellular prion protein released on exosomes from macrophages binds to Hsp70[J]. Acta Biochim Biophys Sin(Shanghai),2010,42(5):345-350.
[2] Hsiao K,Baker H F,Crow T J,et al. Linkage of a prion protein missense variant to Gerstmann-Straussler syndrome[J]. Nature,1989,338(23):342-345.
[3] Hsiao K,Prusiner S B. Molecular genetics and transgenic model of Gertsmann -Straussler -Scheinker disease[J].Alzheimer Dis Assoc Disord,1991,5(3):155-162.
[4] Telling G C. The mechanism of prion strain propagation[J]. Genome Biol,2004,5(5):222.
[5] Morillas M,Swietnicki W,Gambetti P,et al. Membrane environment alters the conformational structure of the recombinant human prion protein[J]. J Biol Chem,1999,274(52):36859-36865.
[6] Pauly P C,Harris D A. Copper stimulate endocytosis of the prion protein [J]. J Biol Chem,1998,273(50):33107-33110.
[7] Qin K F,Yang D S,Yang Y,et al. Copper(Ⅱ)-induced conformational changes and protease resistance in recombinant and cellular PrP.Effect of protein age and deamidation[J]. J Biol Chem,2000,275(25):19121-19131.
[8] Yao C,Khoury R,Wang W,et al. LRRK2-mediated neurodegeneration and dysfunction of dopaminergic neurons in a Caenorhabditis elegans model of Parkinson's disease[J]. Neurobiol Dis,2010,40(1):73-81.
[9] 罗云峰,张杰,刘年庆,等. 在阿尔茨海默病转基因线虫模型中铜离子以浓度依赖的方式影响贝塔淀粉样多肽的毒性[J]. 中国科学,2011,41(5):369-376.
[10] Brenner S. The genetics of Caenorhabditis elegans[J].Genetics,1974,77(1):71-94.
[11] Feng Z Y,Li W,Alex Ward,et al. A C.elegans model of nicotine-dependent behavior:regulation by TRP-family channels[J]. Cell,2006,127(3):621-633.
[12] 李奇,杨阳,吕鹏,等. Protein A 磁珠检测朊病毒方法的建立[J]. 黑龙江八一农垦大学学报,2009,21(3):73-75.
[13] Diehl D J,Gershon S.The role of dopamine in mood disorders[J]. Compr Psychiatry,1992,33(2):115-120.
[14] Brown D R,Schmidt B,Kretzschmar H A. Effects of copper on survival of prion protein knockout neurous and glia[J]. Neurochem,1998,70(4):1686-1693.
[15] Wadsworth J D,Hill A F,Joiner S,et al. Strain-specific prion-protein conformation determined by met al icons[J]. Nat Cell Biol,1999,1(1):55-59.
[16] Waggoner D J,Drisaldi B,Bathnikas T B,et al. Brain copper content and cuproenzyme activity do not vary with prion protein expression level [J]. Biol Chem,2000,275(11):7445-7448.
