实验性蛛网膜下腔出血后早期铁调素表达的变化☆
2013-11-23刘浏谭关平陈耀隆詹傲熊伟茗何朝晖
刘浏 谭关平 陈耀隆 詹傲 熊伟茗 何朝晖
早期脑损伤(early brain injury,EBI)是蛛网膜下腔出血(subarachnoid hemorrhage,SAH)患者死亡和残疾的首要原因,细胞凋亡是其最主要的病理机制[1,2]。脑铁含量增加催化的活性氧簇(reac⁃tive oxygen species,ROS)反应性增强是导致细胞凋亡的重要原因之一[3,4]。新近的研究[5]提示,细胞内铁代谢紊乱是脑铁含量增加的新机制。铁调素(hepcidin)被认为是调节铁稳态的最重要的类激素物质,可通过干扰铁转运相关蛋白影响铁代谢平衡[6]。Hepcidin表达水平的增高会导致体内铁含量的蓄积,但SAH后脑铁含量增高是否与铁调素的变化有关尚需进一步探明。本实验通过复制大鼠SAH模型,观察SAH后大鼠海马Hepcidin的表达与总铁含量的关系,探讨Hepcidin在SAH后脑铁代谢紊乱中的作用机制。
1 材料与方法
1.1 研究对象 健康成年雄性SD大鼠90只,体质量250~300g,由重庆医科大学实验动物中心提供。随机将大鼠分为假手术(对照)组和蛛网膜下腔出血(SAH)组,其中SAH组根据处理时间分为12、24、48、72h 4个组,总共5组,每组各18只大鼠(其中6只用于免疫组化检测,6只用于检测West⁃ern-blot,6只用于检测海马铁含量)。
1.2 SAH模型制作 以水合氯醛腹腔麻醉大鼠后,常规消毒,分离右侧股动脉,留置结扎线。将动物固定于脑立体定位仪上,沿颅顶正中矢状线切开顶部中线皮肤,钝性分离骨膜,在距前囟前5mm,中线旁3mm处用电动牙科钻钻孔,孔径为1.0mm,小心挑破硬膜,将PE10细导管紧贴前颅窝底蛛网膜下腔送至颅底动脉环,置管深度约1cm。连接注射器回抽见有清亮脑脊液流出,证实导管进入蛛网膜下腔后,以皮试针经股动脉穿刺抽取自体动脉血0.3mL,立即在30s内缓慢注入蛛网膜下腔。拔出导管,封闭骨孔,缝合皮肤,保持头低位30min。假手术对照组动物按上述方法操作,但蛛网膜下腔置管后不注血。
1.3 免疫组织化学检测Hepcidin蛋白的表达 脑组织用4%多聚甲醛灌注固定,石蜡包埋切片,厚约4μm。按照说明书采用SP法进行染色。以PBS代替一抗作阴性对照。Hepcidin一抗浓度1:200(美国Abcam公司)。采用Image-Pro Plus5.0图像分析系统对免疫组化结果进行扫描,半定量分析Hepcidin在对照组和SAH组中的表达。每张切片观察5个视野,所有切片在同一放大倍数(400×)、同一光强度下照相,以平均光密度值定量比较,细胞膜上出现棕黄色为阳性反应。
1.4 Western blot法检测Hepcidin蛋白 取海马组织于匀浆器中,加入组织裂解液,振荡或涡旋混匀,冰水浴裂解20~30 min。加入上样缓冲液强力混匀,置100℃的水浴箱中水浴加热3~5min,4℃下12000r/min离心15min,取上清液,BCA法测定蛋白浓度并标化。蛋白样品加入变性缓冲液于沸水中煮5min,10000r/min离心5min后上样。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,然后转至硝酸纤维膜。于5%脱脂牛奶中4℃封闭过夜;分别加入抗 Hepcidin 抗体(美国 Abcam,1:100)、抗β-actin抗体(北京中杉公司1∶3000)置于4℃孵育过夜;加入二抗goat anti rabbit(北京中杉公司,1:2000)于37℃孵育1 h。按1:1配制A、B发光液,凝胶成像仪与Quantity One软件照相显影,分析结果。采用β-actin为内参照。
1.5 原子吸收光谱法测定大鼠海马中铁含量 大鼠经冷生理盐水灌注后,取新鲜脑组织,分离海马,用离子水冲洗两遍,滤纸吸干表面,置入EP管中于-80℃保存。电子分析天平称每个标本的质量,标本加入硝酸高氯酸(V硝酸:V高氯酸=4:1)20mL,避光消化10h,中温加热,消解至无色透明,高温加热挥发完余酸,冷却后加入去离子水10mL,加热至近干,用2%HNO3移入比色管,定容至10mL,用原子吸收光谱仪测定铁浓度。脑铁含量的计算:提取物铁浓度(ppm)×10mL/标本质量(mg)。
2 结果
2.1 大鼠海马组织免疫组化检测结果 Hepcidin在假手术对照组的海马神经元中仅有弱阳性表达(图1A),而在SAH组中检测到很强的Hepcidin阳性表达细胞(图1B)。在SAH组各时间点hepcidin表达逐渐增高,大鼠SAH后72h增高最明显,SAH后各时间点Hepcidin在海马神经元的表达量与假手术对照组比较均明显增加(F=31.911,P<0.05)。见图1,表1。
2.2 大鼠海马组织内Hepcidin蛋白的表达 West⁃ern blot检测到假手术对照组有Hepcidin蛋白的表达,实验组SAH后12h Hepcidin蛋白表达开始增高,SAH后72h时Hepcidin表达最高,各时相点与假手术对照组比较均有统计学差异(F=147.314,P<0.05)。见图2。
2.3 大鼠海马铁含量的变化 原子吸收分光光谱法显示,大鼠SAH后海马铁含量明显增高,与假手术对照组比较,大鼠SAH后海马铁含量在12h、24h、48h、72h呈逐渐增高趋势,其SAH后72h时铁含量最高(F=28.799,P<0.05)(表1)。
2.4 大鼠海马Hepcidin蛋白的表达与海马铁含量的相关性 大鼠海马组织Hepcicin蛋白的表达量与海马铁含量成正相关(r=0.914,P<0.05)。
3 讨论
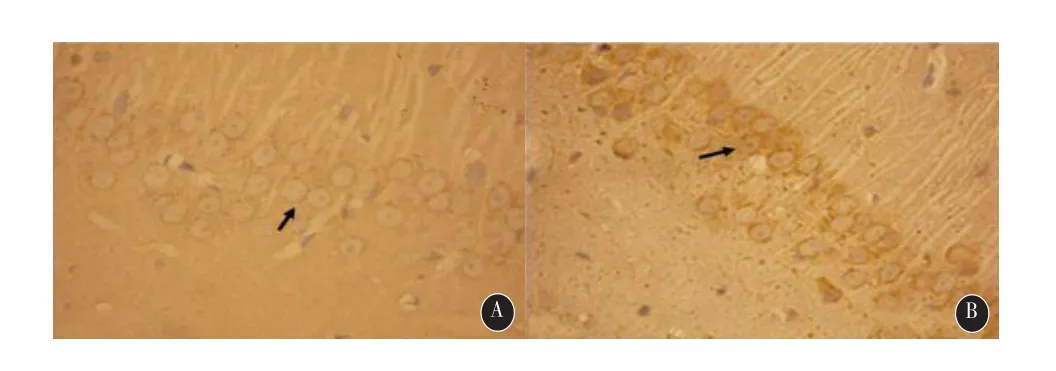
图1 免疫组化检测SAH后72h Hepcidin的表达情况。A:对照组大鼠海马(400×);B:SAH组大鼠SAH 72h后海马(400×),黑色箭头示Hepcidin阳性表达细胞

图2 Western blot检测大鼠海马Hepcidin的表达情况。1:假手术对照组;2:SAH后12h;3:SAH后24h;4:SAH后48h;5:SAH后72 h

表1 大鼠海马组织Hepcidin的蛋白表达和铁含量
SAH后早期脑损伤(EBI)可能是SAH患者致死致残率较高的首要原因[7],脑血管痉挛可造成严重脑缺血及脑损伤。传统观念认为,SAH后早期血管痉挛是血块分解代谢释放的血管活性物质所致,而脑内铁含量的增高是血块中血红蛋白分解的结果[8]。近期研究表明,脑细胞内铁代谢紊乱可导致脑内铁含量增高,提示SAH后脑铁含量增高可能与脑细胞内铁代谢紊乱有关[9]。SAH后早期,海马中可观察到细胞凋亡的发生,铁离子作为生物分子氧化的主要催化剂可产生反应性极强的氧自由基,诱导细胞凋亡[10]。因此,我们推断,铁离子在SAH后EBI的发生过程中起着重要的作用。
脑铁代谢的平衡至关重要。脑总铁含量水平的升高被认为在包括阿尔兹海默病和帕金森疾病在内的神经退行性疾病的发病机制中发挥重要的作用,铁诱导的氧化损伤与其发病有关。脑出血后,脑铁含量的增高导致大量自由基生成,在脑出血后的脑水肿的发展过程中起着重要的作用[11,12]。我们推测,脑总铁含量的升高同样在SAH后EBI发展过程中起着重要的作用。本实验采用视交叉前池单次注血法构建大鼠SAH模型,原子吸收分光光谱法检测海马总铁含量发现,SAH后各时间点大鼠海马总铁含量逐渐增加,在72h最多,证实SAH后早期大鼠海马总铁含量增高。我们推断,在SAH后脑组织总铁含量水平的升高,铁离子可产生反应性极强的羟自由基,从而激发过氧化反应引起细胞凋亡,可能参与了SAH后EBI的发生发展过程。
Hepcidin也称肝脏抗菌多肽,是在肝脏合成并富含半胱氨酸的抗菌多肽[13]。近年来被认为是调节铁稳态的最重要类激素类物质,广泛分布于鼠类的皮层、海马和基底节区等部位,与多种铁代谢蛋白有着密切的关系。膜铁转运蛋白1(ferro⁃portin1,Fpn1)、铜蓝蛋白(ceruloplasmin,CP)和二价金属转运体(divalent metal transporter 1,DMT1)等铁转运相关蛋白可影响铁含量紊乱,在铁代谢过程中发挥重要作用[14]。Li L等通过侧脑室内注射Hepcidin对大鼠海马区的研究发现,Hepcidin可以抑制Fpn1及Fpn1 mRNA的表达,还可下调CP及其mRNA的表达,另可显著促进组织中DMT1的表达,且具有明显的区域特异性[15]。我们推测在SAH后EBI发展过程中,Hepcidin表达可能增加,通过对上述重要的铁转运相关蛋白调控,进而影响脑组织中的总铁含量。
通过Western blot检测发现,与对照组比较,大鼠在建模后12h海马Hepcidin蛋白的表达明显增加,至72h时表达最高。免疫组化同样证实了海马Hepcidin在SAH后早期的上调,其表达改变与海马总铁含量的变化时程相吻合。同时经相关性分析,SAH后Hepcidin的蛋白表达与海马组织的总铁含量呈明显正相关。
因此,我们推测,SAH后Hepcidin的表达增高可能与海马总铁含量的水平升高有关,本实验结果提示SAH后引起Hepcidin的表达增高,可能通过对铁转运相关蛋白的影响调控,导致细胞内铁代谢紊乱,最终引起海马的总铁含量增高,为今后进一步研究SAH后脑铁代谢紊乱奠定了实验基础。本研究目前只能通过Hepcidin蛋白表达和总铁含量的相关性,推测两者之间的可能机制,这是本文的不足之处,在后期的实验中,我们将进行铁转运蛋白与海马神经元细胞凋亡的检测,来进一步探讨Hepcidin参与SAH后脑铁代谢紊乱及EBI整个病理过程的相关机制,将可能为SAH的治疗提供新的思路。
[1]Ostrowski RP,Colohan AR,Zhang JH.Molecular mechanisms of early brain injury after subarachnoid hemorrhage[J].Neurol Res,2006,28(4):399-414.
[2]Cahill J,Calvert JW,Solaroglu I,et al.Vasospasm and p53-in⁃duced apoptosis in an experimental model of subarachnoid hem⁃orrhage[J].Stroke,2006,37(7):1868-1874.
[3]Jomova K,Vondrakova D,Lawson M,et al.Metals,oxidative stress and neurodegenerative disorders[J].Mol Cell Biochem,2010,345(1-2):91-104.
[4]Ong WY,Halliwell B.Iron,atherosclerosis,and neurodegenera⁃tion:a key role for cholesterol in promoting iron-dependent oxi⁃dative damage?[J].Ann N Y Acad Sci,2004,1012:51-64.
[5]Chi SI,Wang CK,Chen JJ,et al.Differential regulation of H-and L-ferritin messenger RNA subunits,ferritin protein and iron following focal cerebral ischemia-reperfusion[J].Neurosci⁃ence,2000,100(3):475-484.
[6]Wang SM,Fu LJ,Duan XL,et al.Role of hepcidin in murine brain iron metabolism[J].Cell Mol Life Sci,2010,67(1):123-133.
[7]Broderick JP,Brott TG,Duldner JE,et al.Initial and recurrent bleeding are the major causes of death following subarachnoid hemorrhage[J].Stroke,1994,25(7):1342-1347.
[8]Macdonald RL,Weir BK.A review of hemoglobin and the patho⁃genesis of cerebral vasospasm[J].Stroke,1991,22(8):971-982.
[9]Chi SI,Wang CK,Chen JJ,et al.Differential regulation of H-and L-ferritin messenger RNA subunits,ferritin protein and iron following focal cerebral ischemia-reperfusion[J].Neurosci⁃ence,2000,100(3):475-484.
[10]Yeo JE,Kang SK.Selenium effectively inhibits ROS-mediated apoptotic neural precursor cell death in vitro and in vivo in traumatic brain injury[J].Biochim Biophys Acta,2007,1772(11-12):1199-1210.
[11]Castellani RJ,Moreira PI,Liu G,et al.Iron:the Redox-active center of oxidative stress in Alzheimer disease[J].Neurochem Res,2007,32(10):1640-1645.
[12]鲍旭辉,黄峰平.铁在脑出血后脑水肿形成中的机制研究进展[J].中国神经精神疾病杂志,2007,33(8):507-510.
[13]Krause A,Neitz S,Magert HJ,et al.LEAP-1,a novel highly di⁃sulfide-bonded human peptide,exhibits antimicrobial activity[J].FEBS Lett,2000,480(2-3):147-150.
[14]Wu J,Hua Y,Keep RF,et al.Iron and iron-handling proteins in the brain after intracerebral hemorrhage[J].Stroke,2003,34(12):2964-2969.
[15]Li L,Holscher C,Chen BB,et al.Hepcidin treatment modulates the expression of divalent metal transporter-1,ceruloplasmin,and ferroportin-1 in the rat cerebral cortex and hippocampus[J].Biol Trace Elem Res,2011,143(3):1581-1593.
