MK-801对不同发育阶段大鼠脑内NMDA受体亚基及NGF的影响
2013-03-21贾娇李继涛黄润虎杨红苏允爱司天梅
贾娇李继涛黄润虎杨红苏允爱司天梅
·论 著·
MK-801对不同发育阶段大鼠脑内NMDA受体亚基及NGF的影响
贾娇*李继涛***黄润虎**杨红**苏允爱***司天梅***
目的 探讨新生期重复注射N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体拮抗剂地卓西平马来酸盐(dizocilpine maleate,MK-801)对不同发育阶段大鼠NMDA受体亚基NMDAR1(NR1)、NMDAR2A(NR2A)、NMDAR2B(NR2B)表达及神经生长因子(nerve growth factor,NGF)含量的影响。方法 30只新生雄性大鼠随机分为研究组和对照组,各15只。于出生后(postnatal day,PND)5~14d皮下注射MK-801(0.25mg/kg,每日2次)或生理盐水。分别于幼年期(PND15)、青春期(PND42)和成年期(PND70)取脑留取海马、前额叶皮质脑区,用免疫印迹(Western blot)方法检测NR1、NR2A、NR2B表达水平,用ELISA方法测定NGF含量。结果 幼年期(PND15)与对照组相比,研究组海马与前额叶NMDA受体各亚基表达水平及NGF含量没有统计学差异(均P>0.05);青春期(PND42)研究组大鼠前额叶NGF含量低于对照组[(56.19±37.87)vs.(152.54±53.92)],差异有统计学意义(P<0.01);成年期(PND70)研究组大鼠海马NR1、NR2A表达水平较对照组增加[NR1:(149.55%± 27.00%)vs.(100.00%±32.08%);NR2A:(171.54%±19.85%)vs.(100.00%±51.04%)],差异均有统计学意义(均P<0.05)。结论 新生期重复注射MK-801选择性上调成年大鼠海马NMDA受体亚基NR1和NR2A的表达水平,且显著降低青春期大鼠前额叶NGF的含量。提示发育早期阻断NMDA受体对大鼠大脑的神经发育产生远期影响。
地卓西平马来酸盐 N-甲基-D-天冬氨酸受体 神经生长因子 精神分裂症
根据谷氨酸功能低下假说建立的动物模型因能较精确地模拟精神分裂症而受到关注。与成年期给予N-甲基-D-天冬氨酸(N-methyl-D-aspar⁃tate,NMDA)受体拮抗剂相比,新生期阻断NMDA受体能引起更长久的行为和神经生物学改变,因而新生期阻断NMDA受体被用作建立精神分裂症的神经发育模型。研究显示,新生期阻断NMDA受体,会引起NMDA受体亚基NMDAR1(NR1)上调[1],但对于亚基NMDAR2A(NR2A)、NMDAR2B(NR2B)表达的影响,研究结果尚不一致;而且目前相关动物研究仅关注阻断NMDA受体对其海马或皮层某一生长时间点的影响。本实验通过新生期重复注射非竞争性NMDA受体拮抗剂地卓西平马来酸盐(dizocilpine maleate,MK-801),研究其对大鼠不同发育阶段(幼年期、青春期、成年期)海马和前额叶皮质脑区NMDA受体亚基NR1、NR2A、NR2B表达的影响。另外,神经生长因子(nerve growth factor,NGF)为重要的神经营养因子,研究提示NGF水平的改变可能参与精神分裂症的发病机制[2],有关阻断NMDA受体对NGF含量影响的相关研究较少。本研究拟探讨新生期阻断NMDA受体对不同发育阶段海马和前额叶皮质脑区NGF水平的影响。
1 材料和方法
1.1 实验动物 孕18天清洁级Sprague-Dawley(SD)大鼠8只(购自北京大学医学部实验动物中心),动物房采用12h昼夜节律控制(8:00~20:00),室温21~25℃,湿度40%~60%。动物自由进食进水。出生后(postnatal day,PND)当天为PND0,10~ 12只/窝;出生后21天(PND21)断奶,留雄性每笼5只饲养,共30只。本实验通过北京大学医学部动物伦理委员会审核批准。
1.2 药物与分组
1.2.1 实验药物 地卓西平马来酸盐(dizocilpine,(+)-MK-801)购自美国Sigma-aldrich公司,溶于生理盐水。
1.2.2 给药方案及分组 新生雄性大鼠随机分为研究组和对照组,每组15只,随机分给每个研究年龄段5只。分别于PND5~14皮下注射MK-801(0.25mg/kg)或等量生理盐水,每日2次(9:00和15: 00),给药体积5mL/kg。
1.3 实验方法
1.3.1 样本制备 30只大鼠分别于PND15、PND42、PND70取脑,分离海马和前额叶皮质脑区,骤冷后冻存。进一步测定前进行脑组织裂解,离心并取上清,冻存备用。
1.3.2 免疫印迹(Western Blot)法检测NMDA受体亚基表达水平 采用BCA蛋白定量试剂盒(美国Pierce公司)检测蛋白浓度、计算上样量;变性,保存备用。取含有30μg蛋白的样本上样,电泳、电转、封闭,分别加一抗NMDAR-1(Epitmics,1:1000)、NMDAR-2A(Epitmics,1:1000)、NMDAR-2B(Cell Signaling,1:1000)、Actin(Santa Cruz Biotechnology,1:1000),4℃孵育过夜。次日,加HRP标记山羊抗兔(1:5000)二抗,室温孵育2h。暗室曝光、显影、定影,扫描后用Quantity One 4.6.2软件处理结果。所有数据均以MK-801组值与对照组值(设为100%)相比所得的百分比表示。每个实验(即每个脑区、每个抗体检测)重复3次。
1.3.3 ELISA法测定NGF浓度 采用ELISA试剂盒(美国Promega公司)测定NGF浓度。抗NGF多克隆抗体包被,4℃孵育过夜。次日阻断液阻断1h,加入NGF标准品和待测样本,孵育6h;加抗NGF单克隆抗体,4℃孵育过夜;加入HRP标记的抗大鼠IgG抗体,室温孵育2.5h。TMB显色10 min,加盐酸终止反应后,放入酶标仪读数(波长450nm)。根据NGF标准曲线计算脑组织匀浆NGF含量,结果以NGF浓度(pg/mL)/总蛋白浓度(mg/mL)的比值表示,单位为pg/mg protein。
1.4 统计学方法 采用SPSS 17.0进行数据统计分析。实验结果以均数±标准差(±s)表示。NMDA受体亚基表达水平和NGF浓度的组间差异比较采用独立样本t检验。检验水准α为0.05。
2 结果
2.1 大鼠幼年期NMDA受体亚基表达水平 在大鼠幼年期,研究组与对照组比较,前额叶与海马部位NR1、NR2A、NR2B表达水平均无统计学差异(均P>0.05)。见表1与图1。
2.2 大鼠青春期NMDA受体亚基表达水平 在大鼠青春期,研究组与对照组比较,前额叶与海马部位NR1、NR2A、NR2B表达水平均无统计学差异(均P>0.05)。见表2与图2。

图1 Western Blot检测幼年期前额叶与海马部位NMDA受体亚基蛋白表达水平(control:对照组,MK-801:研究组,PFC:前额叶,HP:海马)

图2 Western Blot检测青春期前额叶与海马部位NMDA受体亚基蛋白表达水平(control:对照组,MK-801:研究组,PFC:前额叶,HP:海马)
表1 大鼠幼年期(PND15)NMDA受体亚基蛋白表达水平(±s)

表1 大鼠幼年期(PND15)NMDA受体亚基蛋白表达水平(±s)
前额叶海马组别研究组对照组n 55 NR1 113.18%±16.11% 100.00%±8.84% NR2A 100.75%±19.83% 100.00%±17.13% NR2B 105.85%±10.19% 100.00%±23.90% NR1 94.99%±21.06% 100.00%±17.59% NR2A 91.85%±18.22% 100.00%±13.99% NR2B 100.03%±25.20% 100.00%±17.84%
表2 大鼠青春期(PND42)NMDA受体亚基蛋白表达水平(±s)

表2 大鼠青春期(PND42)NMDA受体亚基蛋白表达水平(±s)
前额叶海马组别研究组对照组n 55 NR1 108.67%±16.01% 100.00%±19.95% NR2A 121.12%±33.18% 100.00%±51.12% NR2B 122.44%±19.46% 100.00%±43.29% NR1 113.37%±17.46% 100.00%±16.21% NR2A 100.76%±18.19% 100.00%±35.00% NR2B 95.58%±16.62% 100.00%±18.50%
表3 大鼠成年期(PND70)NMDA受体亚基蛋白表达水平(±s)

表3 大鼠成年期(PND70)NMDA受体亚基蛋白表达水平(±s)
1)与对照组比较,经独立样本t检验,P<0.05
前额叶海马组别研究组对照组n 55 NR1 115.89%±19.61% 100.00%±21.58% NR2A 120.68%±31.73% 100.00%±21.28% NR2B 89.64%±19.36% 100.00%±31.59% NR1 149.55%±27.00%1) 100.00%±32.08% NR2A 171.54%±19.85%1) 100.00%±51.04% NR2B 106.34%±35.23% 100.00%±7.31%
表4 研究组与对照组不同年龄段的NGF浓度(±s,单位:pg/mg protein)
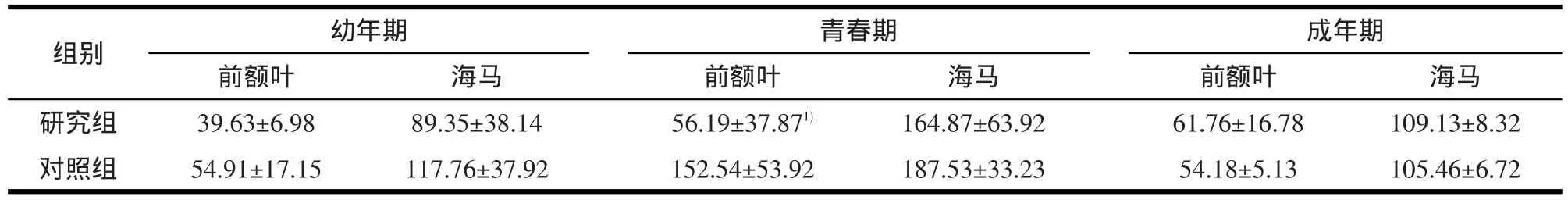
表4 研究组与对照组不同年龄段的NGF浓度(±s,单位:pg/mg protein)
1)与对照组比较,经独立样本t检验,P<0.01
组别研究组对照组幼年期前额叶39.63±6.98 54.91±17.15海马89.35±38.14 117.76±37.92青春期前额叶56.19±37.871) 152.54±53.92海马164.87±63.92 187.53±33.23成年期前额叶61.76±16.78 54.18±5.13海马109.13±8.32 105.46±6.72
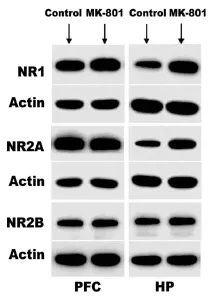
图3 Western Blot检测成年期海马与前额叶部位NMDA受体亚基蛋白表达水平(control:对照组,MK-801:研究组,PFC:前额叶,HP:海马)
2.3 大鼠成年期NMDA受体亚基表达水平 在大鼠成年期,研究组与对照组比较,前额叶部位NR1、NR2A、NR2B表达水平均无统计学差异(均P>0.05);研究组海马部位NR1(t=-2.642,P= 0.030)和NR2A(t=-2.921,P=0.032)较对照组增加,差异有统计学意义,NR2B在两组间无统计学差异(P>0.05)。见表3与图3。
2.4 不同年龄段大鼠NGF浓度 在大鼠青春期,研究组前额叶部位NGF浓度低于对照组,差异有统计学意义(t=3.582,P=0.005);海马部位NGF浓度在两组间无统计学差异(P>0.05)。
在大鼠幼年期和成年期,研究组与对照组比较,前额叶和海马部位NGF浓度无统计学差异(P>0.05)。
3 讨论
本实验组前期研究提示,新生期阻断NMDA受体会诱发一系列精神分裂样行为,如自发活动增多,空间工作记忆能力受损等[3-4]。本实验在此基础上进一步探讨新生期阻断NMDA受体引起的海马和前额叶皮质脑区NMDA受体亚基表达水平及NGF浓度的改变。研究提示海马和前额叶皮质脑区NMDA受体功能低下与精神分裂症的发病密切相关[5-6],所以本研究选择这两个脑区作为关注点。
NMDA受体功能低下在精神分裂症发病的病理机制中起重要作用[7]。NMDA受体由亚基NR1、NR2、NR3组成,NR1为必需亚基,代表NMDA受体的含量;NR2存在4种不同结构NR2A、NR2B、NR2C和NR2D,辅助NMDA受体形成多元化结构[8-9];其中NR2A、NR2B起主要作用。Wilson等[10]于大鼠新生期注射MK-801后4h检测各脑区NMDA受体亚基mRNA表达,结果显示NR1、NR2A mRNA均上调,而NR2B mRNA无明显变化。本研究显示新生期注射MK-801引起成年大鼠海马NR1、NR2A蛋白表达明显增加,NR2B无明显改变。其中NR1改变与多项研究结果一致,如小鼠怀孕后期注射NMDA受体拮抗剂苯环己哌啶(phencyclidine,PCP),其子代在青春后期NR1表达增加[11];同时Baier等[12]研究也显示新生期注射NMDA受体拮抗剂可引起大脑皮层NR1的上调。
关于阻断NMDA受体对NR2A、NR2B表达的影响,国内外研究较少且结果不一致。NR2A、NR2B在神经突触传递中起重要作用,NR2A主要存在于突触部位,参与长时程增强(long-term potenti⁃ation,LTP)形成;NR2B主要位于突触外,参与长时程抑制(long-term depression,LTD)形成[13]。在脑发育期间NR2B由突触部位逐渐迁移至突触外,在NMDA受体亚基中的贡献逐渐降低;而NR2A逐渐代替NR2B,在突触中起主要作用[14-15]。大鼠新生期慢性注射PCP致青春期大脑皮层NR2B下调[16],提示NR2B与神经元凋亡密切相关。而Anastasio等[17-18]指出新生期重复注射PCP可使额叶皮层NR1和NR2A上升,NR2B无明显改变。上述研究结果不一致主要与发育阶段、检测脑区、给药方式及剂量不同有关。本实验通过新生期重复注射MK-801,同时检测不同生长发育阶段以及不同脑区的NMDA受体亚基表达,结果显示成年大鼠海马部位NR1、NR2A蛋白表达明显增加,与上述Anastasio等[17-18]研究结果一致。
NGF广泛分布于中枢和周围神经系统,通过与受体p75NTR和TrkA结合,调节神经元的存活、生长、分化、迁移,以及突触的形成和连接[19-20]。精神分裂症患者血清NGF水平下降[21],提示NGF含量与精神分裂症密切相关。本研究组已有研究结果显示,大鼠新生期注射MK-801会引起脑源性神经营养因子(brain derived neurophic factor,BDNF)改变[4];本实验进一步检测MK-801是否会引起NGF改变。研究指出,NGF的mRNA合成受非竞争性NMDA受体的调节[22];Zafra等[23]研究结果显示,人体服用氯胺酮对NGF无影响,而国内研究显示成年雄性大鼠注射MK-801引起海马NGF下调[24]。本研究于新生期阻断NMDA受体,结果显示在青春期研究组前额叶部位NGF明显下降,在幼年期、成年期对前额叶和海马NGF均无明显影响。提示NMDA功能低下与NGF降低存在一定联系,两者共同参与精神分裂症发病机制,具体作用机制需进一步研究探讨。
总之,本研究发现新生期阻断NMDA受体会引起大鼠成年期海马NR1、NR2A的代偿性增加,引起青春期前额叶部NGF下降,因而认为新生期阻断NMDA受体会引起NGF调节改变、谷氨酸系统长期代偿。新生期NMDA受体功能低下模型引起分子改变的病理机制仍需进一步研究探讨,这将对精神分裂症的发病机制、预防以及改善预后等有关研究有重要意义。
[1]Wang C,McInnis J,Ross-Sanchez M,et al.Long-term behav⁃ioral and neurodegenerative effects of perinatal phencyclidine administration:implications for schizophrenia[J].Neuroscience, 2001,107(4):535-550.
[2]Berry A,Bindocci E,Alleva E.NGF,brain and behavioral plas⁃ticity[J].Neural Plast,2012,2012:784040.
[3]Su YA,Wang XD,Li JT,et al.Age-specific effects of early MK-801 treatment on working memory in female rats[J].Neu⁃roreport,2011,22(8):402-406.
[4]Guo C,Yang Y,Su Y,et al.Postnatal BDNF expression profiles in prefrontal cortex and hippocampus of a rat schizophrenia model induced by MK-801 administration[J].J Biomed Bio⁃technol,2010,2010:783297.
[5]Akbarian S,Sucher NJ,Bradley D,et al.Selective alterations in gene expression for NMDA receptor subunits in prefrontal cor⁃tex of schizophrenics[J].J Neurosci,1996,16(1):19-30.
[6]Gao XM,Sakai K,Roberts RC,et al.Ionotropic glutamate recep⁃tors and expression of N-methyl-D-aspartate receptor subunits in subregions ofhuman hippocampus:effects of schizophrenia [J].Am J Psychiatry,2000,157(7):1141-1149.
[7]Dawson N,Xiao X,McDonald M,et al.Sustained NMDA recep⁃tor hypofunction induces compromised neural systems integra⁃tion and schizophrenia-like alterations in functional brain net⁃works[J/OL].Cereb Cortex,[2013-7-10].http://dx.doi.org/ 10.1093/cercor/bhs322.
[8]Manning SM,Boll G,Fitzgerald E,et al.The clinically avail⁃able NMDA receptor antagonist,memantine,exhibits relative safety in the developing rat brain[J].Int J Dev Neurosci,2011, 29(7):767-773.
[9]凌薇,刘伟亚,宋一志,等.NR1、NR2A与PSD-95在生后大鼠海马发育中的表达[J].神经解剖学杂志,2011,27(2):147-153.
[10]Wilson MA,Kinsman SL,Johnston MV.Expression of NMDA receptor subunit mRNA after MK-801 treatment in neonatal rats[J].Brain Res Dev Brain Res,1998,109(2):211-220.
[11]Lu L,Mamiya T,Lu P,et al.Prenatal exposure to phencyclidine produces abnormal behaviour and NMDA receptor expression in postpubertal mice[J].Int J Neuropsychopharmacol,2010,13(7): 877-889.
[12]Baier PC,Blume A,Koch J,et al.Early postnatal depletion of NMDA receptor development affects behaviour and NMDA re⁃ceptor expression until later adulthood in rats-a possible model for schizophrenia[J].Behav Brain Res,2009,205(1):96-101.
[13]Müller T,Albrecht D,Gebhardt C.Both NR2A and NR2B sub⁃units of the NMDA receptor are critical for long-term potentia⁃tion and long-term depression in the lateral amygdala of hori⁃zontal slices of adult mice[J].Learn Mem,2009,16(6):395-405.
[14]Fan H,Gao J,Wang W,et al.Expression of NMDA receptor and its effect on cell proliferation in the subventricular zone of neonatal rat brain[J].Cell Biochem Biophys,2012,62(2):305-316.
[15]Ling W,Chang L,Song Y,et al.Immunolocalization of NR1, NR2A,and PSD-95 in rat hippocampal subregions during post⁃natal development[J].Acta Histochem,2012,114(3):285-295.
[16]Sircar R,Follesa P,Ticku MK.Postnatal phencyclidine treat⁃ment differentially regulates N-methyl-D-aspartate receptor subunit mRNA expression in developing rat cerebral cortex[J]. Brain Res Mol Brain Res,1996,40(2):214-220.
[17]Anastasio NC,Johnson KM.Differential regulation of the NMDA receptor by acute and sub-chronic phencyclidine admin⁃istration in the developing rat[J].J Neurochem,2008,104(5): 1210-1218.
[18]Anastasio NC,Johnson KM.Atypical anti-schizophrenic drugs prevent changes in cortical N-methyl-D-aspartate receptors and behavior following sub-chronic phencyclidine administra⁃tion in developing rat pups[J].Pharmacol Biochem Behav, 2008,90(4):569-577.
[19]Wang SH,Liao XM,Liu D,et al.NGF promotes long-term memory formation by activating poly(ADP-ribose)polymerase-1[J].Neuropharmacology,2012,63(6):1085-1092.
[20]Gioiosa L,Iannitelli A,Aloe L.Stress,anxiety and schizophre⁃nia and neurotrophic factors:the pioneer studies with nerve growth factor[J].Riv Psichiatr,2009,44(2):88-94.
[21]Xiong P,Zeng Y,Wan J,et al.The role of NGF and IL-2 serum level in assisting the diagnosis in first episode schizophrenia[J]. Psychiatry Res,2011,189(1):72-76.
[22]Zafra F,Hengerer B,Leibrock J,et al.Activity dependent regu⁃lation of BDNF and NGF mRNAs in the rat hippocampus is me⁃diated by non-NMDA glutamate receptors[J].EMBO J,1990,9 (11):3545-3550.
[23]Ricci V,Martinotti G,Gelfo F,et al.Chronic ketamine use in⁃creases serum levels of brain-derived neurotrophic factor[J]. Psychopharmacology(Berl),2011,215(1):143-148.
[24]于文娟,朱浩,卢卫红,等.MK-801建立谷氨酸功能低下精神分裂症大鼠模型的研究[J].中国神经精神疾病杂志, 2011,37(10):621-624.
The effects of neonatal MK-801 treatment on expression of NMDA receptors and NGF in rats.
JIA Jiao,LI Jitao,HUANG Runhu,YANG Hong,SU Yunai,SI Tianmei.Department Of Mental Health,Dayi Hospital Affiliated to Shanxi Medical University,Taiyuan 030032,China.Tel:0351-8379346.
Objective To investigate the effects of repeated neonatal administration of dizocipline maleate(MK-801),the N-methyl-D-aspartate(NMDA)receptor antagonist,on the expression of NMDA receptor subunits NMDAR1 (NR1),NMDAR2A(NR2A),NMDAR2B(NR2B)and the protein levels of nerve growth factor(NGF)in neonatal rats. Methods Neonatal Sprague-Dawley(SD)rats were randomly divided into research group and control group,with 15 ani⁃mals in each group.Rats were administrated subcutaneously with MK-801 or normal saline from postnatal day(PND)5 to PND14(0.25 mg/kg,twice a day).The expression levels of NR1,NR2A,NR2B and NGF were examined on PND15, PND42 and PND70 in the prefrontal cortex and hippocampus.Results At PND15(neonatal period),there were no signif⁃icant differences in the expression levels of NR1,NR2A,NR2B and NGF in the prefrontal cortex and hippocampus be⁃tween the two groups(P>0.05).At PND42(adolescence),NGF protein levels in the prefrontal cortex was significantly low⁃er in research group than in control group[(56.19±37.87)vs.(152.54±53.92),P<0.01].At PND70(adulthood),the expres⁃sion of NR1,NR2A in the hippocampus was significantly higher in research group than in control group[NR1:(149.55%± 27.00%)vs.(100.00%±32.08%);NR2A:(171.54%±19.85%)vs.(100.00%±51.04%).P<0.05].Conclusion Neonatal re⁃peated treatment of MK-801 increases the expression of NMDA receptor subunits NR1,NR2A in the hippocampus in adulthood while decreases the expression of NGF in the prefrontal cortex in adolescence,suggesting that neonatal block⁃ade of the NMDA receptor may influence the growth and development of the nervous system.
Dizocilpine maleate N-methyl-D-aspartate receptor Nerve growth factor Schizophrenia
R749.3
A
2013-08-05)
(责任编辑:肖雅妮)
10.3936/j.issn.1002-0152.2013.12.007
☆ 国家自然科学基金(编号:30800361)
* 山西医科大学(太原030001)
** 山西医科大学附属山西大医院精神卫生科
*** 北京大学第六医院,北京大学精神卫生研究所,卫生部精神卫生学重点实验室(北京大学)
(E-mail:yhsgx@163.com;suyunai@163.com)
