溴氰菊酯对烟草K326抗氧化酶活性和MDA含量的影响
2013-11-22李新扬公玲玲井维霞刘修堂李慧婵曲爱军
顾 珂,李新扬,公玲玲,井维霞,刘修堂,李慧婵,曲爱军*
1山东农业大学植物保护学院,山东 泰安271018;2山东农业大学化学与材料科学学院,山东 泰安271018;3山东安丘实验中学,山东 潍坊262100
目前,在农林业害虫治理中,化学防治法仍占有主导地位。农药在使用过程中,大部分被植物、土壤、空气所吸收。然而,国内外有关农药对植物影响的研究较少。康乐(1995)明确提出农药为非自然的污染胁迫因子;各种胁迫因子主要通过活性氧对植物造成伤害,而抗氧化酶系统则是植物消除活性氧的主要途径(Bashir et al.,2007)。
溴氰菊酯(deltamethrin)是常用的拟除虫菊酯类杀虫剂之一,具有很强的触杀作用,有一定的胃毒作用和拒避活性,主要用于防治果树、蔬菜等作物上的重要害虫,对鳞翅目、直翅目、缨翅目、半翅目、双翅目、鞘翅目等多种害虫有效。但昆虫易对其产生抗药性(赵善欢,2000)。溴氰菊酯对非靶标生物体的影响,主要有鱼类和藻类等(魏华等,2010),但其对陆生作物生理生化的影响尚未见报道。因此,本试验研究溴氰菊酯对烟草K326 抗氧化酶活性和MDA 含量的影响,以期为该农药的合理使用提供依据。
1 材料与方法
1.1 材料
供试烟草品种为K326。在玻璃温室中采用塑料托盘育苗,育苗穴内装有基质,正常管理。待烟苗长至4 片叶时,移入花盆(直径12 cm、高10 cm),放入网室,并定期施肥、浇水(N:P:K 为20:20:20)。待烟草幼苗生长至9 叶1 芯时,选取长势基本一致、健壮无病虫的幼苗进行测定。
供试杀虫剂为25 g·L-1溴氰菊酯乳油(拜耳作物科学有限公司)。
1.2 药剂处理
在参照实际生产应用浓度的基础上,以不产生药害为标准,适当提高试验浓度。以丙酮为溶剂,将溴氰菊酯稀释至500、1000、1500 倍液(牟定荣等,2008)。用微量注射器移液枪取100 μL 药液,均匀涂抹于烟草幼苗第9 片叶上,微量注射器的针头不接触叶片。药剂处理24 h 后取样,测定烟草幼苗丙二醛(malonyldialdehyde,MDA)含量和抗氧化酶活性。以施用丙酮为对照,每个处理重复5 次。
1.3 测定方法
1.3.1 酶液提取 取烟草幼苗第9 片叶(去叶脉)0.5000 g于预冷的研钵中,加入2 mL 0.05 mol·L-1磷酸缓冲液(pH=7.8),在冰浴下研磨成浆,加缓冲液至终体积为6 mL。移入离心管,配平后于10000 r·min-1下离心15 min,上清液即为酶粗提液。
1.3.2 抗氧化酶活性的测定 超氧化物歧化酶(superoxide dismutase,SOD)活性的测定参照Giannopolitis & Ries (1977)的方法;过氧化氢酶(catalase,CAT)活性的测定参照Cakmak & Marschner (1992)的方法;抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性的测定参照Nakano & Asada (1981)的方法;谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)活性的测定参照Upadhyaya et al.(1985)的方法。
1.3.3 MDA 含量的测定 测定方法参照Dhindsa et al.(1981)。
1.4 数据统计分析
用DPS 软件统计数据,对所有数据进行方差分析,处理间的差异显著性用LSD 检验。
2 结果与分析
2.1 溴氰菊酯对烟草幼苗MDA 含量的影响
从图1可以看出,各浓度溴氰菊酯均会导致烟草幼苗MDA 含量下降。其中,1000 和1500 倍液处理结果与对照差异显著(P <0.05),500 倍液处理结果与对照差异极显著(P <0.01)。

图1 溴氰菊酯对烟草幼苗MDA 含量的影响Fig.1 Effects of deltamethrin on MDA contents
2.2 溴氰菊酯对烟草幼苗抗氧化酶活性的影响
由图2~5 可知,施用溴氰菊酯后,烟草幼苗SOD、CAT、APX、GPX 活性均下降。其中,各浓度处理后的SOD、CAT、APX 活性及500 倍液处理后的GPX 活性与对照差异显著(P <0.05),1000 和1500倍液处理后的GPX 活性与对照差异不显著(P >0.05)。

图2 溴氰菊酯对烟草幼苗SOD 活性的影响Fig.2 Effects of deltamethrin on SOD activities
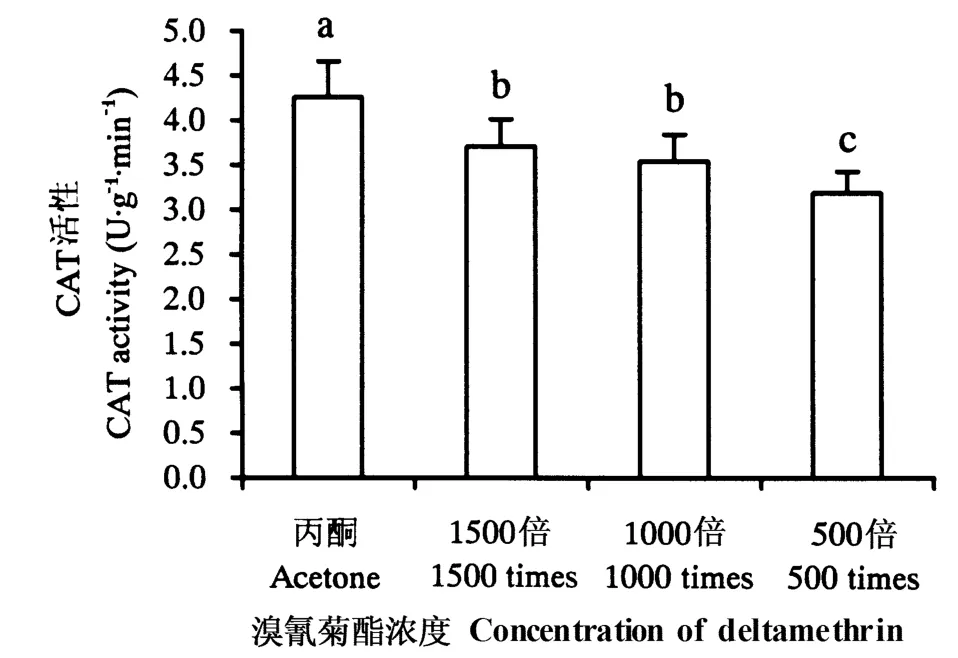
图3 溴氰菊酯对烟草幼苗CAT 活性的影响Fig.3 Effects of deltamethrin on CAT activities
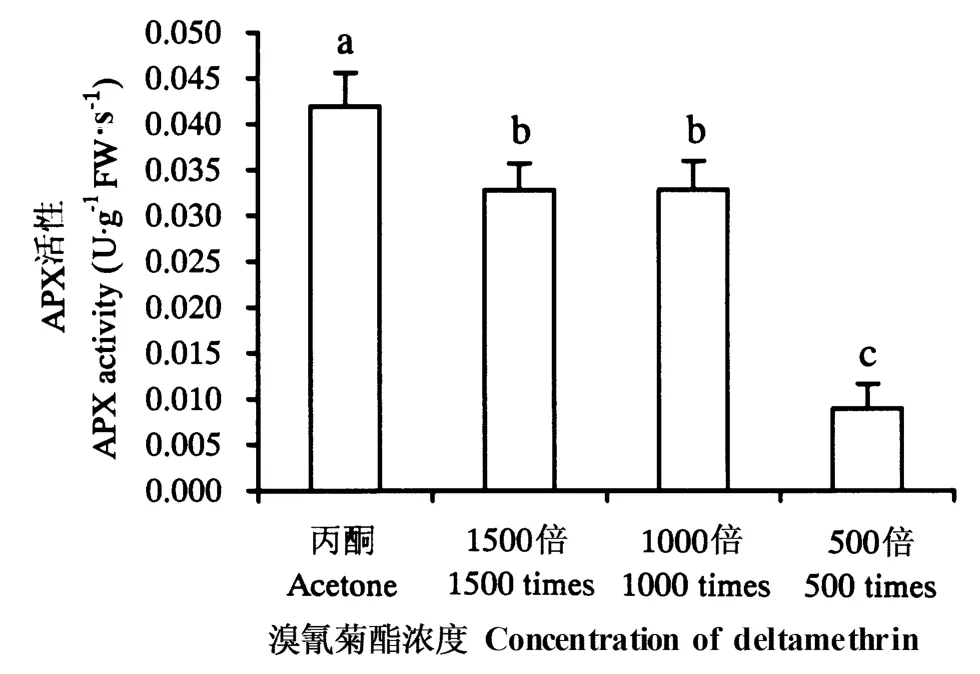
图4 溴氰菊酯对烟草幼苗APX 活性的影响Fig.4 Effects of deltamethrin on APX activities
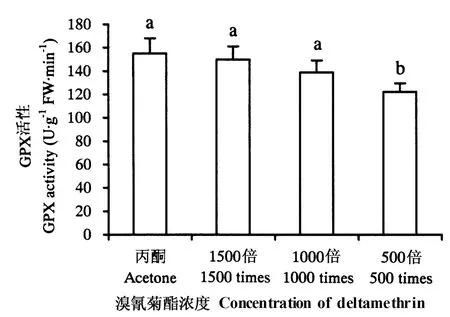
图5 溴氰菊酯对烟草幼苗GPX 活性的影响Fig.5 Effects of deltamethrin on GPX activities
3 讨论
在各种逆境条件下,植物体的自由基清除机制遭到破坏,自由基大量积累,启动膜脂过氧化反应,对生物膜造成损伤,使原生质体渗漏。MDA 是膜脂过氧化反应的最终产物,是反映植物在各种逆境胁迫下所受伤害程度的重要标志之一(Dhindsa et al.,1981)。本试验结果表明,施用溴氰菊酯后,烟草幼苗MDA 含量下降,表明溴氰菊酯不会对烟草幼苗生物膜产生破坏。
SOD 是植物抗氧化系统的第一道防线,是清除超氧阴离子()活性氧的主要酶,能与反应生成氧气和过氧化氢(Cakmak & Marschner,1992)。本研究表明,施用溴氰菊酯后,烟草幼苗的SOD 活性下降,说明溴氰菊酯并未导致的产生。
CAT 是一类广泛存在于动物、植物和微生物体内的末端氧化酶,其功能是催化细胞内过氧化氢分解,防止膜脂过氧化。研究表明,CAT 是C3 植物中清除H2O2的关键酶,且是C3 植物耐受胁迫所必需的酶(Nakano & Asada,1981)。GPX 也是生物清除H2O2的一种方式(Dhindsa et al.,1981)。本试验中,施用各浓度溴氰菊酯后,烟草幼苗的CAT、GPX活性都有所下降,说明在溴氰菊酯的作用下,幼苗未产生大量活性氧。
APX 是利用抗坏血酸为电子供体的H2O2清除剂,一般认为细胞叶绿体中的H2O2是由APX 清除的(Upadhyaya et al.,1985)。本试验中,施用溴氰菊酯后,APX 活性有所降低,说明溴氰菊酯不会对烟草幼苗叶绿体产生伤害。
综上所述,随着溴氰菊酯浓度的上升,MDA 含量及SOD、CAT、APX 和GPX 活性下降幅度增大,说明在500 ~1500 倍液浓度范围内,溴氰菊酯对烟草具有生态安全性。
康乐.1995.环境胁迫下的昆虫—植物相互关系.生态学杂志,14(5):51-57.
牟定荣,杨明权,董勇.2008.烟草中拟除虫菊酯类杀虫剂残留量的测定.烟草科技,(8):38-40,60.
魏华,吴楠,沈竑,成永旭,吴婷婷.2010.溴氰菊酯对克氏原螯虾的氧化胁迫效应.水产学报,34(5):733-739.
赵善欢.2000.植物化学保护.北京:中国农业出版社.
Bashir K,Nagasaka S,Nakanishi R,Kobayshi T,Takahashi M,Nakanishi H,Mori S and Nishizawa N.2007.Expression and enzyme activity of glutathione reductase is upregulated by Fe-deficiency in graminaceous plants.Plant Molecular Biology,65:277-284.
Cakmak I and Marschner H.1992.Magnesium defieieney and high light intensity on enhance activities of superoxide dismutase,peroxidase and glatation reductase in bean leaves.Plant Physiology,98:1222-1227.
Dhindsa R S,Plumb-Dhindsa P and Thorpe T A.1981.Leaf senescence:correlated with increased levels of membrane permeability and lipid peroxidation and decreased levels of superoxide dismutase and catalase.Journal of Experimental Botany,32:93-101.
Giannopolitis C N and Ries S K.1977.Superoxide dismutase.I.Occurrence in higher plants.Plant Physiology,159:309-314.
Nakano Y and Asada K.1981.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts.Plant and Cell Physiology,22:867-880.
Upadhyaya A,Sankhla D and Davis T D.1985.Effect of paclobutrazol on the activities of some enzymes of activated oxygen metabolism and lipid peroxidation in senescing soybean leaves.Journal of Plant Physiology,121:453-461.
