纳米银抗3型副流感病毒作用及机制研究
2013-11-22尹俭俭李秀景郑丛龙
尹俭俭,李秀景,郑丛龙
(大连大学医学院,辽宁大连116622)
副流感病毒(parainfluenza virus,PIV)属于副黏病毒科,为负单链RNA病毒,主要存在于呼吸道分泌物内,是引发婴幼儿呼吸道感染的重要病原体。其中,3型副流感病毒(PIV-3)仅次于呼吸道合胞病毒,能够引发6个月以下婴幼儿肺炎、支气管炎[1]。当感染PIV时,体内可产生局部抗体和血清抗体,但这样获得的免疫力较差,且婴幼儿抗体应答能力相对较弱,持续时间短,容易反复感染。对此,国内外还没有特别有效的抗PIV治疗药物。因此,需要研发有效的药物应对PIV的潜在威胁。纳米银是将纳米技术与金属银本身的抗菌防腐作用相结合而成的,已广泛应用于生物传感、食品工业、化妆品和医疗设备[2],在医学临床领域,也具有较好的抗菌效果[3]。近些年来,有关纳米银抗病毒作用已有报道,其对人类免疫缺陷病毒、乙肝病毒和流感病毒等有明显的抑制作用[4-6]。有关纳米银抗PIV作用及机制的研究报道较少,本文主要应用MTT法、透射电镜技术,神经氨酸酶活性抑制实验和小鼠体内实验来初步探讨纳米银抗PIV3的可能机制。
1 材料及方法
1.1 材料
1.1.1 细胞株和病毒株 传代细胞:狗肾细胞(MDCK)用于分离和培养PIV,购于大连市疾病预防和控制中心,经本实验室传代后保存,并用含10%胎牛血清的DMEM传代培养。病毒株:PIV3(血凝效价为1∶1 024),购自中国科学研究院武汉病毒研究所,经本实验室接种后冻存。
1.1.2 实验动物 清洁级ICR小鼠40只,雌雄各半,体质量18~22 g,由大连医科大学实验动物中心提供,动物生产许可证号:SCXK(辽)2008-0002。
1.1.3 主要试剂和试剂盒 DMEM:美国Gibco公司;纳米银溶液:由大连大学医学院病原生物学研究组应用化学还原法制得,质量浓度为400 mg/L,颗粒平均粒径约为10 nm,室温保存6个月无沉积现象发生;四甲基偶氮唑蓝(MTT):美国Sigma;二甲基亚砜(DMSO):上海生工;免疫荧光试剂盒:英国Dako Cytomation;神经氨酸酶活性检测试剂盒:江苏碧云天;2%磷钨酸负染液(pH=6.5):北京中镜科仪;乙醚:北京化工厂分析纯(纯度≥99.5%)。
1.1.4 主要仪器 酶标仪:瑞士TECAN;NU-5500E二氧化碳培养箱:NUAIR;BCN-1360B生物洁净工作台:北京东联哈尔仪器制造有限公司;CKX44倒置显微镜、荧光显微镜:日本Olympus。
1.2 方法
1.2.1 PIV3毒力测定 用DMEM细胞维持液将PIV3依次作 10 倍系列稀释,配制得 10-1、10-2、10-3、10-4、10-55 个不同梯度的病毒液。按 100 μL/孔分别加至已铺满单层MDCK细胞的96孔板中,每个剂量设置6个复孔,同时设正常细胞对照,将其置于37℃ 5%CO2孵箱培养2 h,弃去上清,PBS吹洗3遍,补加细胞维持液100 μL/孔继续培养,倒置显微镜下每日观察,连续观察6 d,培养结束弃去上清,PBS洗涤3次,按25 μL/孔加 MTT,放置在37℃,5%CO2孵箱培养4 h,弃上清后加入DMSO 150 μL/孔,置入酶标仪中,内部震荡混匀15 min后测光密度D(492 nm),实验重复3次。计算各组细胞存活率,根据Reed-Muench法,距离比例=(高于50%病变率的百分数-50%)/(高于50%病变率的百分数-低于50%病变率的百分数),lg半数感染剂量(TCID50)=距离比例×稀释度对数之间的差+高于50%病变率的稀释度的对数,计算PIV3的TCID50。
1.2.2 不同途径下纳米银体外对PIV3感染MDCK的抑制作用
1.2.2.1 纳米银对PIV3的直接灭活作用(直接灭活组) 先将25 mg/L的纳米银与等体积100 TCID50的PIV3液充分混合作用2 h,取混合液按100 μL/孔加至长满单层MDCK的培养板,37℃,5%CO2孵育2 h,弃上清,PBS吹洗3次,加细胞维持液100 μL/孔继续培养,观察细胞形态变化。细胞存活率检测方法同上。
1.2.2.2 纳米银对PIV3吸附和侵入MDCK的阻断作用(预防给药组) 将25 mg/L纳米银按100 μL/孔加至长满单层MDCK的培养板,孵育2 h,弃上清,PBS吹洗3次;然后将100 TCID50的 PIV3液按100 μL/孔加入上述处理的培养板,37℃,5%CO2吸附2 h,弃上清,PBS吹洗3次,最后加细胞维持液100 μL/孔继续培养,观察细胞形态变化。当病毒对照组细胞形态变化达75%以上时,采用MTT法检测各组细胞的存活率。
1.2.2.3 纳米银对PIV3子代病毒体增殖的抑制作用(治疗给药组) 将100 TCID50的PIV3液按100 μL/孔加至长满单层MDCK的培养板,充分吸附2 h,弃病毒液,PBS吹洗3次,再将25 mg/L的纳米银溶液按100 μL/孔加入上述处理的培养板中,37℃,5%CO2孵育2 h,弃上清,PBS吹洗3次,补加维持液100 μL/孔继续培养,观察细胞形态变化。细胞存活率检测方法同上。
同时设正常细胞组、病毒对照组、纳米银对照组,每个质量浓度设置6个复孔,MTT法检测细胞存活率,实验重复3次。
1.2.3 免疫荧光法检测纳米银在MDCK内对PIV3的抑制作用 待MDCK在附有盖玻片的6孔培养板中长至75%左右时,按照上述3种不同途径处理MDCK后进行免疫荧光检测。当病毒对照组细胞形态显示明显病变时(达75%以上),取出盖玻片,用冰浴上的PBS吹洗3次,4℃预冷丙酮固定30 min,PBS吹洗3次,滴加30 μL免疫染色封闭液,37℃孵育30 min,PBS吹洗3次,然后再滴加30 μL用FITC标记的抗体于各盖玻片上,37℃孵育30 min,取下盖玻片,PBS吹洗3次,用滤纸吸干薄片边缘液体,封片液封片,置于荧光显微镜下观察并拍照记录。
1.2.4 神经氨酸酶活性抑制实验 PIV3的神经氨酸酶活性可以通过神经氨酸酶抑制实验来检测[7]。按照试剂盒要求操作,病毒液在室温条件下分别与75 mg/L和37.5 mg/L的纳米银作用30 min和60 min,同时设阳性对照和阴性对照,加入荧光酶作用底物充分混匀,37℃ 孵育10 min。设定激发波长和发射波长分别为355 nm和460 nm,测定荧光强度值,并计算神经氨酸酶活性的抑制百分率。
1.2.5 透射电镜负染色法观察纳米银对PIV3粒子的破坏作用 将150 mg/L纳米银与PIV3液等体积混合,两者充分作用30,60和120 min;镊子夹住铜网边缘并浸没于上述样品中静置20 min;夹出,用滤纸将铜网边缘吸去悬液,自然晾干至肉眼看不到残留液后,将铜网浸没于磷钨酸负染液中静置3~5 min;干燥后用透射电镜观察。
1.2.6 纳米银对小鼠PIV感染治疗的作用效果
1.2.6.1 分组 将小鼠随机分成5组:正常对照组、阳性对照组、纳米银对照组、病毒对照组和纳米银治疗组(纳米银质量溶度为400 mg/L),每组8只,雌雄各半,分笼饲养。
1.2.6.2 纳米银治疗组动物模型的建立和肺组织病理学检查 小鼠经乙醚麻醉,当进入麻醉状态且用鼻呼吸急促时,迅速进行滴鼻。正常对照组和纳米银对照组滴鼻40 μL生理盐水,阳性对照组、病毒对照组和纳米银治疗组滴鼻40 μL PIV3液。滴病毒液4 h后进行治疗:病毒照组和正常对照组滴生理盐水40 μL,纳米银治疗组和纳米银对照组滴纳米银40 μL,阳性对照组采用利巴韦林口服药灌胃,此为第1次治疗。此后每隔24 h按此操作进行1次治疗,总计3次。4 d后无菌剖取肺组织,用10%甲醛固定作病理切片,于光学显微镜下观察病理变化。
1.3 统计学分析
采用SPSS 17.0统计学软件处理数据,计量资料用均数±标准差(±s)表示。多组间均数比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 纳米银对MDCK的毒性作用及PIV3的毒力
纳米银对MDCK作用的最大无毒质量浓度(TC0)为 25 mg/L[8],PIV3 对 MDCK 细胞作用的TCID50为10-1.35/mL。当纳米银浓度大于 25 mg/L后,则开始抑制MDCK生长。纳米银对MDCK的毒性作用主要表现为细胞颗粒增多,大小不均,增殖缓慢,细胞回缩、变圆、成串脱落死亡。纳米银对细胞的毒性作用随着纳米银溶液质量浓度的降低而降低,细胞存活率相应增加。
2.2 MTT法检测纳米银对PIV3的抑制作用
结果表明,纳米银处理组(直接灭活组,预防给药组,治疗给药组)的细胞存活率与病毒对照组相比,差异有统计学意义(P<0.01)。见表1。
表1 不同组MTT检测结果的比较±sTab 1 Comparison of MTT assay results in different groups

表1 不同组MTT检测结果的比较±sTab 1 Comparison of MTT assay results in different groups
a:P <0.01,与病毒对照组比较
组别 MTT值 细胞存活率/%直接灭活组 0.8273 ±0.04 94.81 ±0.02a预防给药组 0.8120 ±0.04 93.05 ±0.05a治疗给药组 0.7882 ±0.01 90.32 ±0.02a正常细胞组 0.8727±0.04 —病毒对照组 0.2470 ±0.05 25.50 ±0.06纳米银对照组 0.8308 ±0.03 95.21 ±0.04 F 值 361.542 332.327 P值 <0.01 <0.01
2.3 免疫荧光法检测纳米银对PIV3的抑制作用
待MDCK在置有盖玻片的6孔培养板上铺满单层后,将纳米银和PIV3作不同的处理,封片,于倒置显微镜下观察。如图1所示,正常MDCK组未见特异性黄绿色荧光,细胞形态正常;病毒对照组和溶剂对照组(溶剂与PIV3混合组)中,MDCK均出现了很强的特异性黄绿色荧光,细胞肿胀变圆、间隙增大、细胞死亡或脱落;预防用药组、直接灭活组、治疗用药组的细胞内特异性荧光均很少见,细胞形态变化不大,细胞稍微回缩,但形态基本正常。
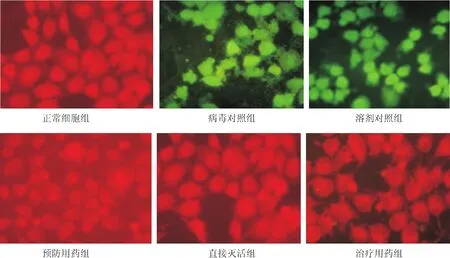
图1 不同组细胞的免疫荧光法检测结果Fig 1 Immunofluorescence analysis of cells in different groups
MTT和免疫荧光的结果表明,纳米银能明显抑制PIV3的复制和子代病毒的合成,对PIV3的侵入有一定的阻断作用,对PIV3及其吸附有破坏作用。
2.4 纳米银对神经氨酸酶活性的抑制
不同质量浓度的纳米银(75 mg/L和37.5 mg/L)分别与PIV3相互作用30 min和60 min,再孵育10 min,纳米银对PIV3神经氨酸酶活性的抑制率均高于80%,而病毒对照组和溶剂对照组的抑制率均低于20%(图2)。神经氨酸酶催化唾液酸与糖蛋白之间糖苷键的水解,协助病毒颗粒穿过呼吸道黏液和促进子代病毒体脱离于感染细胞[9]。上述结果表明,纳米银可以通过作用于PIV3神经氨酸酶药物靶点来阻断病毒对细胞的感染。
2.5 纳米银对PIV3粒子的破坏作用
PIV3液经透射电镜负染色后,可观察到正常PIV3颗粒,自外而内可见清晰的包膜和基质,符合PIV3的形态特征。PIV3与纳米银相互作用30 min后,其形态部分缺损;相互作用60 min,结构完全被破坏;作用120 min,病毒被破坏成更小的碎片,形态已无法观察。见图3。结果表明,纳米银颗粒可能直接破坏PIV3的形态和结构。
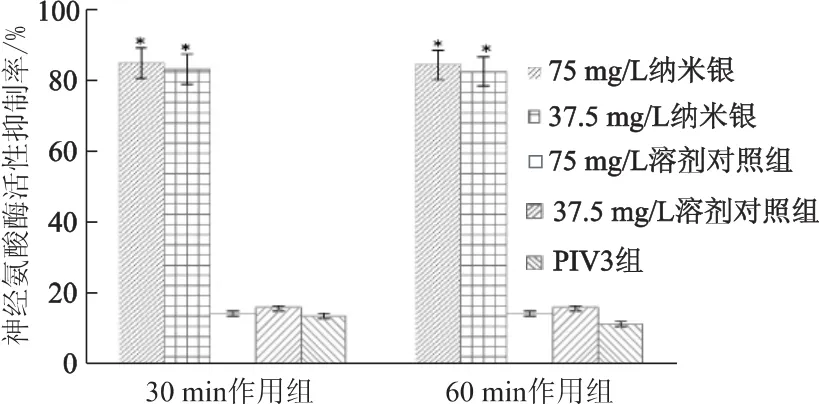
图2 不同组神经氨酸酶活性的抑制率Fig 2 The inhibition rate of neuraminidase activity in different groups
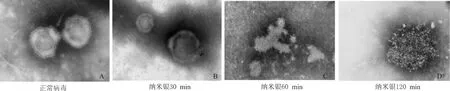
图3 3型副流感病毒的形态结构(透射电镜负染×200 000)Fig 3 Transmission electron microscope negative staining of parainfluenza virus 3(PIV3)
2.6 纳米银小鼠感染PIV3后的治疗结果
2.6.1 一般生理状况 正常对照组ICR小鼠毛发光滑,活动敏捷,饮食、饮水正常,体质量持续增加;病毒对照组滴病毒后3 d,活动减少,毛色不光泽,开始出现战栗,饮食和饮水减少,体质量减轻。病毒对照组体质量与纳米银治疗组比较,差异无统计学意义。
2.6.2 肺指数 肺指数用来表示肺病变的严重程度。PIV3感染小鼠后引起肺部炎性细胞浸润、水肿、充血,导致肺重量增加,肺指数增大。病毒对照组小鼠肺指数高于正常对照组,但差异无统计学意义;肉眼观,肺组织部分充血,水肿,颜色暗红。纳米银治疗组的小鼠肺组织与正常对照组比较接近,颜色呈粉红,无差异。
2.6.3 肺组织病理变化 无菌剖取小鼠肺组织,可见正常对照组和纳米银对照组小鼠肺呈粉红色,体积较小;病毒对照组小鼠肺充血水肿,颜色部分暗红,体积增大;纳米银治疗组小鼠肺体积大小与正常小鼠相近,但部分部位有充血现象。光镜下结果显示(图4),正常对照组和纳米银对照组小鼠肺组织的形态结构完整,肺泡大小均一,肺泡壁厚度正常,外周未见有炎性细胞浸润;病毒对照组小鼠肺组织的形态结构消失,肺泡壁增厚,组织间可见大量红细胞,肺泡腔有炎性细胞浸润;纳米银治疗组小鼠肺组织的病变明显减轻,肺组织形态结构较为完整,肺泡腔中炎性细胞浸润较少。

图4 各组小鼠肺组织病理形态(HE染色×200)Fig 4 Pathological images of lung tissues in different mouse groups
3 讨论
副流感病毒包膜表面突出有2种重要的糖蛋白:HN糖蛋白和F糖蛋白。HN糖蛋白通过与宿主细胞膜上的唾液酸受体结合,主要协助病毒表面蛋白和宿主细胞包膜之间的相互融合,促进病毒进入细胞,与病毒的装配释放有关[10]。F糖蛋白具有使细胞融合剂溶解红细胞的作用[1],是病毒与宿主细胞融合所必需的,能够促进病毒核衣壳进入并感染宿主细胞。银有很强的杀菌能力,在古代人们就认识到银制品具有抗菌防腐作用,并将其用于实际生活中。纳米银在较低浓度下可对细菌和真菌产生抑制作用[2],主要通过与菌体中酶蛋白的巯基(-SH)相结合,使酶失活,导致病原菌不能代谢而死亡[11]。此外,纳米银易通过化学键与外来原子结合,具备吸附病毒的能力[12]。
本实验探讨了纳米银对PIV3的抑制作用及其机制。MTT结果显示,3种不同给药方式下的纳米银处理组与PIV3对照组相比,差异具有统计学意义(P<0.01);荧光实验结果显示,病毒对照组细胞内部的免疫荧光强度明显强于各实验组,说明纳米银在体外对PIV3有抑制作用,其作用机制可能是纳米银与细胞表面受体结合,改变膜表面蛋白的构象,导致对PIV3敏感的细胞变为不敏感的细胞;或者封闭细胞和病毒膜上的受体,阻止病毒的吸附,使其不能进入细胞内复制。纳米银作用组的神经氨酸酶活性明显降低(抑制率高于80%),说明纳米银破坏或抑制了PIV3膜上的血凝素——神经氨酸酶蛋白,即破坏或抑制了神经氨酸酶的生物活性。透射电镜显示,与PIV3形态相比,纳米银与病毒作用30,60,120 min后,对病毒形态结构的破坏作用随着时间的延长而增加,说明纳米银能直接破坏PIV3的形态和结构,进而可能影响某些相关蛋白的表达和遗传物质的复制。
动物实验结果显示,纳米银治疗组、阳性对照组和正常对照组3组小鼠生理状态没有差异,而病毒对照组小鼠出现饮食饮水下降,毛色变暗,没有光泽;从病理切片上看,纳米银治疗组小鼠的肺组织接近正常小鼠,而病毒对照组小鼠的肺组织有充血,水肿,炎性浸润等明显的病变。在PIV3感染的ICR小鼠动物模型中,病毒对照组小鼠体质量3~5 d出现一过性降低,之后回升。5 d后解剖小鼠,比较小鼠生理状态、肺组织切片等指标,差异均有统计学意义,但小鼠体质量、死亡率、肺指数等指标差异无统计学意义;结果表明,纳米银对小鼠PIV3有一定的治疗作用。小鼠体质量、死亡率、肺指数等指标差异无统计学意义的原因可能因为ICR小鼠对PIV3产生了免疫作用,从而掩盖了纳米银的部分治疗作用。进一步实验应该选择和建立更敏感的动物模型,或缩短动物感染后检测时间,检测鼠肺中病毒滴度及动物发病率和死亡率。
纳米银对小鼠毒理安全性的研究本实验室已报道,证实其低毒性对黏膜和皮肤无刺激性[13]。有研究[14]显示,连续吸入60 nm的纳米银颗粒28 d,其呼吸系统和血液生化指标没有显著变化。Stebounova等[15]研究发现,小鼠暴露在纳米银的环境中(3.3 mg/m3)连续吸入40 h,诱导的肺部毒性和炎症反应非常低;与暴露在新鲜空气环境中的小鼠比较,其肺功能、死亡率、临床观察、食物摄入量、体质量等指标没有明显差异[16]。纳米银的低毒性、无耐药性以及广谱抗病毒和抗菌特性,在呼吸道病毒感染的预防和治疗中具有独特的价值,值得深入研究。本研究中纳米银确切的抗PIV3机制还需作进一步探讨,如通过反转录PCR、实时定量PCR等技术可探讨纳米银对PIV3核酸的影响作用;通过蛋白印迹技术可探讨纳米银对宿主细胞信号通路传导的影响,解释纳米银间接抗病毒的作用和机制。
[1] Henrickson KJ.Parainfluenza viruses[J].Clin Microbiol Rev,2003,16(2):242-264.
[2] You C,Han C,Wang X,et al.The progress of silver nanoparticles in the antibacterial mechanism,clinical application and cytotoxicity[J].Mol Biol Rep,2012,39(9):9193-9201.
[3] 王冬梅,莫遗盛,江晓筠.纳米银临床应用研究进展[J].中国药房,2007,18(5):386-387.
[4] Sun RW,Chen R,Chung NP,et al.Silver nanoparticles fabricated in Hepes buffer exhibit cytoprotective activities toward HIV-1 infected cells[J].Chem Commun(Camb),2005(40):5059-5061.
[5] Lu L,Sun RW,Chen R,et al.Silver nanoparticles inhibit hepatitis B virus replication[J].Antivir Ther,2008,13(2):253-262.
[6] 向冬喜,蒋晓婷,李秀景,等.纳米银体外抗H3N2流感病毒作用及其机制初步探讨[J].华西医学,2011,26(1):4-7.
[7] Gubareva LV.Molecular mechanisms of influenza virus resistance to neuraminidase inhibitors[J].Virus Res,2004,103(1/2):199-203.
[8] 裘红梅,于舒,苗迎秋,等.纳米银抑制副流感病毒的研究[J].实用医学杂志,2010,26(14):2473-2476.
[9] Kim SH,Subbiah M,Samuel AS,et al.Roles of the fusion and hemagglutinin-neuraminidase proteins in replication,tropism,and pathogenicity of avian paramyxoviruses[J].J Virol,2011,85(17):8582 -8596.
[10] Sealy R,Surman S,Hurwitz JL,et al.Antibody response to influenza infection of mice:different patterns for glycoprotein and nucleocapside antigens[J].Immunology,2003,108(4):431-439.
[11] Wilkinson LJ,White RJ,Chipman JK.Silver and nanoparticles of silver in wound dressings:a review of efficacy and safety[J].J Wound Care,2011,20(11):543-549.
[12] Elechiguerra JL,Burt JL,Morones JR,et al.Interaction of silve nanoparticles with HIV-1[J].J Nanobiotechnology,2005,3(6):1-10.
[13] 向冬喜,陈娜娜,裘红梅,等.纳米银毒理学安全性研究[J].实用医学杂志,2010,26(11):1906-1908.
[14] Ji JH,Jung JH,Kim SS,et al.Twenty-eight-day inhalation toxicity study of silver nanoparticles in Sprague-Dawley rats[J].Inhal Toxicol,2007,19(10):857 -871.
[15] Stebounova LV,Adamcakova-Dodd A,Kim JS,et al.Nanosilver induces minimal lung toxicity or inflammation in a subacute murine inhalation model[J].Part Fibre Toxicol,2011,8(1):1 -12.
[16] Sung JH,Ji JH,Song KS,et al.Acute inhalation toxicity of silver nanoparticles[J].Toxicol Ind Health,2011,27(2):149-154.
