急性肺损伤患者外周血Th17细胞水平及功能的研究
2013-11-21刘泽宇夏书月何巍
刘泽宇 夏书月 何巍
急性肺损伤(acute lung injury,ALI)是指心源性以外的各种肺内、外致病因素所导致的急性进行性缺氧性呼吸衰竭,病情凶险,死亡率高。失控的炎症反应是发病机制的核心,避免炎症反应失控是降低ALI病死率的关键。近年的研究发现了一种新型的T细胞亚群,可以产生IL-17,因此称之为Th17细胞亚群[1]。维甲酸相关核孤儿受体γt(Retinoid-related orphan receptor gammat,RORγt)是调节Th17细胞分化的特异性转录因子,直接决定了Th17细胞的分化能力。Th17细胞通过分泌IL-17等细胞因子,在免疫调控网络中发挥重要作用,参与炎性反应、自身免疫性疾病和移植排斥等。进一步的研究表明,Th17细胞和哮喘、COPD等多种肺部疾病具有相关性。但对于Th17细胞与ALI是否相关,目前还未见报导。本研究通过检测ALI患者外周血中RORγt mRNA的表达量、Th17细胞的比例和血浆中IL-17的水平来了解Th17细胞的分化能力、数量多少和功能状况,进而明确Th17细胞和ALI的关系,推测Th17细胞可能发挥的调控作用。
1 资料与方法
1.1 一般资料 选择2009年10月至2011年12月期间,在沈阳医学院奉天医院呼吸内科住院的ALI患者10例。入选标准:符合中华医学会重症医学分会制定的《急性肺损伤/急性呼吸窘迫综合征诊断治疗指南》所推荐的ALI诊断标准。其中男性6例,女性4例,平均年龄(68±11)岁,入组时患ALI的天数为(3±1)d,氧合指数(PaO2/FiO2)为(235±48)mm Hg。排除标准:留取血标本前已经应用了糖皮质激素。对照组为健康志愿者10人,同样选取男性6例,女性4例,平均年龄(65±9)岁。本研究得到了沈阳医学院奉天医院伦理委员会批准,所有受试者均已签署知情同意书。
1.2 研究方法
1.2.1 收集标本 清晨空腹抽取受试者外周血至少7 ml。其中5 ml用于提取RNA,1 ml用于流式细胞学检测,1 ml用于酶联免疫吸附试验(ELISA)检测。
1.2.2 RT-PCR检测RORγt mRNA的表达量 Trizol(购自美国Invitrogen公司)法提取 RNA,配制 RNA/Primer混合物(RT-PCR试剂盒购自美国Invitrogen公司):总RNA5 μl+Oligo(dT)20 50 μM)1 μl+dNTP mix(10 mM)1 μl+ddH2O(DEPC 处理过)3 μl(补到 10 μl),再配制 cDNA Synthesis Mix:10 × RTbuffer2 μl+25 mM MgCl24 μl+0.1 m DTT 2 μl+RNaseOUT(40U/μl)1 μl+SuperScriptⅢ RT(200U/μl)1 μl。将10 μl cDNA Synthesis Mix 加入 RNA/Primer混合物中,反应后加入 RNase H降解残留的 RNA。在 NCBI中查到RORγt的 cDNA 序 列,设 计 引 物 为:上 游 引 物5'GCAACAGCAGCAACAGGA3'、 下 游 引 物5'TCAGGGAGGCATAGGGTG3'、产物长度为428bp(引物由上海英骏生物技术有限公司合成)。将β肌动蛋白(β-actin)基因作为内参,上游引物为:5'GCTCGTCGTCGACAACGGCTC3'、下游引物为5'CAAACATGATCTGGGTCATCTTCTC3'、产物长度为353bp。将 PCR buffer、dNTPmix、上游引物、下游引物、Taq酶、cDNA模板、ddH2O加入一薄壁离心管中,进行PCR扩增(PCR仪为德国Promega公司产品)。反应条件为:94℃预变性5 min。94℃变性 30s,61.5℃退火 30s,72℃延伸 40s,30 个循环。最后72℃再延伸10 min。DM2000(购自北京天根生化科技有限公司)为DNA分子量标准,进行琼脂糖凝胶电泳,用RORγt对β-actin的累积光密度(IOD)的比值作为RORγt的相对量,进行统计分析。
1.2.3 流式细胞术检测Th17细胞的比例 将外周血按1∶1的比例与RPMI-1640培养基(购自美国Gibco公司)混匀,加入激活剂佛波酯(PMA),离子霉素(Ionomycin)和高尔基体阻断剂Brefeldin-A(BFA)(均购自美国Sigma公司),培养4 h后与结合有FITC的抗人CD4单抗(购自美国BD公司)反应30 min。再经过溶血素(购自碧云天公司)裂解红细胞,Fix&perm(购自美国Caltag公司)固定、破膜。最后与结合有PE的抗IL-17单抗(购自美国BD公司)反应,流式细胞仪检测。
1.2.4 ELISA检测IL-17浓度 取出包被有IL-17抗体的酶标板(购自美国R&D公司),分别加入血浆和不同浓度的标准品并孵育。此后依次经过与生物素化抗体、酶结合物、显色剂、终止液的多步反应,最后测量OD450值,计算血浆中IL-17的浓度。
1.2.5 统计学方法 首先进行两样本的方差齐性检验,P>0.05为方差齐。再做两个独立样本的t检验,P<0.05为差异有统计学意义。
2 结果
2.1 外周血中RORγt mRNA的表达水平 RORγt mRNA在ALⅠ组的表达水平(0.56±0.08)高于对照组(0.19±0.05),差异显著(P<0.01),见图1。

图1 RORγt mRNA
2.2 外周血中Th17细胞的比例 Th17细胞在ALⅠ组的比例(32.60% ±5.51%)高于对照组(12.29% ±1.71%),有统计学差异(P<0.01),见图2。
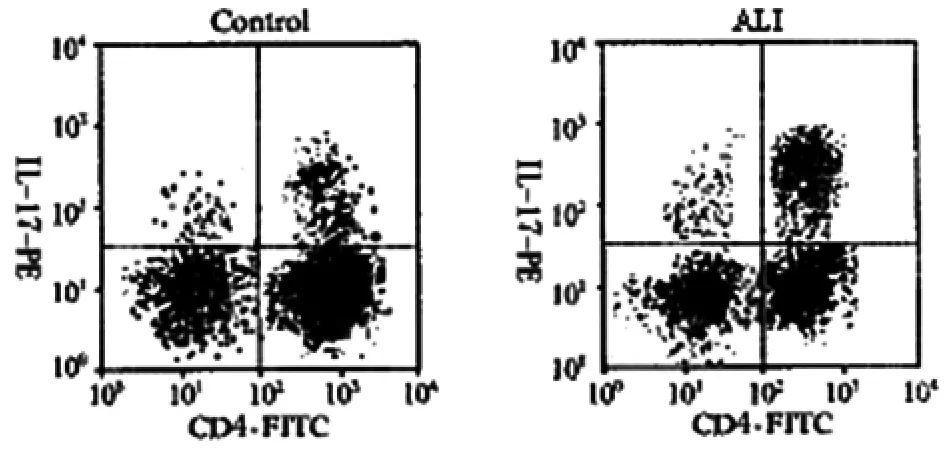
图2 Th17细胞的比例
2.3 血浆中IL-17的浓度 IL-17在ALⅠ组的浓度(87.33±6.08)pg/ml明显高于对照组(52.71±3.19)pg/ml,P <0.01,见图3。
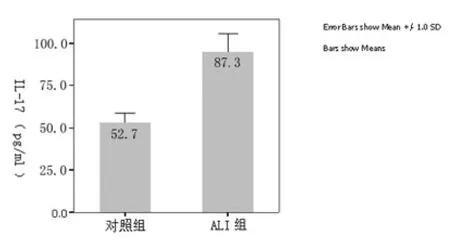
图3 IL-17的浓度
3 讨论
ALI属于一种特殊类型的急性呼吸衰竭,具有病情凶险,死亡率高的特点。目前认为,失控的炎症反应是发病机制的核心,避免炎症反应失控是降低ALI病死率的关键,也是目前研究的热点之一。
对于在免疫调控网络中起重要作用的辅助性T细胞(Th),根据所分泌的细胞因子的不同,传统上将其分为Th1和Th2两个亚群。Th1细胞以分泌INF-γ和IL-2为主,Th2细胞以分泌IL-4、IL-5和IL-13为主。而近年的研究发现了一种新型的Th细胞亚群,以产生IL-17为主,但不能产生INF-γ和IL-4,因此称之为Th17细胞亚群[1]。Th17细胞是由初始T细胞分化而来,在细胞和分子水平受到精细调节。TGF-β是启动Th17细胞分化的始动因素[2],IL-6是协同促进Th17细胞分化的关键因子,而IL-23则对Th17细胞的存活和增殖发挥重要作用[3]。虽然Th17细胞可以分泌多种细胞因子,但主要还是通过分泌IL-17来发挥生物学作用,广泛参与抗感染[4]、自身免疫[5]和移植排斥[6]等。
RORγt是调节 Th17细胞分化的特异性转录因子,在Th17细胞分化发育过程中起到极其重要的作用。体外实验显示,在TGF-β和IL-6的共同作用下,初始CD4+T细胞可以分化为Th17细胞,但需要RORγt的表达,即使没有其他的外源性细胞因子,加强表达RORγt也足以诱导Th17细胞的分化[7]。当 RORγt缺乏时,Th17 细胞的数量也随之显著下降[8]。RORγt基因敲除的小鼠不易出现严重的自身免疫性疾病[9],炎症组织中 Th17细胞也明显减少[10]。这些研究结果均提示,RORγt可以通过促进Th17细胞的分化,间接起到上调炎症反应的作用。本研究的结果表明,在ALI患者的外周血中,淋巴细胞表达RORγt的水平较对照组明显升高,这会有力地促进初始CD4+T细胞向Th17细胞分化,进而上调炎症反应,这与上面提到的研究结论是一致的。
虽然有多种细胞可以分泌IL-17,但IL-17的主要来源仍然是Th17细胞。作为一种细胞因子,参与包括哮喘和COPD在内的多种炎症性疾病。利用动物模型,对Th17细胞/IL-17和多种肺部疾病之间关系所进行的研究,已经取得了一定进展。李鸿佳等[11]发现,哮喘小鼠外周血中Thl7细胞明显增多,BALF中IL-17的水平显著升高。在哮喘小鼠肺组织中,增多的Thl7细胞不但促进中性粒细胞在局部的浸润,而且增强变应原诱导的气道高反应性[12]。McKinley等[13]将 Th17细胞通过静脉注入到T细胞缺失的哮喘小鼠体内,诱导出IL-17,气道内中性粒细胞聚集和气道高反应性。总之,哮喘小鼠体内IL-17可以通过募集并激活中性粒细胞等多种方式发挥促炎作用[14]。而在 COPD 方面,Alcorn等[15]对 IL-17RA 基因敲除的小鼠进行研究发现,香烟暴露导致肺气肿的严重程度较野生型小鼠减低,说明IL-17对肺气肿的形成有促进作用。Shen等[16]将抗IL-17抗体注入香烟暴露的小鼠腹腔内,去除小鼠体内的IL-17,肺组织匀浆中IL-17的浓度下降,支气管肺泡灌洗液中中性粒细胞的水平降低,小气道炎症明显缓解,从反面证明IL-17可以上调COPD的气道炎症反应。我们的研究表明,与对照组比较,ALI患者外周血中Th17细胞的比例增加,IL-17的浓度升高,差异有统计学意义。这提示Th17细胞可能通过分泌IL-17来上调炎症反应,加重炎症反应的失控。这与前面提到的哮喘和COPD动物模型中所见到的情况是相吻合的。
虽然Th17细胞与多种肺部疾病相关,但与ALI是否相关,目前还未见报导。我们对ALI患者外周血中Th17细胞和IL-17进行研究后发现:ALI患者外周血中Th17细胞的分化加强,数量增多,血浆中IL-17的水平增高。据此推测,Th17细胞参与了ALI的发病过程,可能通过分泌以IL-17为主的细胞因子,加重气道炎症反应。今后的研究方向包括进一步深化对Th17细胞生物学特点的认识,尝试通过干预Th17细胞来控制炎症反应,改善ALI的预后。
[1]Harrington LE,Hatton RD,Mangan PR,et al.Interleukin 17-producing CD4+effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages.Nat Immunol,2005,6(11):1123-1132.
[2]Mangan PR,Harrington LE,O'Quinn DB,et al.Transforming growth factor-beta induces development of the Th17 lineage.Nature,2006,441(7090):231-234.
[3]McGeachy MJ,Chen Y,Tato CM,et al.The interleukin 23 receptor is essential for the terminal differentiation of interleukin 17-producing effector T helper cells in vivo.Nat Immunol,2009 Mar;10(3):314-324.
[4]Bǎlǎnescu P,Lǎdaru A,Voiosu T,et al.Th17 and IL-17 immunity in chronic hepatitis C infection.Rom J Intern Med,2012,50(1):13-18.
[5]Chiricozzi A,Zhang S,Dattola A,et al.New insights into the pathogenesis of cutaneous autoimmune disorders.J Biol Regul Homeost Agents,2012,26(2):165-170.
[6]Nakagiri T,Inoue M,Minami M,et al.Immunology mini-review:the basics of T(H)17 and interleukin-6 in transplantation.Transplant Proc,2012,44(4):1035-1040.
[7]Cha HR,Chang SY,Chang JH,et al.Downregulation of Th17 cells in the small intestine by disruption of gut flora in the absence of retinoic acid.J Immunol,2010,184:6799-6806.
[8]Hirahara K,Ghoreschi K,Laurence A,et al.Signal transduction pathways and transcriptional regulation in Th17 cell differentiation.Cytokine Growth Factor Rev,2010,21(6):425-434.
[9]Kwan BC,Tam LS,Lai KB,et al.The gene expression of type 17 T-helper cell-related cytokines in the urinary sediment of patients with systemic lupus erythematosus.Rheumatology(Oxford),2009,48:1491-1497.
[10]Buonocore S,Ahern PP,Uhlig HH,et al.Innate lymphoid cells drive interleukin-23-dependent innate intestinal pathology.Nature,2010,464:1371-1375.
[11]李鸿佳,盖庆玲,王立华,等.Thl7淋巴细胞在哮喘小鼠气道炎症中的初步研究。细胞与分子免疫学杂志,2011,27(1).
[12]Wilson RH,Whitehead GS,Nakano H,et al.Allergic sensitization through the airway primes Th17-dependent neutrophilia and airway hyperresponsiveness.Am J Respir Crit Care Med,2009,180(8):720-730.
[13]McKinley L,Alcorn JF,Peterson A,et al.TH17 cells mediate steroid-resistant airway inflammation and airway hyperresponsiveness in mice,J.Immunol,181,(2008):4089-4097.
[14]Iwakura Y,Ishigame H,Saijo S,et al.Functional specialization of interleukin-17 family members.Immunity,2011,34(2):149-162.
[15]Alcorn JF,Crowe CR,Kolls JK,et al.TH17 cells in asthma and COPD.Annu Rev Physiol,2010,72:495-516.
[16]Shen N,Wang J,Zhao M,et al.Anti-interleukin-17 antibodies attenuate airway inflammation in tobacco-smokeexposed mice.Inhal Toxicol,2011:23:212-218.
