ABCE1基因对小细胞肺癌增殖、侵袭、迁移能力的影响
2013-11-20王晓东郎贤平辽宁医学院附属第一医院胸外科辽宁锦州121000
黄 波 王晓东 郎贤平 (辽宁医学院附属第一医院胸外科,辽宁 锦州 121000)
小细胞肺癌约占全部肺癌的20% ~25%,其恶性程度高,发展迅速,早期可有远处广泛的转移,确诊时70% ~90%病人已有临床或亚临床的淋巴或血行转移,自然病程短。小细胞肺癌对放、化疗敏感,近期疗效好,缓解率可达65% ~90%,但90%以上患者治疗后出现复发和转移,而肿瘤的转移和侵袭是治疗失败患者死亡的主要原因〔1〕,因此寻找新的途径治疗小细胞肺癌尤显重要。由于目前发现的与小细胞肺癌发生、发展密切相关的基因较为罕见,寻找新的小细胞肺癌差异表达基因,并确定其在小细胞肺癌中的作用,对于小细胞肺癌的诊断、预防和治疗均具有重要意义。ABCE1基因属ATP结合盒转运子基因亚家族,其蛋白位于细胞质,分布于人体多处组织,能够阻断干扰素介导的2-5A/核糖核酸酶L细胞抗病毒通路,抑制细胞凋亡过程,并可能在促进蛋白质合成及细胞增殖分化方面发挥作用〔2〕。为进一步观察ABCE1基因对小细胞肺癌细胞株的侵袭及迁移能力的影响,笔者在构建ABCE1基因SiRNA表达载体的基础上,将上述载体转染小细胞肺癌细胞株,观察ABCE1基因对小细胞肺癌增殖、侵袭、迁移能力的影响。
1 材料与方法
1.1 材料 人小细胞肺癌细胞株NCI-H446由中国科学院细胞库引进。新生小牛血清购于杭州四季青公司,RPMI 1640培养基和lipofect2000购于美国Invitrogen公司。RNAi-Ready pSIREN-DNR购自 TaKaRa公司。为穿梭载体,大小6.7 kb,于832~1 509 bp位置携带有红色荧光蛋白报告基因,其两端分别带有BamH I和 EcoR I酶切位点。菌株JM109、DH5α均购于大连宝生物公司。引物设计、合成以及测序由大连宝生物公司完成。ABCE1-SiRNA-1,ABCE1-SiRNA-2为 RNA干扰序列,ABCE1-SiRNA-N为无意义干扰序列。
1.2 SiRNA载体构建 将合成的ABCE1基因的SiRNA引物退火并将退火产物与RNAi-Ready pSIREN-DNR载体4℃过夜充分连接。热转化至DH5α中,分别命名为ABCE1-SiRNA-1、ABCE1-SiRNA-2、ABCE1-SiRNA-N,涂布平板后,37℃过夜培养。从转化平板上挑取阳性单菌落,进行扩增,检测阳性克隆,并测序。
1.3 细胞转染 转染前1 d,NCI-H446细胞用胰酶消化,接种于6孔板,加入含10%胎牛血清的RPMI-1640培养基,当细胞达到60%~70%融合时,准备转染。转染当天更换为无胎牛血清的RPMI-1640培养基,每个培养孔1 000 μl。取lipofect2000 10 μl,按照转染试剂:DNA(μg)为 10∶2的比例加入构建成功的载体DNA,混匀后室温孵育30 min,加入到6孔板中培养,6 h后加入100 μl胎牛血清。转染48 h后,荧光显微镜下观察转染情况。转染成功后检测各项指标。
1.4 Western印迹鉴定沉默效果 收取部分细胞,加入预冷裂解缓冲液,剪碎,超声匀浆,低温超速离心。吸取上清液,Lowry法测定蛋白浓度,SDS-PAGE凝胶90 V电泳3 h后转印。洗膜后1%BSA封闭非特异性抗原2 h。缓冲液洗膜,与一抗(1∶250)4℃孵育过夜。洗膜后与碱性磷酸酶标记二抗(1∶200)室温下孵育2 h。NBT/BCIP显色,以NC膜上出现清晰的棕褐色条带为阳性,终止显色,漂洗并干燥后避光保存。
1.5 细胞增殖能力的检测(MTT法)用0.25%的胰蛋白酶消化转染后24 h的4组细胞(未转染组、ABCE1-SiRNA-1组、ABCE1-SiRNA-2组及ABCE1-SiRNA-N组),以含有10%胎牛血清的1640培养液配置成单细胞悬液。以每孔2×103个细胞接种于96孔板中,每孔体积0.2 ml,每组细胞接种6个孔,并以培养液为空白对照,以接种后24、48、72、96 h为4个观察时间点,共铺4块板。置37℃,5%CO2孵箱中培养。24 h后取出其中一块板,每孔加入 5 mg/ml的 MTT 20 μl,37℃,5%CO2条件下继续培养4 h。弃上清后每孔加入150 μl DMSO,并震荡10 min使MTT充分溶解。用490 nm波长的酶标仪,测定各孔的吸光度值(OD值)。
1.6 转染后细胞侵袭能力的检测 将转染后24 h 4组细胞进行如下操作:水化后的Transwell小室放入24孔培养板中,在小室外加含15%胎牛血清1640培养液500 μl,在小室内加入200 μl肿瘤细胞悬液,细胞数为5×103,培养液为含2%胎牛血清1640培养液,每组重复6个样本。常规培养24 h,取出Transwell小室,PBS淋洗,用棉签小心擦去微孔膜上层细胞,Hoechst 33258溶液染色。在荧光显微镜下计数移至微孔膜下层的细胞数,每个样本计数10个视野。
1.7 转染后细胞迁移能力的检测 将各组细胞分别接种在24孔培养板中,每组6孔,每孔细胞数为5×104,常规培养至形成细胞单层。在单层培养细胞上,用直径1 mm的不锈钢探针消毒后在底部划“一”字形横线,用PBS仔细冲去细胞碎片,继续培养。镜下观察0、24、48、72 h的细胞运动情况。记录从迁移起点至迁移最远端细胞核之间的距离,每视野取5个不同的位置,用迁移距离反映迁移速度。
2 结果
2.1 SiRNA载体的构建及连接 ABCE1-SiRNA-1、ABCE1-SiRNA-2、ABCE1-SiRNA-N涂布平板后,37℃过夜培养。从转化平板上挑取单菌落,检测阳性克隆并电泳,可见构建的质粒约7 kb大小(图1),选取阳性克隆的PCR产物进行测序,测序结果与设计的序列一致。

图1 构建后SiRNA质粒电泳
2.2 转染结果判定 因构建的SiRNA含有DSRed荧光物质,转染 ABCE1-SiRNA-1、ABCE1-SiRNA-2、ABCE1-SiRNA-N 后,荧光显微镜观察细胞胞浆内可见红色的荧光(图2),未转染组无荧光表达,表明成功将质粒转入NCI-H446细胞。转染质粒后NCI-H446细胞略肿胀,部分细胞变圆,死亡;而转染ABCE1-SiRNA-1、ABCE1-SiRNA-2后细胞的增殖明显减慢。
2.3 ABCE1-SiRNA对ABCE1蛋白表达的影响 Western印迹检测ABCE1蛋白表达水平,可见68 KD处一条特异条带。凝胶成像系统灰度扫描 ABCE1现色条带,转染ABCE1-SiRNA-1和ABCE1-SiRNA-2组与转染ABCE1-SiRNA-N和空白对照组相比,ABCE1蛋白表达量明显下降(图3)。表明ABCE1-SiRNA-1和ABCE1-SiRNA-2成功转染入小细胞肺癌细胞,转染ABCE1-SiRNA-1或ABCE1-SiRNA-2能够抑制小细胞肺癌细胞ABCE1基因表达。

图2 转染SiRNA的NCI-H446细胞(×100)

图3 不同组Western印迹结果
2.4 转染前后细胞增殖能力的改变 转染质粒后各组NCIH446细胞略肿胀,转染ABCE1-SiRNA-N的细胞增殖改变不明显,仍然需要2~3 d换液1次。而转染 ABCE1-SiRNA-1或ABCE1-SiRNA-2后细胞的增殖明显减慢,需要5~6 d换液1次。根据OD值,描记各组细胞生长曲线(图4),可见转染ABCE1-SiRNA-1或ABCE1-SiRNA-2后细胞的生长明显滞后于转染ABCE1-SiRNA-N的细胞。在铺板的第3天转染ABCE1-SiRNA-1的NCI-H446细胞数分别是未转染组和转染ABCE1-SiRNA-N的65%和63%,转染ABCE1-SiRNA-2的NCI-H446细胞数分别是未转染组和转染ABCE1-SiRNA-N的64%和62%(P<0.05)。在铺板的第4天转染ABCE1-SiRNA-1的 NCIH446细胞数分别是未转染组和转染ABCE1-SiRNA-N的68%和70%,转染ABCE1-SiRNA-2的NCI-H446细胞数分别是未转染组和转染ABCE1-SiRNA-N的71%和73%(P<0.05)。
2.5 转染后细胞侵袭能力的检测 未转染组和转染ABCE1-SiRNA-N的NCI-H446细胞穿膜能力较强,穿膜细胞数较多〔分别为(41±5),(40±4)〕,而转染 ABCE1-SiRNA-1和 ABCE1-SiRNA-2的NCI-H446细胞穿膜能力较弱,穿膜细胞数较少〔分别为(18±4),(21±5)〕(均P<0.05)。表明转染 ABCE1-SiRNA后可抑制NCI-H446细胞的体外侵袭潜能。
2.6 转染后细胞迁移能力的检测 见表1。转染ABCE1-SiR-NA-1和ABCE1-SiRNA-2组,培养24 h后,划痕无明显缩小趋势。转染ABCE1-SiRNA-1和ABCE1-SiRNA-2组,培养48 h后,划痕略缩小,但无融合趋势。空白对照和转染ABCE1-SiRNA-N组培养48 h后,划痕明显开始缩小。转染ABCE1-SiRNA-1和ABCE1-SiRNA-2组,培养72 h后,划痕缩小;空白对照和转染ABCE1-SiRNA-N组培养72 h后划痕缩小更加明显且有融合之趋势。结果表明,转染ABCE1-SiRNA后NCI-H446细胞的迁移能力明显下降。
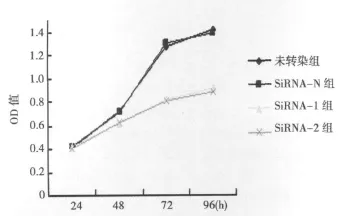
图4 不同组生长曲线图
表1 各组NCI-H446细胞不同时刻划痕的宽度(mm,n=5,s)
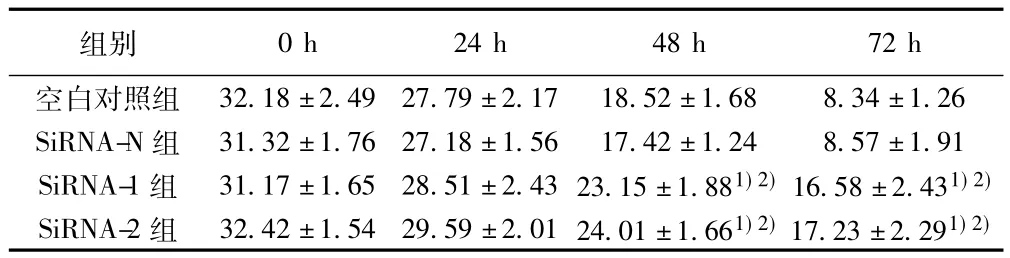
表1 各组NCI-H446细胞不同时刻划痕的宽度(mm,n=5,s)
与空白对照组比较:1)P<0.05;与SiRNA-N组比较:2)P<0.05
0 h 24 h 48 h 72 h空白对照组组别32.18±2.49 27.79±2.17 18.52±1.68 8.34±1.26 SiRNA-N组 31.32±1.76 27.18±1.56 17.42±1.24 8.57±1.91 SiRNA-1组 31.17±1.65 28.51±2.43 23.15±1.881)2)16.58±2.431)2)SiRNA-2组 32.42±1.54 29.59±2.01 24.01±1.661)2)17.23±2.291)2)
3 讨论
小细胞肺癌是一种恶性度极高的肿瘤,早期易发生淋巴和血行转移。研究表明在小细胞肺癌的发生过程中涉及了众多基因的改变〔3〕。染色体的改变,如 3p、4q、5q、10q、13q 和 17p等染色体的杂合性缺失也常见于小细胞肺癌患者〔4〕。Eun等〔5〕在4q上发现了原发小细胞肺癌的抑制基因,所有这些缺失部位都可能含有与小细胞肺癌发生、转移相关的基因。ABCE1基因位于常染色体4q31上,其全长cDNA序列编码599个氨基酸,编码的蛋白为67 314 Da。该基因在人体各组织器官普遍表达〔6〕,但表达的形式及水平有所不同,并具有组织特异性。其在脑组织、肾脏及前列腺呈高表达,在肺、肝脏、脾、心脏、胰腺、骨骼肌呈微量表达,而在脊髓和骨不表达。ABCE1基因能特异性地与RNase L结合并抑制其活性,研究显示ABCE1编码的RNase L基因的突变与人前列腺癌的发生、发展密切相关,RNase L的缺失也可能会引发前列腺癌〔7〕。Chen等〔8〕研究表明应用ABCE1基因的SiRNA转染HEK293细胞后,细胞的增殖能力明显下降,提示ABCE1基因与该细胞的增殖有关。ABCE1抑制的RNase L具有防止病毒扩散,诱导细胞凋亡,阻止细胞增生失控的作用。细胞凋亡的抑制是恶性肿瘤发生与转移的关键环节〔9〕,进而可以推测ABCE1基因与恶性肿瘤的发生及转移密切相关。
RNAi-Ready pSIREN-DNR于832~1 509 bp位置携带表达红色荧光的蛋白(DsRed)报告基因,在557~579 nm可激发出红色荧光,因此转染该载体的细胞可发出红色荧光。通过荧光显微镜或流式细胞仪可直接观察沉默基因的转染效率及表达等。本研究应用MTT法研究了ABCE1-SiRNA对转染的小细胞肺癌NCI-H446细胞株增殖能力的影响,发现转染ABCE1-SiRNA-1和ABCE1-SiRNA-2均可抑制小细胞肺癌细胞株NCIH446的增殖。同时证实ABCE1-SiRNA转染小细胞肺癌细胞株NCI-H446可抑制其内ABCE1的表达,降低其增殖和迁移能力。
肿瘤的侵袭和转移是许多恶性肿瘤治疗失败和患者死亡的主要原因。癌细胞侵袭是指癌细胞离开其原发灶而侵犯了邻近组织,并在该处继续生长繁殖的过程。肿瘤细胞侵袭破坏细胞外基质并迁移进入脉管系统是转移发生过程中的重要环节,肿瘤细胞的侵袭、迁移能力可反映其恶性程度〔10,11〕。划痕实验是测定细胞迁移能力的一种经典研究方法。Transwell小室体外侵袭实验是一种测定细胞侵袭能力的方法〔12〕。Transwell小室底部是布满8 μm直径小孔的PET膜,可供单个细胞迁移通过。侵袭实验则在PET膜上面铺了一层Matrigel,模仿细胞外基质,只有具有侵袭能力的细胞才能通过,细胞消化了基质才能从低营养的培养液进入高营养的培养液里,最后检测穿过基质胶的细胞数量就可以了解细胞的侵袭能力。本研究证实ABCE1-SiRNA转染小细胞肺癌NCI-H446细胞株后,NCIH446的侵袭及迁移能力均有所下降,因此ABCE1-SiRNA有望为治疗小细胞肺癌提供新的依据。
1 Lally BE,Urbanic JJ,Blackstock AW,et al.Small cell lung cancer:have we made any progress over the last 25 years〔J〕?Oncologist,2007;12:1096-104.
2 Thakur B,Kant J,Beihua D,et al.Small-molecule activators of RNase L with broad-spectrum antiviral activity〔J〕.Chandar S Biochemistry,2007;104:9585-90.
3 Baines AT,Lim KH,Shields JM,et al.Use of retrovirus expression of interfering RNA to determine the contribution of activated K-Ras and ras effector expression to human tumor cell growth〔J〕.MethodsEnzymol,2006;407:556-74.
4 ullmann R,Petzmann S,Sharma A,et al.Chromosomal aberrations in a series of large-cell neuroendocrine carcinomas:unexpected divergence from small-cell carcinoma of the lung〔J〕.Hum Pathol,2001;32:1059-63.
5 Eun SC,Joon C,Kyung YC,et al.Identification of tumor suppressor loci on the long arm of chromosome 4 in primary small cell lung cancers〔J〕.Yonsei Med J,2002;2:145-51.
6 Langmann T,Mauerer R,Zahn A,et al.Real-time reverse transcription-PCR expression profiling of the complete human ATP-binding cassette transporter superfamily in various tissues〔J〕.Clin Chem,2003;49:230-8.
7 Silverman RH.Implications for RNase L in prostate cancer biology〔J〕.Biochemistry,2003;42:1805-12.
8 Chen ZQ,Dong JSh,Akihiko I,et al.The essential vertebrate ABCE1 pro-tein interacts with eukaryotic initiation factors〔J〕.J Biol Chem,2006;281:7452-7.
9 Lin Y,Kokontis J,Tang F,et al.Androgen and its receptor promote Baxmediated apoptosis〔J〕.Mol Cell Biol,2006;26:1908-16.
10 Liotta LA,Mandle R,Murano G,et al.Tumor cell auticrine motility factor gene expression〔J〕.Proc Natl Acad Sci USA,1986;83(14):3302-6.
11 Liotta LA.Tumor invasion and metastases:role of the basement membrane〔J〕.Am J Pathol,2009;117:339-48.
12 Albini A,Melchiori A,Santi L,et al.Tumor cell invasion inhibited by TIMP2〔J〕.J Natl Cancer Inst,2001;83:775-8.
