rhG-CSF对缺氧SH-SY5Y细胞及大鼠缺血脑组织中LAMP-2a和HSC-70蛋白表达的影响*
2013-11-20王雪晶马耀华邓文静滕军放
田 婧,王雪晶,马耀华,荆 婧,邓文静,苏 楠,滕军放
郑州大学第一附属医院神经内科 郑州 450052
重组人粒细胞集落刺激因子(recombinant human granulocyte colony stimulating factor,rhG-CSF)是一种造血营养因子。近些年研究[1]发现rhG-CSF在脑缺血中发挥保护作用。自噬是细胞膜结构发生动态的形态学改变,并通过溶酶体介导蛋白质和细胞器降解的过程,分为巨自噬、微自噬、分子伴侣介导自噬(chaperone-mediated autophagy, CMA)。CMA是组成型热休克蛋白70(heat shock cognate protein 70, HSC-70)作为分子伴侣参与的细胞自我吞噬,对于机体保持内环境稳定具有重要意义[2]。已有研究[3-4]显示rhG-CSF可调控CMA。2006年Takemura等[3]发现rhG-CSF的心脏保护作用是通过对抗自噬性细胞凋亡实现的。2012年Jacquel等[4]发现CMA参与rhG-CSF介导的单核细胞向巨噬细胞的转化。作者观察了rhG-CSF对缺氧人神经母细胞瘤SH-SY5Y细胞及缺血缺氧大鼠脑缺血周边区组织CMA标志性蛋白LAMP-2a及HSC-70表达的影响,探讨rhG-CSF抑制缺血缺氧后神经元损伤的机制,为rhG-CSF治疗脑卒中提供更多依据。
1 材料与方法
1.1细胞实验
1.1.1 缺氧细胞模型的制备及处理 SH-SY5Y细胞由中南大学唐北沙教授馈赠。将SH-SY5Y细胞置于37 ℃、体积分数5% CO2、饱和湿度培养箱培养。取对数生长期细胞,换用预先以无氧混合气体(VN2:VCO2=955)填充30 min的无糖DMEM培养液,将细胞立即置于无氧混合气体填充的缺氧培养箱中,37 ℃、饱和湿度条件下培养6 h,制备成氧糖剥夺模型。然后将细胞接种在正常培养皿,分为3组,分别加入0、100、200 μg/L的rhG-CSF,继续培养48 h。
1.1.2 细胞HSC-70、LAMP-2a蛋白测定 经rhG-CSF孵育48 h后的细胞以裂解液裂解,4 ℃、3 000 r/min离心10 min,采用二辛可宁酸法行蛋白质定量检测,然后提取总蛋白 25 μg,采用SDS-PAGE电泳,转膜,用50 g/L脱脂奶粉封闭1 h,TBST洗3次,加入一抗(抗人HSC-70抗体按1500稀释、LAMP-2a抗体按1800稀释、GAPDH抗体按15 000稀释),4 ℃过夜。次日加入过氧化物酶标记的山羊抗兔IgG,置于水平脱色摇床上孵育2 h,ECL光化学法显色,暗室中行X线胶片曝光。使用凝胶分析系统分析,测定各条带的光密度值,以目的条带与内参GAPDH光密度值的比值作为目的蛋白的相对表达量。
1.2动物实验
1.2.1 实验动物分组 SD大鼠54只,体质量280~320 g,由郑州大学实验动物中心提供。随机分为3组,每组18只。假手术组仅进行颈部手术,不栓塞大脑中动脉,实验组及模型组均制备大脑中动脉栓塞模型[5]。术后2 h实验组给予rhG-CSF(50 μg·kg-1·d-1)注射5 d,模型组和假手术组给予等量生理盐水。各组大鼠使用300 mg/kg水合氯醛腹腔注射麻醉,开胸,经心尖至升主动脉入路,依次用生理盐水和40 g/L甲醛溶液各200 mL灌注,然后断头完整取脑。
1.2.2 大鼠脑缺血周边区组织HSC-70、LAMP-2a蛋白测定 取0.1 g脑缺血周边区组织,PBS漂洗3次,加入裂解液后匀浆,然后转入EP管中超声,离心后收集上清。用考马斯亮蓝法测量蛋白浓度,采用Western blot法检测HSC-70和LAMP-2a,操作同1.1.2。
1.2.3 大鼠脑缺血周边区组织MAP-2蛋白检测 取脑缺血周边区组织,切片脱水、石蜡包埋、切片。切片脱蜡至水后,体积分数3%过氧化氢消除内源性过氧化物酶活性,50 g/L小牛血清封闭,室温孵育30 min,滴加1200稀释的MAP-2多克隆抗体,4 ℃孵育过夜,PBS漂洗,滴加HRP标记的二抗,PBS漂洗后,DAB显色,常规脱水透明,树脂封片,显微镜下观察。
1.2.4 大鼠神经功能评价 模型建立后在动物苏醒后即刻及术后第7天,由不了解动物分组的人员参照改良神经功能缺损评分方法对3组大鼠进行神经功能评价,总分18分,分值越高,损伤越严重。
1.3统计学处理采用SPSS 17.0处理数据。采用单因素方差分析比较3组细胞HSC-70、LAMP-2a蛋白的表达及3组大鼠HSC-70、LAMP-2a蛋白的表达,采用LSD-t检验行组间两两比较;采用两独立样本的t检验比较模型组和实验组两个时间点神经功能缺损评分的差值。检验水准α=0.05。
2 结果
2.1 3组细胞HSC-70、LAMP-2a蛋白的表达结果见图1、表1。

图1 不同质量浓度rhG-CSF对细胞HSC-70、LAMP-2a蛋白表达水平的影响
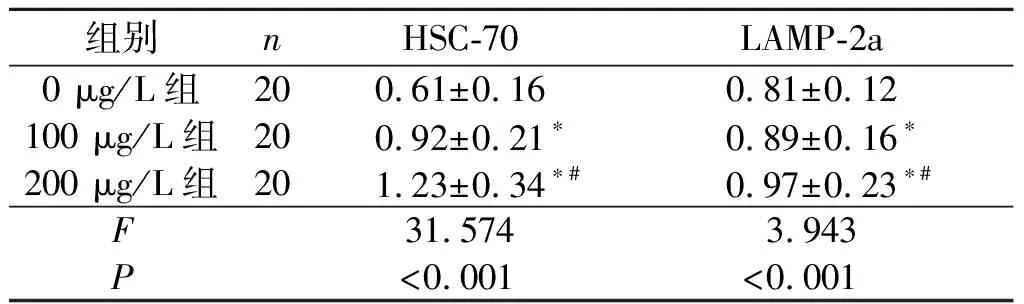
表1 不同质量浓度rhG-CSF对细胞HSC-70、LAMP-2a蛋白表达水平的影响
*:与0 μg/L组比较,P<0.05;#:与100 μg/L组比较,P<0.05。
2.2 3组大鼠脑缺血周边区组织HSC-70、LAMP-2a蛋白的表达结果见图2、表2。
2.3 3组大鼠脑缺血周边区组织MAP-2蛋白的表达与模型组相比,实验组可见密集、粗大、呈丛状的MAP-2免疫反应阳性的树突,见图3。

图2 大鼠脑缺血周边区组织HSC-70、LAMP-2a 蛋白的表达

表2 3组大鼠脑组织中HSC-70、LAMP-2a 蛋白的表达水平
*:与假手术组比较,P<0.05;#:与模型组比较,P<0.05。

图3 MAP-2免疫组化染色结果(SP,×400)
2.4 3组大鼠神经功能评价假手术组术后苏醒时及术后第7天神经功能正常,神经功能缺损评分为0。模型组与实验组两个时间点神经功能缺损评分比较见表3。

表3 模型组与实验组两个时间点神经功能缺损评分
*:t=6.322,P<0.001。
3 讨论
以往研究发现,rhG-CSF可以动员骨髓干细胞向脑梗死部位迁移,并向神经细胞分化,替代受损伤的神经细胞,同时通过促进病变脑组织的血管生成,改善局部血流量,促进神经营养因子分泌及抑制炎性反应,从而发挥脑保护作用[6]。作者观察rhG-CSF对缺氧SH-SY5Y细胞及缺血缺氧大鼠脑缺血周边区组织CMA标志性蛋白LAMP-2a及HSC-70表达的影响,探讨rhG-CSF抑制缺血缺氧后神经元损伤的机制。
HSC-70为热休克蛋白70家族成员之一。LAMP-2a为表达在溶酶体膜上的单次跨膜蛋白。CMA的过程是当细胞受到氧化性损伤时,细胞内蛋白暴露出KFERQ序列,被作为分子伴侣的HSC-70识别结合,形成分子伴侣-底物复合物,然后引导该复合物到达溶酶体并与溶酶体膜上的LAMP-2a结合,将损伤的蛋白质等运输到溶酶体内降解[7-8]。
该研究证实,在细胞及动物模型水平rhG-CSF均可上调HSC-70与LAMP-2a的表达,说明rhG-CSF提高了缺氧细胞及缺血缺氧后大鼠脑组织CMA的水平,但rhG-CSF上调CMA的机制尚不明确。在巨自噬的研究[9]中已证实在脑出血中,NF-κb特异性抑制剂SN50通过抑制NF-κb信号通路在一定程度上促进了脑出血后巨自噬相关蛋白的表达上调。rhG-CSF可抑制NF-κb,那么rhG-CSF是否通过抑制NF-κb而上调CMA的活性有待进一步研究。
该研究的动物实验部分在证实rhG-CSF上调缺血缺氧后脑组织CMA活性的同时,还发现使用rhG-CSF后神经元内MAP-2表达增加,神经功能得到改善。MAP-2为存在于树突中的神经元标志性骨架蛋白,可反映神经元代偿修复及神经干细胞定向分化为神经元的状况。因此rhG-CSF可能通过上调CMA在脑缺血中发挥神经保护作用。原因考虑如下:首先,CMA上调可选择性地清除由某些病毒、病原体及错误折叠而形成的凝聚蛋白或受损的细胞器,有利于神经功能恢复及内环境的稳定[10]。其次,上调自噬可促进细胞分化。在低等生物中,自噬可参与酵母孢子的形成和分化[11]。在血液系统中,自噬可参与单核细胞向巨噬细胞的转化[12]。在神经系统中,自噬上调可促进神经干细胞分化为神经细胞,所以自噬的上调可以促进神经功能恢复[9]。rhG-CSF动员到达脑缺血区的骨髓间充质干细胞分化为神经细胞,可能与其上调CMA促进细胞分化有关。总之,CMA的上调可能从多个途径发挥神经保护功能。
综上所述,该研究通过动物及细胞实验证实在缺血缺氧损伤中,rhG-CSF能上调CMA。脑缺血中rhG-CSF可能通过上调CMA发挥神经元保护作用,这为rhG-CSF的临床应用提供了更多的理论依据。
[1] 史建军,付宏亮.粒细胞集落刺激因子对大鼠急性缺血性脑梗死的神经保护作用[J].中国药物与临床,2009,9(5):372
[2] Kon M,Cuervo AM.Chaperone-mediated autophagy in health and disease[J]. FEBS Lett,2010, 584(1): 1399
[3] Takemura G,Miyata S,Kawase Y,et al.Autophagic degeneration and death of cardiomyocytes in heart failure[J].Autophagy, 2006,2(3):212
[4] Jacquel A,Obba S,Boyer L,et al. Autophagy is required for CSF-1-induced macrophagic differentiation and acquisition of phagocytic functions[J].Blood, 2012, 119(19):4527
[5] 汪飞,储照虎.线栓法大鼠大脑中动脉闭塞模型的制备[J].基层医学论坛,2011,15(1):14
[6] 程鹤云,滕军放,郭利利.重组人粒细胞集落刺激因子对急性缺血再灌注脑损伤大鼠脑组织Egr-1、Survivin 蛋白表达及血管再生的影响[J].郑州大学学报:医学版,2013, 48(2):200
[7] 陶伍元,张文武.HSP70与脓毒症[J]. 中国实用内科杂志,2010,30(增刊 1):88
[8] Massey AC,Kaushik S, Sovak G,et al. Consequences of the selective blockage of chaperone-mediated autophagy[J]. Proc Natl Acad Sci USA,2006,103(15):5905
[9] 孙玉霞,包海军,刘伟丽,等.小鼠脑出血后自噬相关蛋白表达及NF-κb信号通路对其调节作用的研究[J].苏州大学学报:医学版,2011, 31(1):30
[10]Orenstein SJ,Cuervo AM.Chaperone-mediated autophagy:molecular mechanisms and physiological relevance[J].Semin Cell Dev Biol,2010,21(7):719
[11]Juhasz G,Csikos G,Sinka R.The Drosophila homology of Aut1 is essential for autophagy and development[J]. FEBS Lett, 2003,543(13):154
[12]王卓.自噬调节全反式维甲酸诱导髓系白血病细胞分化的机制研究[D].长沙:中南大学,2011.
