6周递增负荷运动对大鼠小肠集合淋巴结细胞线粒体凋亡途径的影响
2013-11-19王雪芹郝选明
王雪芹,郝选明
(1.华南师范大学 体育科学学院,广东 广州 510006;2.临沂大学 体育学院,山东 临沂 276005)
小肠集合淋巴结(Peyer’s patches,PP结)是免疫应答的诱导和活化部位,其淋巴细胞最终离开 PP结归巢到肠黏膜固有层,进一步分化为成熟浆细胞并分泌IgA发挥免疫效应[1]。课题组前期的研究发现,递增负荷运动会导致PP结淋巴细胞凋亡增加[2]。而长期大强度运动诱导 PP结淋巴细胞凋亡及机制研究甚少,为了进一步证实递增负荷运动诱导 PP结淋巴细胞的凋亡及机制,本研究着重探讨递增负荷运动过程中,PP结淋巴细胞线粒体膜电位的变化、细胞凋亡关键分子细胞色素C(Cytochrome C,简称Cyt C)的变化及与线粒体凋亡通路密切相关的促凋亡基因 BaxmRNA和抗凋亡基因 Bcl-2mRNA的表达情况,递增负荷运动过程中 PP结淋巴细胞的线粒体凋亡机制,为长期大强度运动诱导免疫细胞凋亡及机制研究提供依据。
1 研究对象与方法
1.1 研究对象与分组
SPF级雄性SD大鼠(8周龄,64只,购自广东中医药大学实验动物中心,许可证号:SCXK (粤)2008-0020;NO:0104976,粤监证字 F2008A002)被随机分为实验组和对照组,各为32只。实验组进行6周递增强度训练,对照组,正常喂养,不进行运动干预,于第0、2、4、6周末各从实验组和对照组取8只大鼠脏器并测试相关指标(最后一次运动后48 h无菌采样)。
1.2 运动方案
采用本课题组反复实验探索的 6周递增负荷模型。先采用低强度适应性运动(10 m/min)训练1周后,负荷递增至 20 m/min。随后每周递增负荷增量 5 m/min。至第6周,达到40 m/min。
1.3 测试指标与方法
1)线粒体膜电位测定:JC-1膜电位检测试剂盒(JC-1)购于碧云天生物技术研究所(C2006),采用FACS Calibur流式细胞仪进行检测。无菌条件下,从小肠壁上切取PP结,取200目钢网极轻柔研磨细胞,400目尼龙网过滤。收集的细胞用冷PBS离心(200 g,5 min)洗涤2次,悬浮于含100 mL/L胎牛血清RPMI-1640完全培养基中,计数并且调整细胞浓度,取5×105细胞,重悬于0.5 mL细胞培养液中,加入0. 5 mL JC-1染色工作液,颠倒数次混匀。在37 ℃、体积分数5%CO2细胞培养箱中孵育20 min。孵育结束后,离心3 min(600 g ,4 ℃),沉淀细胞。弃上清,用JC-1 染色缓冲液洗涤2次后,再用1 mL的JC-1染色缓冲液重悬,并立即进行流式细胞仪检测。数据采用 WinMDI 2.9软件进行分析处理,计数红色荧光强度平均值和绿色荧光强用红色荧光强度与绿色荧光强度的比值代表线粒体膜电位去极化程度。
2)Bax、Bcl-2mRNA的测定:RNAiso Plus和SYBR®Premix Ex TaqTM反应试剂购自(TaKaRa)大连宝生物公司;引物(见表1)委托上海Invitrogen公司合成;采用全自动荧光定量PCR仪进行测定。

表1 Bax基因、Bcl-2基因和GAPDH管家基因引物序列
3)细胞色素C的测定:采用ELISA检测,Cyt C浓度测定严格按照检测试剂盒(R&D systems)说明书要求进行。在酶标仪(Tecan Infinite F200)上,于450 nm波长读取光密度值,根据标准曲线计算出Cyt C的浓度。
1.4 数据的统计学处理
所有数据用平均数±标准差(x±s)表示,用SPSS Statistics 17.0统计软件进行统计处理;组间比较采用单因素方差(one-way ANOVA)进行分析。P<0.05为差异有显著性统计学意义,P<0.01为差异有非常显著性统计学意义。
2 结果及分析
2.1 对照组测试指标的变化
第0、2、4、6周,对照组的PP结线粒体膜电位、PP结淋巴细胞Bax、Bcl-2mRNA和Cyt-C浓度差异没有显著性(P<0.05),表明6周生长对这些指标没有影响。
2.2 长期递增负荷运动对PP结线粒体膜电位的影响
线粒体对JC-1的摄取依赖于跨膜电位,正常PP结淋巴细胞线粒体的膜电位高,细胞受损后,线粒体膜电位下降。在JC-1染色中,受到ΔΨm和制约,因此,很多研究数值来反映ΔΨm[4]。本研究结果显示,6周递增负荷运动中,4周显高于0周,差异具有显著性(P<0.05)。0周到4周PP结淋巴细胞ΔΨm持续下降,6周PP结淋巴细胞ΔΨm略有上升。2、6周PP结淋巴细胞ΔΨm与0周相比,差异具有显著性(P<0.05);4周PP结淋巴细胞ΔΨm与0周相比,差异具有非常显著性(P<0.01)(见表2)。
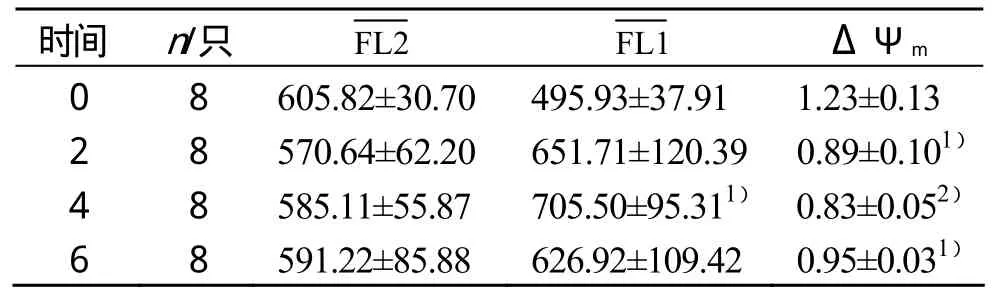
表2 长期递增负荷运动过程中PP结ΔΨm的变化
2.3 长期递增负荷运动对 PP结淋巴细胞 Bax和Bcl-2mRNA的影响
结果显示,6周递增负荷运动中,与0周相比,2、4、6周BaxmRNA表达升高,其中4和6周的BaxmRNA表达明显高于0周,差异具有显著性(P<0.05);与0周相比,4、6周Bcl-2mRNA表达降低,其中4和6周Bcl-2mRNA表达明显低于 0周,差异具有非常显著性(P<0.01);4周与2周相比,Bcl-2mRNA表达明显降低,差异具有显著性(P<0.05);与0周相比,2、4、6周Bcl-2/Bax明显降低,差异具有非常显著性(P<0.01)(见表3)。
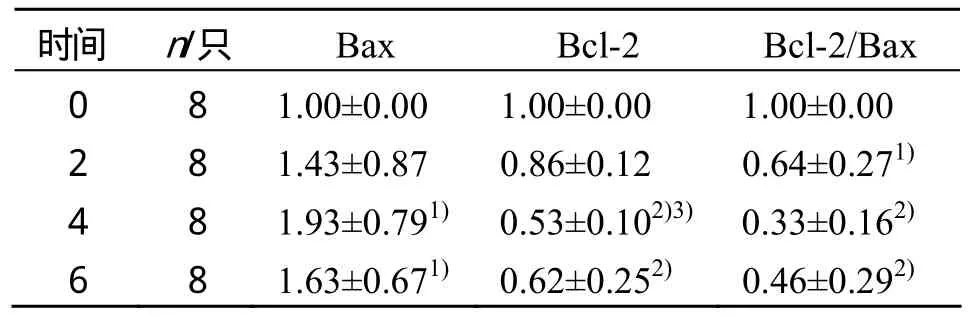
表3 长期递增负荷运动过程中PP结淋巴细胞Bax和Bcl-2mRNA的变化
2.4 长期递增负荷运动对PP结淋巴细胞Cyt C质量浓度的影响
结果显示,递增负荷运动过程中,2、4、6周PP结淋巴细胞Cyt C浓度分别为(3.859±0.241)、(8.456±0.289)、(8.143±0.286) ng/mL,明显高于与0周的(1.675±0.205) ng/mL,差异具有非常显著性(P<0.01);4和6周PP结淋巴细胞Cyt C浓度明显高于2周的,差异具有非常显著性(P<0.01)。
3 讨论
3.1 递增负荷运动过程中线粒体膜电位与PP结淋巴细胞凋亡及机制
本研究探讨了6周递增负荷运动过程中PP结淋巴细胞ΔΨm的变化。结果显示,在递增负荷运动过程中,2、4、6周的ΔΨm明显低于0周,且4周的降低最明显,提示在6周递增负荷运动降低了PP结淋巴细胞的ΔΨm,导致了淋巴细胞凋亡的增加。
运动对大鼠淋巴结淋巴细胞凋亡及凋亡机制的研究报道非常少。ΔΨm的降低与细胞凋亡密切相关。其可能机制为:线粒体不但是细胞的动力工厂,而且是细胞凋亡信号的提供者。ΔΨm是观察线粒体通透性,评价线粒体功能的敏感指标[8]。ΔΨm的降低表明线粒体内膜的通透性增加,细胞受损[4]。线粒体功能改变与细胞凋亡密切相关,包括线粒体膜电位的丧失、胞浆内钙失衡、活性氧(ROS)过度生成、细胞色素C的释放及细胞Bcl-2家族促进和抑制凋亡蛋白的参与[9]。当凋亡信号传递至线粒体,同时激活第2信使如Ca2+、Bcl-2(Bax)、神经酰胺和活性氧等,第2信使也作用于线粒体,使线粒体释放出 Cyt-c,Cyt-c与凋亡蛋白酶激活因子1(Apaf-1)和 Caspases-9形成复合体,导致 Caspases-9的激活,激活 Caspases-9继续激活下游效应因子Caspases-3、6、7,使细胞进入凋亡[10-11]。课题组前期研究发现,6周递增负荷运动期间,肠道淋巴细胞凋亡程度与组织自由基含量变化基本一致,运动应激性自由基生成与肠道淋巴结细胞凋亡有关[2]。与本研究相结合,说明递增负荷运动会导致自由基过度生成,线粒体氧化酶活性下降,进而引发内膜脂质过氧化,使内膜的流动性下降和膜通透性增加,滑扣、质子漏和电子漏增加,导致线粒体膜电位降低甚至丧失,促使了PP结淋巴细胞凋亡的发生。Krüger等[12]以C57BL/6为研究对象,进行一次力竭性递增负荷运动,发现PP结淋巴细胞凋亡在运动后3、24 h明显增加;MDA水平升高,ROS增加;Fas+和FasL+也明显增加。另外,以Fas缺陷MRL/lpr小鼠为研究对象,发现运动诱导下,脾脏、肺、骨髓和淋巴结处淋巴细胞凋亡被阻止,而PP结淋巴细胞仍有凋亡出现,说明介导PP结淋巴细胞凋亡的可能是其他凋亡途径,如运动诱导血清糖皮质激素浓度提高、自由基生成过度等。另外,Bax和Bcl-2的变化趋势与上述ΔΨm的变化趋势是一致的,且在一定诱导条件先,会促使 Bax寡聚体形成并整合到线粒体外膜上,使线粒体发生一系列变化,说明在递增负荷运动中,Bax和Bcl-2也可能参与了PP结淋巴细胞凋亡的过程。
3.2 递增负荷运动过程中的 Bax、Bcl-2、Cyt C与PP结淋巴细胞凋亡及机制
Bcl-2家族是目前最受关注的调控细胞凋亡的基因家族,目前共发现30个成员。根据其结构和功能的不同,编码的蛋白包括抑制凋亡蛋白Bcl-2、Bcl-x、Bcl-XL等,促进凋亡蛋白包括Bax、Bcl-10、Bid等[5]。Bax蛋白与Bcl-2蛋白具有氨基酸顺序上的同源性,二者形成复杂二聚体,对抗Bcl-2抑制细胞凋亡的作用。Bcl-2/Bax比值决定着细胞受到刺激后是发生凋亡还是幸存。如果 Bcl-2/Bax比值降低,会促进线粒体释放细胞色素 C,激活下游因子,裂解底物,诱导细胞凋亡[6]。淋巴结淋巴细胞凋亡率达到峰值时,Bax蛋白表达也最强,而Bcl-2与Bcl-XL蛋白则明显下降,即Bax、Bcl-2与Bcl-XL在淋巴结淋巴细胞凋亡的调控中发挥着重要作用[7]。本研究结果显示,随着运动负荷的递增,从0周到4周,PP结淋巴细胞BaxmRNA表达持续增加,6周BaxmRNA表达比4周略有降低,但明显高于0周;第4和6周PP结淋巴细胞Bcl-2mRNA表达明显低于0周,4周的降低最显著;2、4和6周PP结淋巴细胞Bcl-2/Bax值也明显低于0周,尤其4周最低。即递增负荷运动过程中,尤其在0至4周,机体对负荷的反应较大,到6周反应略有减小,提示机体的运动机能可能提高了。与课题组前期研究结果是一致的[2]。另外,在递增负荷运动过程中,0至4周随着负荷的加大,Cyt C质量浓度明显增加。Cyt C具有激活caspase的作用,是线粒体参与凋亡的直接证据。
Bax、Bcl-2和Cyt C与PP结淋巴细胞凋亡的可能机制:正常情况下,Bax以单体形式存在于胞质,但随着递增负荷的进行,PP结淋巴细胞凋亡蛋白BaxmRNA表达增加,可能会导致Bax寡聚体形成并整合到线粒体外膜上,使线粒体外膜通透性增加,线粒体膜电位降低,使游离的Cyt-c释放至胞质,通过激活一系列下游基因发挥凋亡调节作用,使 PP结淋巴细胞凋亡增加。另外,前期研究发现,大强度运动会导致自由基过度生成,丙二醛(MDA)生成量增加,超氧化物歧化酶(SOD)的活性降低[2],也可能会导致淋巴细胞凋亡蛋白Bax表达的增加,进而引起线粒体膜电位的改变,Cyt-c释放增加,促进凋亡的发生。
递增负荷运动会导致小肠集合淋巴结淋巴细胞 Bax基因表达增加,Bcl-2基因表达降低,Bcl-2/Bax值降低,线粒体膜电位明显降低,Cyt-c释放增加,小肠集合淋巴结淋巴细胞凋亡增加。其凋亡的可能机制为:递增负荷运动导致自由基过度生成,超氧化物歧化酶活性降低,促使抗凋亡蛋白Bcl-2mRNA表达下降,凋亡蛋白BaxmRNA表达增加,其寡聚体形成并整合到线粒体上,引起线粒体外膜通透性改变,线粒体膜电位下降,使游离的Cyt-c释放至胞质增加,进入胞质的Cyt-c引起线粒体凋亡通路的下游基因发挥凋亡调节作用,使淋巴细胞凋亡增加。因此,递增负荷运动可能是通过线粒体通路介导小肠集合淋巴结淋巴细胞凋亡的。
[1] Wittig B M,Zeitz M. The gut as an organ of immunology [J]. Int J Colorectal Dis,2003,18(3):181-187.
[2] 覃飞,郝选明. 长期递增负荷运动对小肠集合淋巴结结构及淋巴细胞凋亡的影响[J]. 体育学刊,2012,19(1):134-138.
[3] 王雪芹. T 细胞活性与巨噬细胞吞噬能力对长期递增负荷运动的应答和适应特征[D]. 广州:华南师范大学,2005.
[4] Makani S,Gollapudi S,Yel L. Biochemical and molecular basis of thimerosal-induced apoptosis in T cells:a major role of mitochondrial pathway[J]. Genes Immun,2003,22(53):270-278.
[5] Youle R J,Strasser A. The BCL-2 protein family:opposing activities that mediate cell death[J]. Nat Rev Mol Cell Biol,2008,9(1):47-59.
[6] Verma Y K,Raghav P K,Raj H G,et al. Enhanced heterodimerization of Bax by Bcl-2 mutants improves irradiated cell survival[J]. Apoptosis,2012,15(12):780-788.
[7] 崔玉芳,丁彦青,徐菡. 致死剂量γ射线照射小鼠淋巴结淋巴细胞凋亡动力学及其与相关蛋白表达的关系[J]. 辐射研究与辐射工艺学报,2005,2(1):57- 61.
[8] Ly J D,Grubb D R,Lawen A. The mitochondrial membrane potential (deltapsi (m)) in apoptosis an update[J]. Apoptosis,2003,8(2):115-128.
[9] 王晓静.氧化应激相关的细胞凋亡过程中基因表达改变[J]. 国外医学:肿瘤学分册,2004,31(1):10-14.
[10] Fulda S,Meyer E,Friesen C,et al. Cell type specific involvement of death receptor and mitochondrial pathways in drug-induced apoptosis[J]. Oncogene,2001,20(9):1063-1075.
[11] Solá S,Morgado A L,Rodrigues C M. Death receptors and mitochondria:two prime triggers of neural apoptosis and differentiation[J]. Biochim Biophys Acta,2012,1830(1):2160-2166.
[12] Krüger K,Frost S,Most E,et al. Exercise affects tissue lymphocyte apoptosis via redox-sensitive and Fas-dependent signaling pathways[J]. Am J Physiol Regul Integr Comp Physiol,2009,296(5):1518-1527.
