运动提高糖尿病大鼠骨骼肌GLUT4基因表达的信号机制
2013-11-19张红学
张红学
(郑州大学 体育学院,河南 郑州 450044)
大量研究表明运动可以提高骨骼肌葡萄糖运载体4(glucose transporter 4,GLUT4)的表达[1-3],这对治疗以胰岛素抵抗为主要病因的糖尿病有重要作用[4-5],但机制尚不清楚。凝胶迁移(electrophoretic mobility shift assay,EMSA)实验,显示了GLUT4启动子区域存在肌细胞增强因子2(myocyte enhancer factor 2,MEF2)的结合位点[6]。Thai等[7]的研究进一步发现,糖尿病大鼠骨骼肌MEF2和GLUT4 结合活性及GLUT4mRNA表达量均显著低于正常大鼠,而用胰岛素刺激糖尿病大鼠骨骼肌细胞之后,发现 MEF2和 GLUT4 结合活性及GLUT4表达量均恢复到正常大鼠水平,提示了MEF2和GLUT4结合活性的变化是影响糖尿病大鼠GLUT4表达失常的重要环节[8]。虽然我们以往的研究结果也显示了运动通过提高骨骼肌MEF2和GLUT4结合活性而提高GLUT4基因表达[10],但此机制未在糖尿病患者中得到证实。Mukwevho[9]的研究发现利用细胞钙离子调节子 Caffeine 孵育激活 C2C12肌细胞钙/钙调素依赖性蛋白激酶 II(calcium-calmodulin depen-dent protein kinase II,CAMKII),可以引起肌细胞核内 MEF2和GLUT4结合活性显著增加,且这种增加伴随着GLUT4基因和蛋白的表达量的提高。运动能够激活CAMKII[11],提示了运动可能通过激活CaMKII而提高糖尿病大鼠MEF2和GLUT4结合活性和GLUT4表达的增加。值得注意的是,离体研究结果并不一定能真实反映在体的真实状况。因此本实验通过KN93(CaMKⅡ的特异性抑制剂)抑制运动对糖尿病大鼠骨骼肌CAMK II的激活作用,研究在体运动情况下CAMK II对糖尿病大鼠MEF2和GLUT4结合活性和GLUT4表达的调节作用。
1 材料和方法
1.1 实验动物
本实验以100只12~14周龄,健康清洁级SD大鼠为研究对象,河南省实验动物中心提供。试验期间,室内温度保持在 20~25 ℃,相对湿度保持在50%~70%,每天光照12 h。正常饲养的1周时间内所有大鼠自由进食(普通饲料)和饮水。
1.2 糖尿病大鼠模型的建立
SD大鼠适应性喂养1周后,随即选出40只作为正常对照,继续以普通饲料饲养。其余60只拟建立糖尿病大鼠模型。方法如下[12]:以高质饲料(碳水化合物和脂肪各占41%,蛋白质占18%,均为质量比)饲养4周,并禁食 12 h(晚上)后,腹腔下注射链脲佐菌素(streptozotocin,STE),注射质量分数为30 mg/kg(柠檬酸钠-柠檬酸盐缓冲液配置,pH=4.2),STE购于 Sigma公司。注射后继续给予高脂饲料,自由饮水。72 h后测定空腹血糖浓度(测血糖浓度之前禁食12 h),凡血糖浓度大于6.7 mmol/L者视为造模成功,成功共35只。
1.3 运动方案和取材
实验安排在第6周进行,实验前1 d进行1~2次适应性跑台练习,并于当天晚上 24:00禁食(耐力训练组不禁食)。实验当天根据体重正常对照大鼠和糖尿病组大鼠各自随机分为5组:安静对照(control,C)、一次性运动组、一次性运动+KN93组、耐力训练组、耐力训练+KN93组。正常对照大鼠每组8只,糖尿病大鼠每组7只。
安静对照组和一次性运动组大鼠,分别于取材前和运动前0.5 h腹腔注射生理盐水。一次性运动+KN93组大鼠运动前0.5 h腹腔注射KN93。注射质量分数为5 mg/kg,KN93购于Sigma公司。一次性运动组大鼠采用坡度为10°的跑台运动,跑台速度为20 m/min(根据Armstrong[13]的公式y=1.25x+47.7(y为VO2max百分比;x为跑台速度),本研究采用的相对强度是 72%VO2max强度),运动时间1 h。耐力训练组大鼠采用同样的跑台运动方式,每天1 h,持续1周。根据预实验结果一次性运动组大鼠运动后3 h取材,耐力训练组大鼠最后一次训练后12 h取材,乙醚麻醉后取右侧股四头肌,迅速投入液氮,再转移至-80 ℃冰箱保存。
1.4 指标测定方法
1)CaMK II磷酸化水平。
取大鼠股四头肌100 mg,液氮研磨,移入离心管并加入1 mL蛋白裂解液,冰上静置30 min,4 ℃ 12 000 r/min离心1 h,取上清。蛋白含量采用pierce公司的BCA蛋白定量试剂盒测定。聚丙烯酰胺凝胶电泳分离目标蛋白(P-CaMKII和β-actin),再将蛋白转移至硝酸纤维素膜上,5%脱脂奶粉封闭。一抗(P-CaMKII,β-actin) 4 ℃孵育过夜,二抗室温孵育1 h。曝光前加入发光液,暗处反应1 min,暗室压片曝光。生物电泳图像分析软件拍照,Image J软件读取蛋白的积分灰度值,结果以积分灰度值的比值表示。
2)GLUT4 mRNA表达。
大鼠股四头肌100 mg,液氮研磨后,1 mL Trizol冰上静置10 min,0.2 mL氯仿冰上静置5 min,4 ℃12 000 r/min离心15 min,取上清,等体积异丙醇室温静置10 min,4 ℃ 12 000 r/min离心15 min,弃上清,1 mL体积分数为75%酒精,4 ℃ 7 500 r/min离心10 min,弃上清,10 μL EDPC水溶解mRNA。逆转录的反应条件:75 ℃ 5 min,42 ℃ 1 h,70 ℃ 15 min。实时定量部分采用ABI公司荧光染料反应混合体系试剂盒。加入目的基因的 cDNA模板后,再分别加入GLUT4的引物和β-actin的引物,进行实时定量。所需引物由上海生工合成。实时定量数据由ABI实时定量7500 PCR仪测得,数据由仪器自带分析软件分析完成。mRNA表达结果以比较CT法相对定量[14]。
3)MEF2和GLUT4结合活性。
EMSA法测定MEF2和GLUT4结合活性。Pierce核蛋白提取试剂盒提取核蛋白,Pierce蛋白定量试剂盒测定蛋白含量。聚丙烯酰胺凝胶预电泳20 min后,配置10 μL上样体系(4 μL三蒸水、2 μL细胞核蛋白、2 μL标记探针、2 μL 5X EMSA/Gel-Shift上样缓冲液)。加入标记探针后,混匀,室温放置20 min,再加入2 μL EMSA/Gel-Shift上样缓冲液,混匀后立即上样。电泳电压按照10 V/cm设置。电泳至上样缓冲液中的蓝色染料溴酚蓝至胶下1/4处。Western所使用的电转膜装置,0.5XTBE为转膜液,把胶上的探针或蛋白以及探针和蛋白的复合物转移到尼龙膜上。紫外交联仪254 nm紫外波长交联45~60 s。封闭液封闭15 min,加入一定量抗生物素蛋白链菌素+辣根过氧化物酶复合物,摇床上摇动15 min,并洗涤4次后,暗室曝光。生物电泳图像分析软件拍照,ImageJ软件读取蛋白的积分灰度值。结果以积分灰度值的比值表示。
1.5 数据统计
统计分析使用SPSS 13.0统计学分析软件完成。所有数据均以平均数±标准差表示。同一指标之间比较采用单因素方差分析。显著性水平为P<0.05。
2 试验结果及分析
2.1 CaMK II磷酸化水平
由图1、图2看出,正常对照及糖尿病大鼠一次性运动组,CaMK II磷酸化水平与安静对照组相比分别升高了96%和140%(P<0.05)。正常对照及糖尿病大鼠一次运动+KN93组,CaMK II磷酸化水平与一次性运动组相比分别降低了 37%和 48%(P<0.05),且与安静对照组相比差异均没有显著性(P>0.05)。
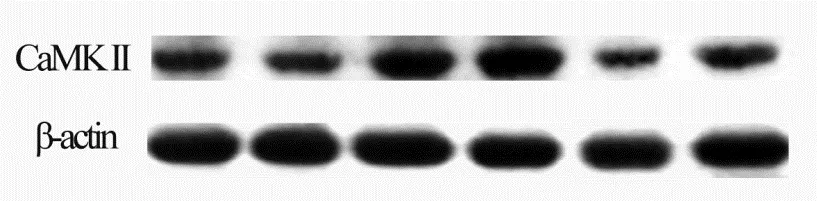
图1 P-CaMKII蛋白表达图谱
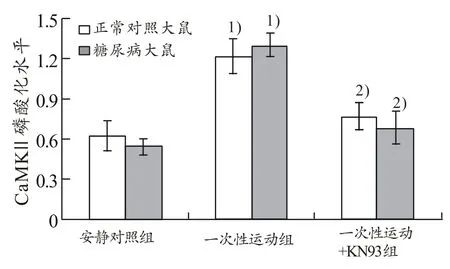
图2 CaMK II磷酸化水平
2.2 GLUT4基因表达量
由图3看出,正常对照大鼠一次性运动组及耐力训练组,骨骼肌GLUT4基因表达量与安静对照组相比分别升高了54%和172%(P<0.05)。一次运动+KN93组,骨骼肌 GLUT4基因表达量与一次性运动组相比降低了27%(P<0.05),耐力训练+KN93组,骨骼肌GLUT4基因表达量与耐力训练组相比没有显著差异(P>0.05)。糖尿病大鼠一次性运动组,骨骼肌GLUT4基因表达量与安静对照组相比没有显著差异(P>0.05),耐力训练组,骨骼肌GLUT4基因表达量与正常对照大鼠耐力训练组相比低了36%(P<0.05),但与安静对照组相比升高了145%(P<0.05)。耐力训练+KN93组,骨骼肌GLUT4基因表达量与耐力训练组相比降低了29%(P<0.05),但与安静对照组相比仍升高了74%(P<0.05)。
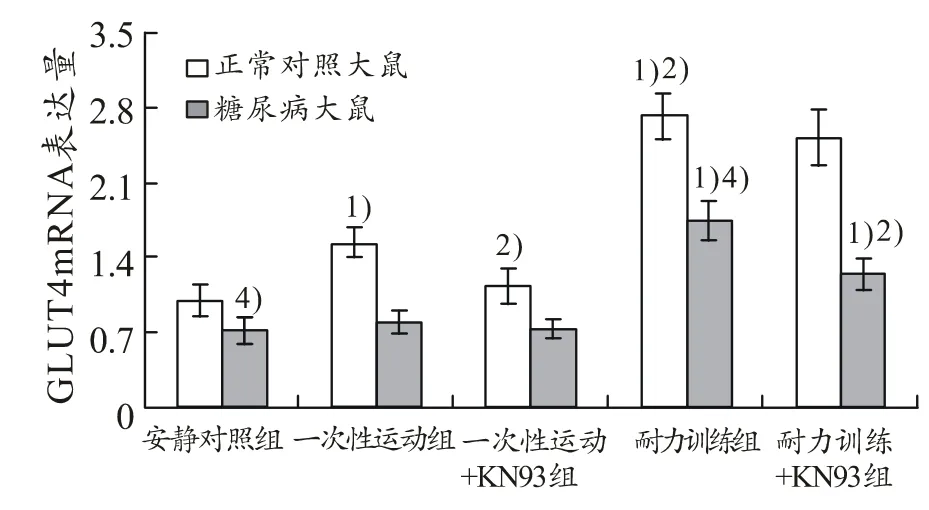
图3 GLUT4基因表达量(相对值)
2.3 MEF2-GLUT4结合活性
由图4看出,正常对照大鼠一次性运动组及耐力训练组,骨骼肌MEF2和GLUT4结合活性与安静对照组相比分别升高了 113%和 244%(P<0.05)。一次运动+KN93组,骨骼肌MEF2和GLUT4结合活性与一次性运动组相比降低了42%(P<0.05),耐力训练+KN93组,骨骼肌MEF2和GLUT4结合活性与耐力训练组相比没有显著差异(P>0.05)。糖尿病大鼠一次性运动组,骨骼肌MEF2和GLUT4结合活性与安静对照组相比没有显著差异(P>0.05),耐力训练组,骨骼肌MEF2和GLUT4结合活性与安静对照组相比升高了157%(P<0.05)。耐力训练+KN93组,骨骼肌MEF2和GLUT4结合活性与耐力训练组相比降低了51%(P<0.05),且与安静对照组相比没有显著差异(P>0.05)。

图4 MEF2和GLUT4结合活性(相对值)
3 讨论
GLUT4作为骨骼肌中葡萄糖跨膜转运的重要转运蛋白,研究显示它的表达量失常是胰岛素抵抗的重要原因。而对于糖尿病患者来说,胰岛素抵抗是其中的重要环节[15-16]。运动可以提高GLUT4基因和蛋白的表达,那么运动对胰岛素抵抗的糖尿病患者骨骼肌GLUT4含量会产生什么影响呢。本实验发现糖尿病大鼠1 h跑台运动后,其骨骼肌GLUT4基因表达量并没有显著升高,而1周耐力训练之后,其骨骼肌GLUT4基因表达量虽然显著低于正常对照大鼠耐力训练组,但与糖尿病大鼠安静对照组相比已经显著升高,提示了虽然单纯的一次性运动可能并不能改善糖尿病大鼠骨骼肌GLUT4表达的缺陷,但经过一定时期的训练完全可以起到改善糖尿病大鼠GLUT4基因表达的作用,这对预防和治疗胰岛素抵抗有重要作用[17-18],但机制尚不清楚。
MEF2是最早在骨骼肌管核发现的一种能识别基因启动子、增强子或特定序列而调控基因表达的蛋白质。近年来大量离体和在体的研究均显示转录因子MEF2和GLUT4启动子区域MEF2结合位点结合,为GLUT4蛋白转录所必须[6-7]。虽然利用了两种不同的蛋白质和DNA结合活性测试方法,Smith等[8,19]的研究均显示了运动后MEF2和GLUT4结合活性显著提高。提示了运动通过提高MEF2和GLUT4的结合活性而提高骨骼肌GLUT4的表达。对于糖尿病大鼠来说,本实验发现一周耐力训练之后,其骨骼肌GLUT4表达提高的同时同样伴随着骨骼肌细胞核内MEF2和GLUT4结合活性的显著提高,提示了运动同样通过提高糖尿病大鼠骨骼肌 MEF2和 GLUT4结合活性而提高骨骼肌GLUT4的表达。而试验中糖尿病大鼠1次性跑台运动后,MEF2和GLUT4结合活性及GLUT4mRNA表达量均与安静对照组无显著性差异,可能为此推测提供了进一步的证据。
CAMK是一类广泛分布的丝/苏氨酸蛋白激酶家族,研究显示CAMKⅡ活性与THR286 位点的磷酸化水平呈高度正相关[20]。本实验中大鼠一次性跑台运动后,骨骼肌 CaMKⅡTHR286位点磷酸化水平显著升高,与以往研究的结果运动可以提高 CaMKⅡ活性相一致[20]。本试验中,运动+KN93组大鼠一次性跑台运动后,骨骼肌 CaMKⅡ活性显著低于跑台运动组,说明了 KN93抑制了运动对 CaMKⅡ的激活作用[21-22]。Smith等[8]的研究发现高表达具有稳定 CAMK II活性(constitutively active)的肌管细胞,其 MEF2和 GLUT4结合活性显著高于高表达显性CAMK II失活(dominant negative)的肌管细胞。Mukwevho等[9]的研究也发现,利用Caffeine 孵育激活C2C12肌管细胞CAMK II活性,可以引起肌细胞核内MEF2和GLUT4结合活性显著增加,而如果预先在培养基中加入CAMK II活性抑制剂KN93,这种变化消失,提示了CaMK II可能参与调节运动诱导的MEF2和GLUT4结合活性和GLUT4表达的增加。本实验中正常对照大鼠,1次性跑台运动+KN93其骨骼肌细胞核内MEF2和GLUT4的结合活性及骨骼肌GLUT4基因表达量均显著低于1次性跑台运动组,与实验假设及以往研究结果[8-9]相一致。
Zheng等[23]利用GLUT4氯霉素酰基转移酶报告基因转染小鼠骨骼肌细胞,发现转染包含位于 GLUT4启动子区域MEF2结合位点序列,并利用腺苷酸活化的蛋白激酶(5’-AMP activated protein kinase,AMPK)的药理激活剂AICAR(5’-aminoimidazole-4carboxamide-riboside)刺激小鼠骨骼肌细胞后,发现GLUT4氯霉素酰基转移酶报告基因活性显著增加。进一步的 EMSA实验也发现AICAR刺激组小鼠骨骼肌细胞核内MEF2和GLUT4结合活性也显著高于生理盐水组[23-24]。由于AICAR并不是AMPK的特异性激活剂[25],我们以往的研究利用转基因技术制造出 AMPK高表达转基因小鼠,发现由于AMPKα2的高表达,1 h跑台运动后,AMPKα2高表达转基因鼠骨骼肌细胞核内 MEF2和GLUT4结合活性及GLUT4基因表达量,均比野生鼠增加更为显著[19]。据此我们推测,CAMK II和AMPK可能均参与调节了运动后MEF2和GLUT4结合活性及GLUT4基因表达的增多,当其中一个通路长期受到抑制时,另外一个通路可能被激活从而代偿了受抑制通路对MEF2和GLUT4结合活性及GLUT4基因表达的调节作用。我们以往的实验结果AMPKα2基因敲除小鼠4周耐力后,骨骼肌MEF2和GLUT4结合活性及GLUT4基因表达量与野生鼠差异均没有显著性[19];本实验中耐力训练+KN93组大鼠,其骨骼肌细胞核内 MEF2和GLUT4的结合活性及骨骼肌GLUT4基因表达量与耐力训练组均没有显著差异,可能为此推测提供了进一步的证据。
对于糖尿病大鼠来说,实验发现耐力训练+KN93组糖尿病大鼠骨骼肌细胞核内MEF2和GLUT4的结合活性显著低于耐力训练组,提示了运动同样通过激活糖尿病大鼠骨骼肌CAMK II而提高其骨骼肌细胞核内MEF2和GLUT4的结合活性。而值得注意的是虽然耐力训练+KN93组糖尿病大鼠骨骼肌细胞核内MEF2和GLUT4的结合活性与安静对照组相比没有显著差异,但其骨骼肌 GLUT4基因表达量与安静对照组相比却显著升高,提示了对于糖尿病大鼠来说,MEF2和GLUT4的结合活性并不是影响其GLUT4表达的唯一因素,与正常大鼠实验结果不一致。Thai[7]的研究也发现,敲除GLUT4启动子区域上MEF2结合位点序列,虽然GLUT4mRNA表达会有所减低,但仍高于糖尿病大鼠mRNA表达水平,提示了GLUT4启动子区域还存在着未知的转录因子结合位点,未知的转录因子与此位点结合而调节GLUT4基因的转录。通过DNA序列同源性分析,Oshel[26]的研究发现,位于GLUT4启动子区域,长度为60对(-712/-772)碱基片段,具有90%以上的同源性,推测此区域可能存在转录因子结合位点。通过进一步的 DNaseⅠ足迹实验分析发现,-742/-712碱基序列对应部位有蛋白质与之结合,Oshel把此段序列命名为Domain 1区域。利用GLUT4萤火素酶报告基因转染 C2C12肌细胞,发现转染Domain 1区域碱基片段时,荧光素酶活性显著增加,说明其片段对于 GLUT4的表达有着重要作用。随后Oshel利用酵母单杂交技术筛选到与Domain区域序列的结合蛋白,并根据此蛋白功能命名为GLUT4增强因子(GLUT4 enhance factor,GEF)。事实上,近年来GEF对GLUT4表达的调节作用研究不是很多,再加上本实验研究并没有测定骨骼肌细胞核内GEF和GLUT4的结合活性,所以我们只能推测GEF可能参与调节了训练引起糖尿病大鼠GLUT4基因表达的提高,并以此来解释耐力训练+KN93组大鼠骨骼肌细胞核内MEF2和GLUT4的结合活性与安静对照组相比没有显著差异,而其骨骼肌 GLUT4基因表达量与正常对照组却显著升高,具体机制有待进一步研究。
运动通过激活糖尿病大鼠骨骼肌CAMK II而提高其骨骼肌细胞核内MEF2和GLUT4的结合活性,虽然MEF2和GLUT4的结合活性参与调节了正常大鼠骨骼肌GLUT4基因表达,但并不是影响糖尿病大鼠骨骼肌GLUT4基因表达的唯一因素。
[1] Gulve E A,Spina R J. Effect of 7-10 days of cycle ergometer exercise on skeletal muscle GLUT4 protein content [J]. J Appl Physiol,1995,79:1562-1566.
[2] Kraniou Y,Cameron-Smith D,Misso M,et al.Effects of exercise on glut4 and glycogenin gene expression in human skeletal muscle[J]. J Appl Physiol,2000,88(2):794-796.
[3] Kraniou G N,Carmeron-Smith D,Hargreaves M.Effect of short-term training on glut4 mRNA and protein expression in human skeletal muscle[J]. Exp Physiol,2004,89(5):559-563.
[4] Ren J M,Marshall B A,Gulve E A,et al. Evidence from transgenic mice that glucose transport is rate-limiting for glycogen deposition and glycolysis in skeletal muscle[J]. J Biol Chem,1993,268(22):16113-16115.
[5] Dohm G L. Invited review:Regulation of skeletal muscle GLUT4 expression by exercise[J]. J Appl Physiol,2002,93(2):782-787.
[6] Liu M L,Olson A L,Edgington N P,et al. Myocyte enhancer factor-2 (Mef2) binding-site is essential for C2C12 myotube-specif i c expression of the rat Glut4 muscle-adipose facilitative glucose-transporter gene[J]. J Biol Chem,1994,269:28514-28521.
[7] Thai M V,Guruswamy S,Cao K T,et al. Myocyte enhancer factor 2 (MEF2)-binding site is required for GLUT4 gene expression in transgenic mice. Regulation of MEF2 DNA binding activity in insulin-def i cient diabetes [J]. J Biol Chem,1998,273:14285-14292.
[8] Smith J A,Collins M,Grobler L A,et al. Exercise and CaMK activation both increase the binding of MEF2A to the Glut4 promoter in skeletal muscle in vivo[J]. Am J Physiol Endocrinol Metab,2007,292:E413-E420.
[9] Mukwevho E,Kohn T A,Lang D,et al. Caffeine induces hyperacetylation of histones at the MEF2 site on the Glut4 promoter and increases MEF2A binding to the site via a CaMK-dependent mechanism [J]. Am J Physiol Endocrinol Metab,2008,294:E582-E588.
[10] 张红学. CaMK Ⅱ参与调解运动诱导的MEF2/GLUT4 DNA结合活性及GLUT4表达研究[J].北京体育大学学报,2011,34(9):51-54.
[11] Rose A G,Hargreaves M. Exercise increases Ca2+-calmodulin-dependent protein kinase II activity in human skeletal muscle [J]. J Physiol,2003,553:303-309.
[12] Wu Y,Qu-Yang J P,Wu K,et al. Hypoglycemic effect of Astragalus polysaccharide and its effect on PTP1B[J]. Acta Pharmacologica Sinica,2005,26(3):345-352.
[13] Armstrong R B,Laughlin M H,More L,et al.Metabolism of rats running up and down an incline[J]. J Apply Physiol,1983,55(2):518-521.
[14] Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ddCT method[J]. Methods,2001,25:402-408.
[15] Zisma A,Peroni O D,Abel E D,et al. Targeted disruption of the glucose transporter 4 selectively in muscle causes insulin resistance and glucose intolerance[J]. Nat Med,2000,6(8):924-928.
[16] Abel E D,Peroni O,Kim J K,et al. Adipose-selective targeting of the GLUT4 gene impairs insulin action in muscle and liver[J]. Nature,2001,409(6821):672-673.
[17] Lecturque A,Loizeau M,Vaulont S,et al. Improvement of insulin action in diabetic transgenic mice selectively overepressing GLUT4 in skeletal muscle[J].Diabetes,1996,45(1):23-27.
[18] Tsao T S,Burcelin R,Katz E B,et al. Enhanced insulin action due to targeted GLUT4 overexpression exclusively in muscle[J]. Diabetes,1996,45(1):28-36.
[19] 龚豪杰,谢谨,张楠,等. 不同强度运动对AMPKα2三种不同基因状态鼠MEF2/GLUT4 DNA结合活性的影响[J]. 体育科学,2011,31(2):55-62.
[20] Rose A G,Hargreaves M. Exercise increases Ca2+-calmodulin-dependent protein kinase II activity in human skeletal muscle[J]. J Physiol,2003,553:303-309.
[21] Hudmon A,Schulman H. Neuronal Ca2+/calmodulin-dependent protein kinase II:the role of structure and autoregulation in cellular function[J]. Annu Rev Biochem,2002,71:473-510.
[22] Sumi M,Kiuchi K,Ishikawa T,et al. The newly synthesized selective Ca2+/calmodulin dependent protein kinase II inhibitor KN-93 reduces dopamine contents in PC12h cells[J]. Biochem Biophys Res Communm,1991,181:968-975.
[23] Zheng D,MacLean P S,Pohnert S C,et al.Regulation of muscle GLUT-4 transcription by AMP-activated protein kinase[J]. J Appl Physiol,2001,91:1073-1083.
[24] Holmes B F,Sparling D P,Olson A L,et al.Regulation of muscle GLUT4 enhancer factor and myocyte enhancer factor 2 by AMP-activated protein kinase[J]. Am J Physiol Endocrinol Metab,2005,289:E1071-E1076.
[25] Young M E,Radda G K,Leighton B. Activation of glycogen phosphorylase and glycogenolysis in rat skeletal muscle by AICAR-an activator of AMP-activated protein kinase[J]. FEBS Lett,1996,382:43-47.
[26] Oshel K M. Knight J B,Cao K T,et al. Identification of a 30-base pair regulatory element and novel DNA binding protein that regulates the human GLUT4 promoter in transgenic mice[J]. J Biol Chem,2000,275(31):23666-23673.
