皱皮柑果皮中总黄酮的回流提取工艺研究
2013-11-18李良导钟晓红孙化鹏王超华
张 珉, 李良导, 钟晓红*, 孙化鹏, 王超华
(1.湖南省林业科学院, 湖南 长沙 410004; 2.湖南农业大学, 湖南 长沙 410128; 3.广州大学, 广东 广州 510006)
皱皮柑果皮中总黄酮的回流提取工艺研究
张 珉1, 李良导2, 钟晓红2*, 孙化鹏2, 王超华3
(1.湖南省林业科学院, 湖南 长沙 410004; 2.湖南农业大学, 湖南 长沙 410128; 3.广州大学, 广东 广州 510006)
采用回流提取法,通过单因素试验和正交试验,研究了皱皮柑果皮中总黄酮的提取工艺。结果表明:皱皮柑果皮中总黄酮的最佳提取工艺条件为乙醇浓度70%、水浴温度90℃、料液比1∶30、回流时间60min、粒径为20目(0.90mm)。在此条件下,总黄酮提取率可达1.56%。各因素对总黄酮提取率影响的主次顺序为回流时间>粒径>水浴温度>乙醇浓度>料液比。
皱皮柑; 总黄酮; 回流提取; 提取工艺
皱皮柑属于柑橘(Citrus)地方品种,其栽培历史至少在千年以上。皱皮柑皮皱,味兼有苦、酸、甜感,有回味,具有止咳、生津、降火等药用功能[1-2]。国内有关皱皮柑药效成分的研究尚属空白。黄酮类化合物被认为是柑橘中最主要的药效成分之一,具有抗炎、降血压、抗氧化、抗癌等生理活性[3-12]。从皱皮柑果皮中分离提取黄酮类化合物,对于皱皮柑的深加工及其在医药、食品、工业等领域的应用,具有重要的理论意义和实用价值。我们以皱皮柑为原料,采用回流提取法对皱皮柑果皮中的总黄酮进行提取,并通过单因素试验和正交试验对提取工艺进行优化。
1 材料与方法
1.1 试验材料
1.1.1 样品 皱皮柑采自湖南省华容县。新鲜皱皮柑洗净、剥皮,果皮40℃烘干、粉碎过筛,密封备用。
1.1.2 仪器和试剂 DHG — 9246A电热恒温鼓风干燥箱(上海精宏实验设备有限公司);FY130型微型植物粉碎机(天津泰斯特仪器有限公司);FA1004N精密电子天平(上海精密科学仪器有限公司);SHZ — Ⅲ循环水式多用真空泵(上海亚荣生化仪器厂);1 — 2LD UV — VIS分光光度计(日本Shimadzu公司)。
芦丁对照品(拓康生物医药科技有限公司,纯度≥98%);石油醚(30~60℃沸程);甲醇;无水乙醇;乙酸乙酯;丙酮;正丁醇;亚硝酸钠;硝酸铝;氢氧化钠。所使用的试剂均为国产分析纯。
1.2 试验方法
1.2.1 芦丁标准曲线的绘制 准确吸取0.1mg/mL的芦丁对照品溶液0.0、1.0、2.0、3.0、4.0、5.0mL分别置于10mL容量瓶中,各加30%乙醇使成5mL,先加5% NaNO2溶液0.3mL,摇匀,放置6min,再加10%Al(NO3)3溶液0.3mL,摇匀,放置6min,加4% NaOH溶液4mL,用蒸馏水稀释到10mL,摇匀,放置15min,以第一管作空白,在吸收波长510nm处测定吸光度值,以吸光度值为纵坐标,芦丁对照品溶液浓度为横坐标,绘制标准曲线[13],得标准工作曲线方程为:
y=11.009x+0.0053,R=0.9998。
1.2.2 提取溶剂的选择 精密称取果皮粉末各1g于圆底烧瓶中,分别加入甲醇、乙醇、乙酸乙酯、丙酮和正丁醇5种不同溶剂,在水浴温度60℃、料液比1∶25、回流时间60min、粒径为60目的条件下进行回流提取,抽滤,滤液定容至100mL,按1.2.1的方法测定吸光度,并计算出总黄酮的提取率。
1.2.3 单因素试验 精密称取果皮粉末各1g于圆底烧瓶中,设计10%、30%、50%、70%、90%不同乙醇浓度;50℃、60℃、70℃、80℃、90℃不同水浴温度;1∶20、1∶30、1∶40、1∶50不同料液比;10目、20目、40目、60目不同粒径大小;10min、30min、60min、90min、120min不同提取时间进行回流提取,抽滤,滤液定容至100mL,按1.2.1的方法测定吸光度,并计算出总黄酮的提取率。
1.2.4 正交试验 在单因素试验的基础上,选择乙醇浓度、水浴温度、料液比、回流时间和粒径作为考察因素,按L16(45)设计五因素四水平正交试验(见表1),试验重复3次。以总黄酮的提取率为指标对提取工艺进行优化。
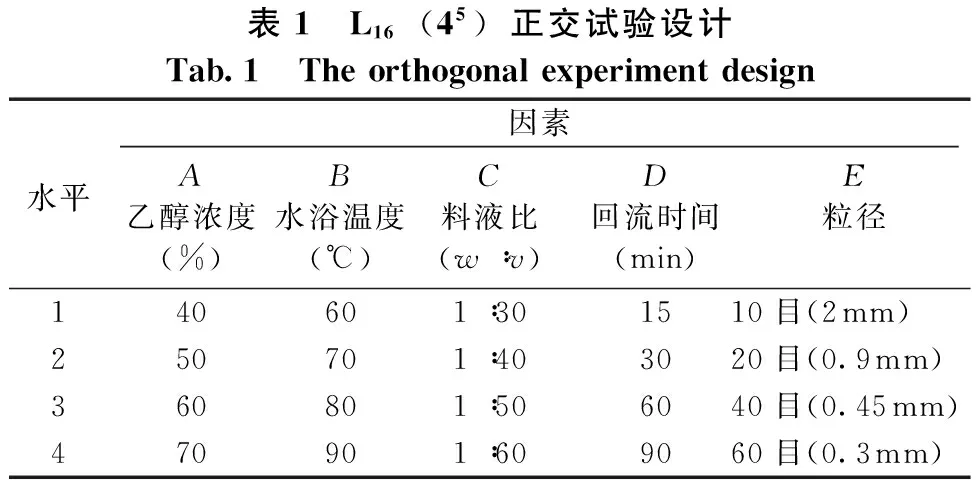
表1 L16(45)正交试验设计Tab.1 Theorthogonalexperimentdesign水平因素A乙醇浓度(%)B水浴温度(℃)C料液比(w∶v)D回流时间(min)E粒径 140601∶301510目(2mm)250701∶403020目(0.9mm)360801∶506040目(0.45mm)470901∶609060目(0.3mm)
1.2.5 数据处理 应用统计软件DPS V3.01专业版对试验数据进行统计分析。
2 结果与分析
2.1 不同溶剂对总黄酮提取率的影响
从图1可看出,5种提取溶剂中以甲醇为溶剂,皱皮柑果皮总黄酮提取率最高,其次为乙醇、正丁醇。考虑到甲醇本身的毒性及选择提取溶剂的经济实用性,因此选定提取率相对较高,毒性较小,且价廉、易得的乙醇作为提取溶剂。
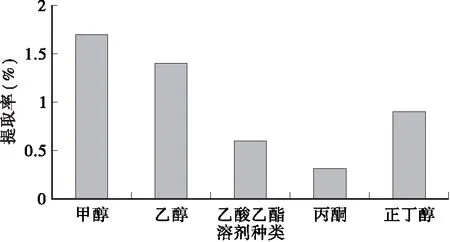
图1 不同溶剂对总黄酮提取率的影响Fig.1 Effect of different solvents on the extraction rate
2.2 单因素试验结果
2.2.1 乙醇浓度对提取率的影响 从图2可看出,在水浴温度70℃、料液比1∶50、回流时间30min、粒径为60目的提取条件下,随着乙醇浓度的增加,皱皮柑果皮总黄酮的提取率先上升后下降,当乙醇浓度为50%时,总黄酮提取率最高。这可能是因为乙醇浓度过高,一些醇溶性杂质、色素等成分溶出量增加,从而导致总黄酮提取率下降[14]。
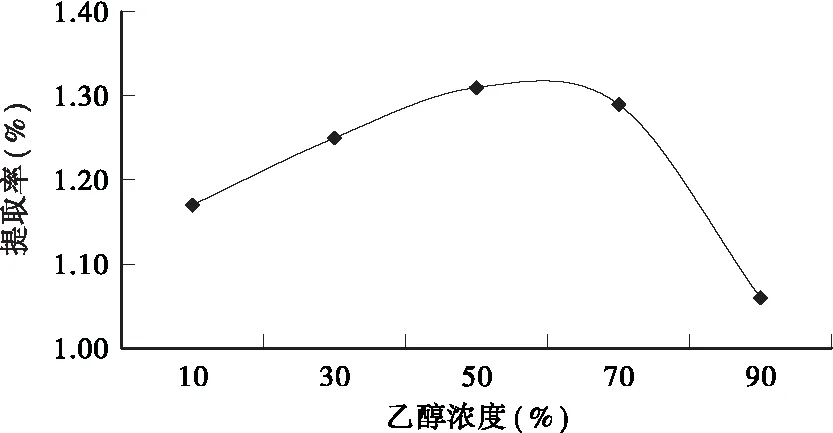
图2 乙醇浓度对总黄酮提取率的影响Fig.2 Effect of ethanol concentration on the extraction rate of total flavonoids
2.2.2 水浴温度对提取率的影响 从图3可看出,在乙醇浓度50%、料液比1∶50、回流时间30min、粒径为60目的提取条件下,随着水浴温度的升高,皱皮柑果皮总黄酮提取率呈上升趋势,但当水浴温度超过70℃时,总黄酮提取率则呈下降趋势。这可能是因为在过高的水浴温度下,可溶性蛋白质溶出变性,阻碍了黄酮类物质的溶出,从而导致总黄酮提取率下降[15]。
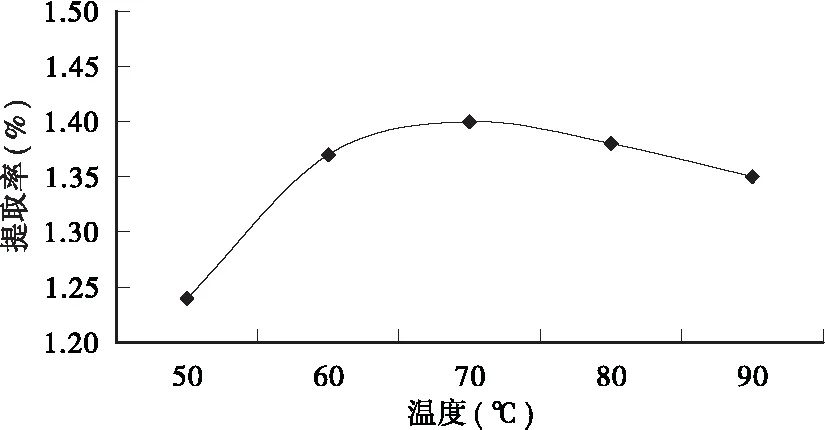
图3 水浴温度对总黄酮提取率的影响Fig.3 Effect of water bath temperature on the extraction rate of total flavonoids
2.2.3 料液比对提取率的影响 从图4可看出,在乙醇浓度50%、水浴温度70℃、回流时间30min、粒径为60目的提取条件下,随着料液比的增大,皱皮柑果皮总黄酮提取率不断上升,但当料液比增至1∶40后,总黄酮提取率的增加已趋于平缓。
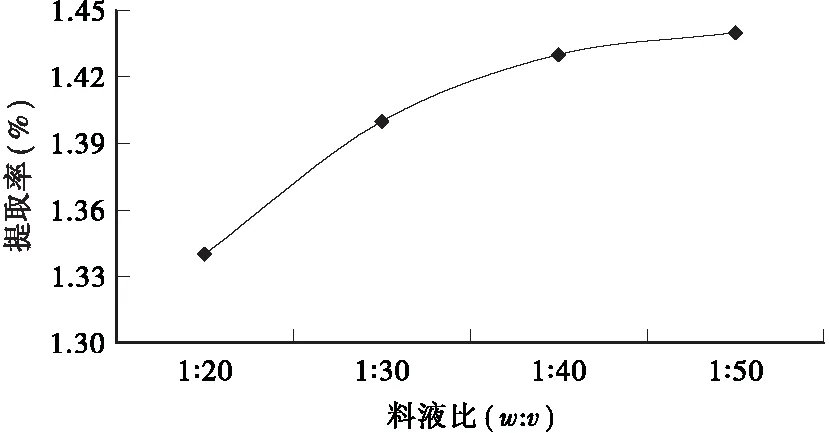
图4 料液比对总黄酮提取率的影响Fig.4 Effect of the ratio of material to solvent on the extraction rate of total flavonoids
2.2.4 回流时间对提取率的影响 从图5可看出,在乙醇浓度50%、水浴温度70℃、料液比1∶50、粒径为60目的提取条件下,随着回流时间的延长,皱皮柑果皮总黄酮提取率先上升后下降,当回流时间为30min时总黄酮提取率最高。这可能是因为回流时间过长会导致黄酮类物质氧化和分解等副反应发生,从而导致总黄酮提取率下降[16]。
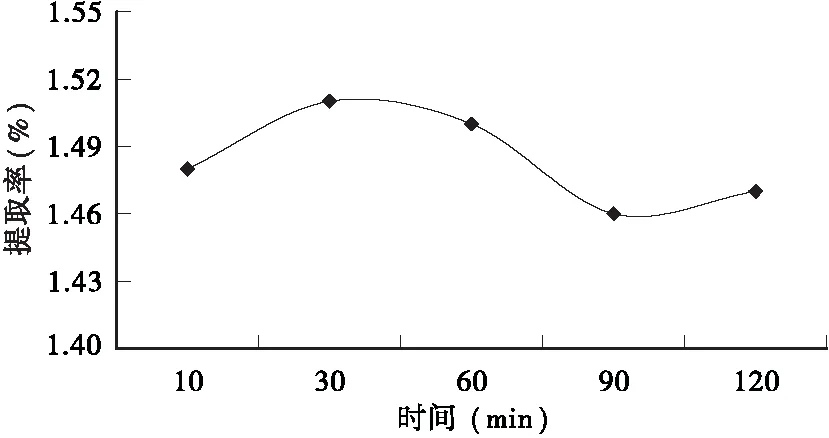
图5 回流时间对总黄酮提取率的影响Fig.5 Effect of refluxing time on the extraction rate of total flavonoids
2.2.5 粒径对提取率的影响 从图6可看出,在乙醇浓度50%、水浴温度70℃、料液比1∶50、回流时间30min的提取条件下,粒径大小对总黄酮提取率的影响较显著。从总体上来看,随着粒径的减小,皱皮柑果皮总黄酮提取率呈上升趋势。其中,过20目与40目筛的果皮粉末,其总黄酮提取率相差不大,过60目筛的果皮粉末总黄酮提取率最高。这可能是因为粒径越小其比表面积越大,与溶剂的接触面积也越大,从而总黄酮提取率增加[17]。
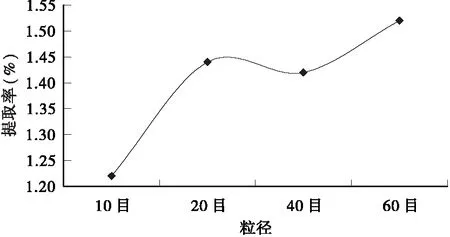
图6 粒径对总黄酮提取率的影响Fig.6 Effect of particle size on the extraction rate of total flavonoids
2.3 正交试验结果
由表2可知,各因素对总黄酮提取率影响的主次顺序为:D>E>B>A>C,即回流时间>粒径>水浴温度>乙醇浓度>料液比。通过方差分析可知(见表3),乙醇浓度、水浴温度、回流时间和粒径对总黄酮提取率具有显著性影响,而料液比对总黄酮提取率的影响则不显著。皱皮柑果皮中总黄酮的最佳回流提取工艺条件为A4B4C1D3E2,即乙醇浓度70%、水浴温度90℃、料液比1∶30、回流时间60min、粒径为20目(0.90mm)。在此条件下,皱皮柑果皮中总黄酮提取率可达1.56%。
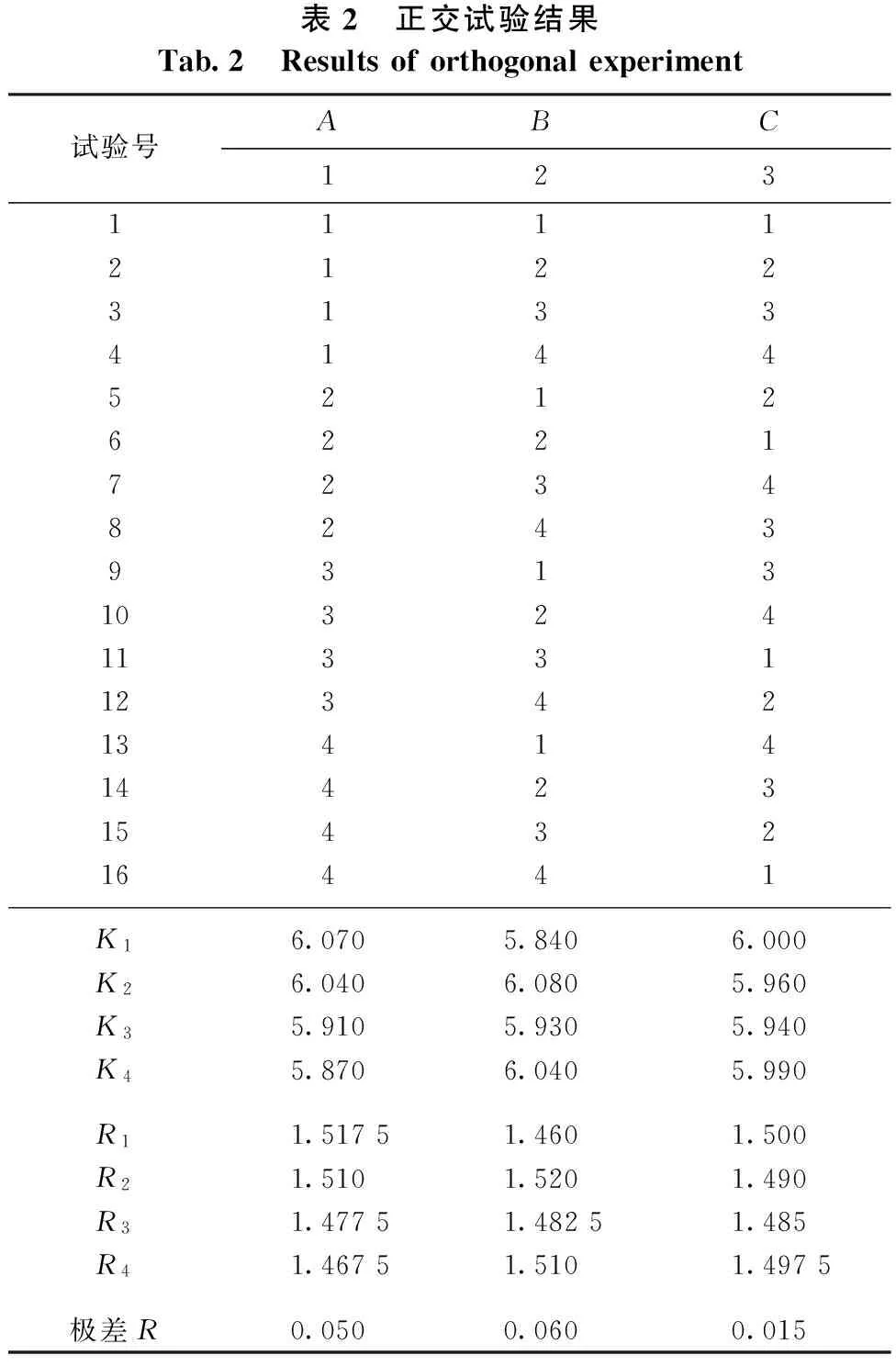
表2 正交试验结果Tab.2 Resultsoforthogonalexperiment试验号ABC12311112122313341445212622172348243931310324113311234213414144231543216441K16.0705.8406.000K26.0406.0805.960K35.9105.9305.940K45.8706.0405.990R11.51751.4601.500R21.5101.5201.490R31.47751.48251.485R41.46751.5101.4975极差R0.0500.0600.015
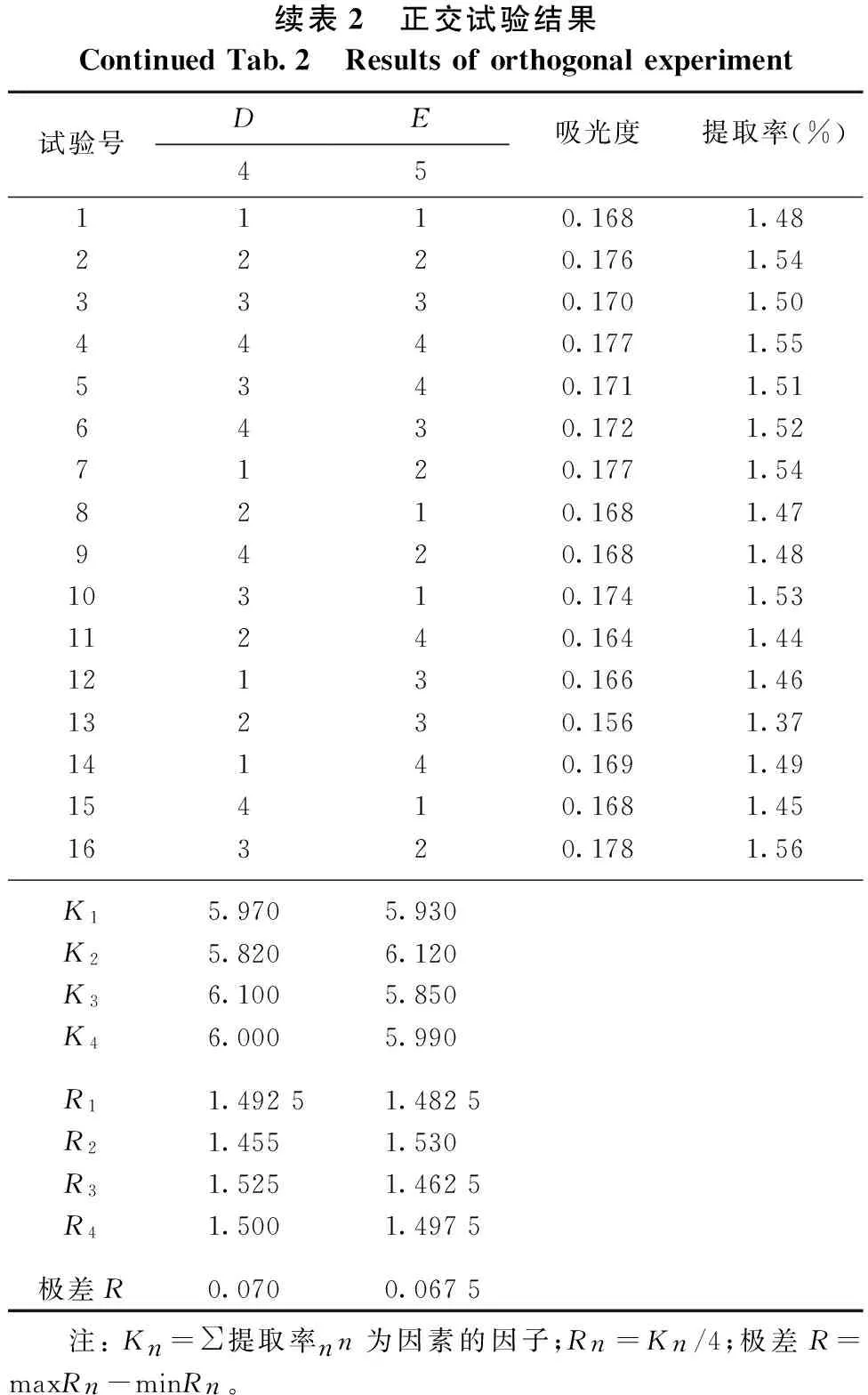
续表2 正交试验结果ContinuedTab.2 Resultsoforthogonalexperiment试验号DE吸光度提取率(%)451110.1681.482220.1761.543330.1701.504440.1771.555340.1711.516430.1721.527120.1771.548210.1681.479420.1681.4810310.1741.5311240.1641.4412130.1661.4613230.1561.3714140.1691.4915410.1681.4516320.1781.56K15.9705.930K25.8206.120K36.1005.850K46.0005.990R11.49251.4825R21.4551.530R31.5251.4625R41.5001.4975极差R0.0700.0675 注:Kn=∑提取率nn为因素的因子;Rn=Kn/4;极差R=maxRn-minRn。
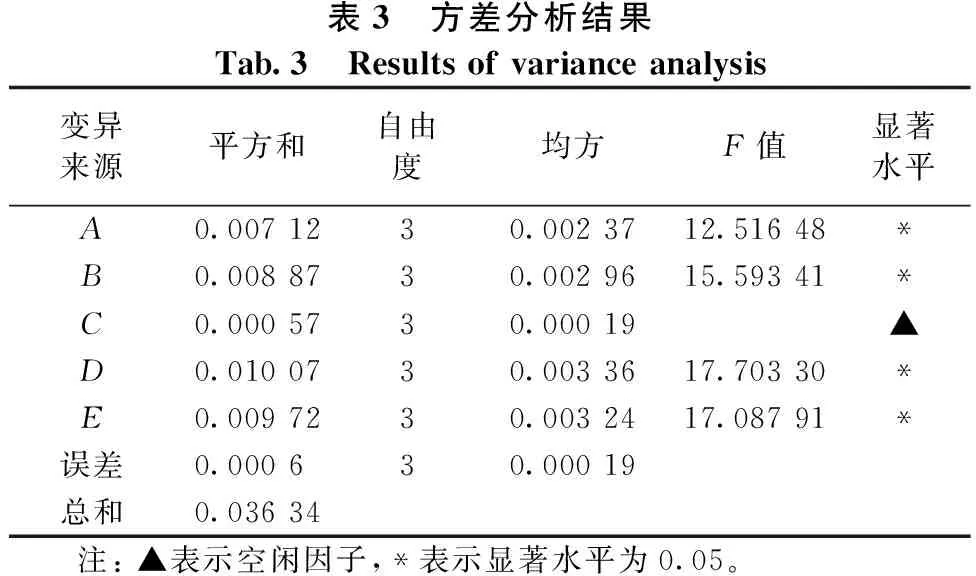
表3 方差分析结果Tab.3 Resultsofvarianceanalysis变异来源平方和自由度均方F值显著水平A0.0071230.0023712.51648*B0.0088730.0029615.59341*C0.0005730.00019▲D0.0100730.0033617.70330*E0.0097230.0032417.08791*误差0.000630.00019总和0.03634 注:▲表示空闲因子,*表示显著水平为0.05。
3 结论与讨论
本试验采用回流提取法对皱皮柑果皮中的总黄酮进行了提取,在单因素试验的基础上,通过正交试验确定了最佳提取工艺,即用过20目筛的皱皮柑果皮粉末,按1∶30料液比加入浓度为70%的乙醇,在水浴温度为90℃条件下进行热回流60min。在此条件下,皱皮柑果皮中总黄酮提取率可达1.56%。各因素对总黄酮提取率影响的主次顺序为回流时间>粒径>水浴温度>乙醇浓度>料液比。
该回流提取工艺具有简便易行、成本低的优点,适用于皱皮柑果皮中总黄酮的提取。本研究为皱皮柑果皮中黄酮类物质的进一步分离鉴定奠定了基础。
[1] 余送辉.柑橘地方良种华容皱皮柑的初步研究[D].长沙:湖南农业大学, 2003.
[2] 余送辉,甘霖.华容皱皮柑[J].中国南方果树,2003(2):21.
[3] 娄桂予,江渝,彭家和. 橙皮甙抗LDL氧化及对MCP-1mRNA转化的影响[J]. 第三军医大学学报, 2004, 26 (8): 717-719.
[4] 秦得安,王晓玲. 橙皮苷对羟自由基的清除作用[J]. 中国药学杂志, 1996, 31 (7): 390.
[5] 张秀荣.黄酮类化合物心血管作用的研究进展[J].心血管病学进展,2003,24(3):173-175.
[6] 周鸣谦,王仁才,邓子牛,等. 不同品种柑橘落果的药用成分研究[J]. 湖南农业大学学报:自然科学版,2008,34(4):438-441.
[7] 张珉,钟晓红,李良导.皱皮柑果皮中主要黄酮类成分分析[J]. 湖南农业大学学报:自然科学版,2009,35(3):292-294.
[8] 张鞍灵,高锦明,王姝清. 黄酮类化合物的分布及开发利用[J]. 西北林学院学报,2005,15(1):69-74.
[9] 李红,敖海英,赵征. 柑橘类黄酮功能及利用的研究进展[J]. 食品研究与开发,2003,24(1):18-20.
[10] 黄河胜,马传庚,陈志武.黄酮类化合物药理作用研究进展[J].中国中医杂志,2000,25(10):589-591.
[11] 赵国华,陈宗道.柑桔类黄酮生物活性的研究进展[J]. 食品与发酵工业, 2001,27(3):71-75.
[12] 赵雪梅,朱大元,叶兴乾,等.柑桔属中类黄酮的研究进展[J].天然产物研究与开发,2002,14(1):89-92.
[13] 李良导. 皱皮柑果皮中总黄酮的提取、纯化及初步鉴定[D]. 长沙:湖南农业大学, 2008.
[14] 江明珠,陈星,颜辉,等.响应曲面法优化女贞子总黄酮的超声波提取工艺[J]. 江苏科技大学学报:自然科学版, 2010, 24(6):604-608.
[15] 罗志刚,赵喜红,何小维.柿叶中黄酮类物质提取的影响因素及抗氧化性研究[J].广东农业科学,2006(12):67-70.
[16] 王瑾,马延,王占红,等. 落新妇中岩白菜素的回流提取工艺研究[J]. 西北林学院学报, 2012,27(4):186-189.
[17] 朱庆书,赵文英,金青,等. 加压提取枳实总黄酮的研究[J].化学工业与工程, 2010, 27(5):415-419.
(文字编校:杨 骏)
Refluxingextractiontechnologyoftotalflavonoidsfromthepeelofrough-peelmandarin
ZHANG Min1, LI Liangdao2, ZHONG Xiaohong2*, SUN Huapeng2, WANG Chaohua3
(1.Hunan Academy of Forestry, Changsha 410004, China; 2.Hunan Agricultural University, Changsha 410128, China; 3.Guangzhou University, Guangzhou 510006, China)
The extraction technology of total flavonoids from the peel of rough-peel mandarin by refluxing method was studied through the single-factor and orthogonal experiments. The results showed that, the optimal extraction conditions were ethanol concentration 70%, water bath temperature 90 ℃, ratio of material to solvent 1∶30, refluxing time of 60 min and particle size 20 meshes. At the optimal conditions, the extraction rate of total flavonoids reached 1.56%. The sequences of factors influencing the extraction rate were refluxing time>particle size>water bath temperature>ethanol concentration>the ratio of material to solvent.
rough-peel mandarin; total flavonoids; refluxing extraction; extraction technology
2013 — 04 — 15
湖南省科学技术厅项目(BK0660)。
* 为通讯作者
R 284
A
1003 — 5710(2013)04 — 0014 — 04
10. 3969/j. issn. 1003 — 5710. 2013. 04. 004
