人胎盘AC133+造血干/祖细胞的集落形成能力
2013-11-18喻晓丹
喻晓丹
(遵义师范学院生命科学学院,贵州遵义563002)
造血干/祖细胞(hematopoietic stem/progenitor cells,HPSC)普遍存在于骨髓(bone marrow,BM)、动员的外周血(mobilized peripheral blood,PB)和脐带血(umbilical cord blood,UCB)等组织中[1-3]。Takahashid等的研究发现,小鼠的胎盘具有造血功能[4]。近年来的研究表明,人胎盘组织富含造血干细胞,其CD34+细胞的百分率为脐带血的8.8倍[5,6]。AC133为近年来确立的一种新的HPSC特征性膜表面标志[7,8]。已有的研究表明,AC133仅表达于造血组织和有限的几种低分化肿瘤细胞株当中[9,10],这不仅说明AC133标志比CD34更为原始,由此,有必要对胎盘组织 AC133+细胞组分的含量及其血细胞增殖分化能力作出评价。本实验采用免疫磁性细胞分选法(magnetic activated cell sorting,MACS)分选人胎盘组织AC133+,并用不同培养体系分别对其进行血细胞集落形成培养,以评价其增殖分化能力。
1 材料和方法
1.1 主要试剂
Ficoll Histopaque购于 Sigma公司;IMDM、FBS、DES、EPO购于Gibco公司;IL-3、GM-CSF、Methylcellulose购于Intergen公司;AC133Mutisort免疫磁珠细胞分选试剂盒及 M iniMACS分离柱购于M iltenyi Biotee公司;荧光素标记单抗 AC133-PE McAb、M cAb购自BD公司;其余试剂均为分析纯。
1.2 胎盘的来源
足月分娩人胎盘,HbsAg-,胎盘于6h内进入实验程序。
1.3 胎盘组织(Placenta tissue, PT)单个核细胞(MNC)悬液的制备
用PBS清洗胎盘表面血迹,剪去胎膜后,多点全层剪取100g胎盘组织,再用PBS洗净残留的血液,将其剪碎,经机械分离(不锈钢网搓)得到胎盘组织单个核细胞(MNC)悬液,该过程在冰浴中进行。胎盘组织单个核细胞(MNC)悬液1500 rpm离心5m in,细胞沉淀用IMDM悬浮,Histopaque分选MNC,镜下计数 MNC,台盼蓝染色观察细胞活力(细胞活力>90%)。
1.4 PT-AC133+和PT-AC133-细胞亚群的免疫磁性分选
按AC133Mutisort试剂盒说明分选PT AC133+和AC133-细胞亚群。
1.5 胎盘细胞样品的流式细胞仪(FCM)分析
调细胞浓度至1×106/m L,于盛有20L相应单抗(AC133-PE、CD34-PE)的试管中加入100L细胞悬液,混匀,室温避光静置20min,1000 rpm离心5m in,弃上清,重新悬浮细胞。每管加入2m L含0.1%NaN3的PBS,混匀,1000 rpm离心 5 min,弃上清,再悬浮细胞;每管加入0.5m L1%的多聚甲醛,混匀,2~8ºC避光放置,上机分析。采用CellQuest软件对标记样品进行采集和分析(每管采集2×104个细胞)。MNC和AC133+细胞绝对计数用ProCOUNT软件采集和分析。AC133+细胞纯度按文献介绍的公式计算[4]。
1.6 血细胞集落形成培养
对从胎盘分选的AC133+、AC133-细胞分别进行CFU-GM、CFU-E、CFU-M ix培养。
1.6.1 CFU-GM培养
用琼脂培养体系进行CFU-GM培养。采用直径为35mm塑料平皿,种入1m L培养体系,培养基为RPM I1640,其中含20%FBS、5000个细胞、200U 粒细胞―巨噬细胞集落刺激因子(GM-CSF),最后加入40℃保温的3%琼脂0.1m L,迅速混匀,静置冷却使之凝固,重复3个皿,37℃,5%CO2、饱和湿度条件下培养10~14d,观察CFU-GM形成情况。
1.6.2 CFU-E培养
用甲基纤维素培养体系进行CFU-E培养。采用直径为35mm塑料平皿,种入1m L培养体系,培养基为 IMDM,其中含 30%FBS、5000个细胞、10%0.1m L、10 U EPO、100 U IL-3、14.3 mM/L 2-ME 3L,最后加入2.7%甲基纤维素0.3m L,混匀,重复3个皿,37℃,5%CO2、饱和湿度条件下培养10 ~14d,观察CFU-E形成情况。
1.6.3 CFU-M ix培养
用甲基纤维素培养体系进行CFU-M ix培养。采用直径为35mm塑料平皿,种入1m L培养体系,培养基为IMDM,30%FBS、5000个细胞、10%0.1m L、10U EPO、PHA-LCM(植物凝集素-白细胞条件培养基)0.3m L、14.3 mM/L 2-ME 3L,最后加入2.7%甲基纤维素0.3m L,混匀,重复3个皿,37℃,5%CO2、饱和湿度条件下培养14~20d,观察CFU-M ix形成情况。
1.6.4 统计学处理
等甲洛洛激动的心情渐渐平复,他又想起自己肩负的使命,既然小丁不是小偷,那小偷一定另有其人,可又是谁呢?他又开始从头整理思绪:
集落数数据以均数±标准差(M±S)表示,若方差齐,采用 检验,若方差不齐,则采用 检验进行两样本间的比较。
2 结果
2.1 胎盘组织AC133+细胞组分的百分率
胎盘组织AC133+细胞组分的百分率见表1。
2.2 胎盘AC133+HSPCS的血细胞系集落形成能力
2.2.1 CFU-GM形成能力
经14d培养,胎盘AC133+细胞可见CFU-GM(见图 1-A),其 CFU-GM 数为(37±3)/1×103。胎盘AC133-细胞组分无CFU-GM形成。

表1 胎盘单个细胞中AC133+细胞数量
2.2 CFU-M ix形成能力
经14 d培养,胎盘AC133+细胞组分可见CFU-M ix形成(见图1-B),其集落形成数是(34±5)/1×103。而胎盘AC133-细胞组分无CFU-M ix形成。
2.2.3 CFU-E形成能力
经7d培养,胎盘AC133+细胞组分可形成CFUE,其集落数为(33±4)/1×103(见图1-C)。胎盘AC133-细胞组分无CFU-E形成。
胎盘 AC133+细胞亚群 CFU-GM、CFU-M ix、CFU-E的形成能力无显著差异(P>0.05)(见图2)。
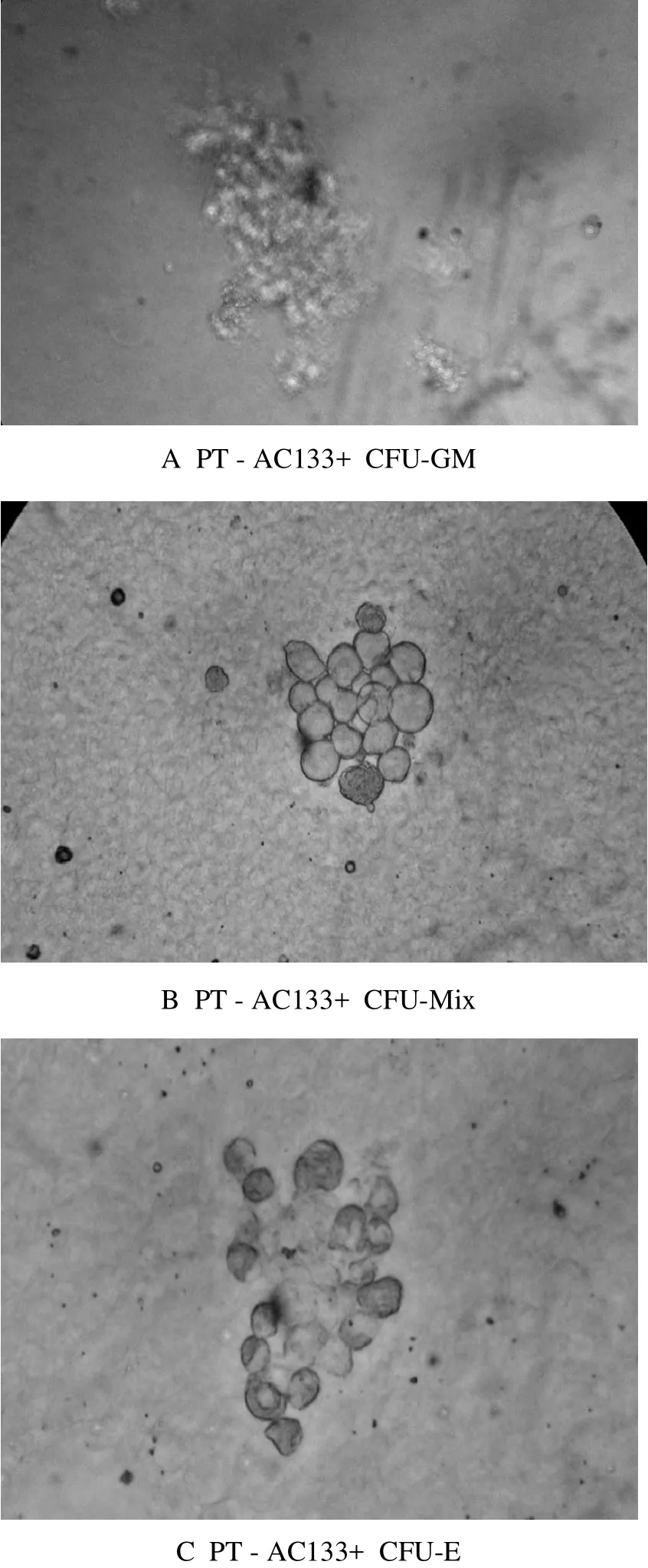
图1 胎盘单个细胞CFU-GM、CFU-M ix F、CFU-GM集落形成图

图 2 PT-AC133+CFU-GM F、CFU-M ix、CFU-GM 集落形成数量比较
3 讨论
长期以来,一直认为CD34膜抗原是HSPC的特征性标志,并用于造血干细胞的分选、扩增和重建造血等研究[11]。AC133是近年来发现的一种新的造血干细胞表面标志,且越来越受到研究者重视[7,8]。M iraglia等的研究表明,AC133是一种5次跨膜糖蛋白,它不同于已知的4次和7次跨膜蛋白,是一种全新的跨膜蛋白,在早期造血调控中起重要作用[8]。最近由Yu等克隆并鉴定了一个新的AC133异构体,命名为C133-2,并证明它是造血干细胞表达的表面特征性标志[12]。AC133抗原主要表达于胎肝、骨髓和血液中CD34+造血干/祖细胞、所有非定向CD34+细胞及大多数定向于粒-单的CD34+细胞中[7];AC133的表达在发育上早于CD34,并可替代CD34膜抗原标记成为分选、扩增和移植造血干/祖细胞的标志分子[13-15]。已有的研究涉及人骨髓、外周血、脐带血AC133+细胞,目前,关于胎盘组织AC133+细胞生物学特性的报道还很不全面、系统。采用AC133膜抗原标志来探索胎盘 AC133+细胞的造血干/祖细胞特性,可以补充该领域资料的欠缺。本实验结果表明,胎盘组织含有丰富的AC133+造血干/祖细胞。
集落形成实验是评价HSPC增殖分化能力的重要指标。近年来有研究表明AC133+细胞形成CFUM ix和高增殖潜能集落形成细胞(HPP-CFC)的能力强于CD34+细胞,AC133+细胞具有更强的增殖潜能,可能比 CD34+细胞更为原始并包含更多的原始HSPC[16]。目前的研究表明,AC133+造血干细胞具有很强的多向分化能力和长期造血重建能力[17,18]。外周血 AC133+CD34+细胞亚群中长期培养起始细胞(LTC-IC)比AC133-CD34+部分高得多[19]。人脐带血 AC133+细胞体外扩增中,AC 133+,AC133+CD34+,CD34+CD38-细胞的CFU-M ix和骨髓高增殖潜能集落形成细胞(HPP-CFC)的扩增倍数高于CD34+细胞,说明AC133是较CD34更为原始的造血干/祖细胞的表面标志,AC133+细胞具有更强的扩增潜力[12]。本研究在采用MACS分选人胎盘AC133+、AC133-细胞组分的基础上,分别对这两个细胞组分进行了各系集落培养,结果显示,胎盘AC133+细胞具有形成 CFU-GM、CFU-M ix、CFU-E的能力,AC133-细胞组分无此能力。这说明胎盘组织中的AC133+细胞组分具有HSPC特性,能够多向增殖并分化为多种造血祖细胞,AC133膜抗原标志可作为胎盘组织HSPC的分选标志。集落形成实验是评价造血干/祖细胞的客观指标之一,但因本实验的样本材料数量上不够大,故尚需作进一步的研究。并且,在全面评价胎盘 AC133+细胞作为 HSPC的一种新的来源之前,还需对其体外扩增能力、黏附分子表达与归巢能力、可塑性和造血重建能力等生物学特性进行研究。
[1]Broxmeyer HE,Dougulas GW,Hangoc G,et al.Human umbilical cord blood as potential source of transplantable hematopoietic stem/progenitor cells[J].Proc Natl Acad Sci USA,1989,(86):3828-3832.
[2]Row ley SD,Sharkis SJ,Hsttenburg C,et al.Culture from human bone marrow of blast progenitor cells w ith an extensive proliferative capacity[J].Blood,1987,(69):804-808.
[3]Fritsch G,Emm inger W,Buchinger P,et al.CD34 positive cell proportions in peripheral blood correlate w ith colonyform ing capacity[J].Exp Hematol,1991,(19):1079-1083.
[4]Takahashid K,Nsito M,Katabuchi H,et al.Development,differentiation,and maturation of macrophage in the chorionic villi of mouse placenta w ith special reference to the origin of Hofbauer cells[J].J Leukocyte Biol,1991,(50):57-68.
[5]周胜利,宋剑秋,旭日.胎盘组织及血液中含有丰富的造血干/祖细胞[J].中国实验血液血杂志,2002,(10):142-147.
[6]陈代雄,方宁,刘祖林,等.人胎盘造血干/祖细胞及淋巴细胞亚群表型的研究[J].中华血液学杂志,2004,(25):175-178.
[7]Yin AH,M irglia S,Zanjani ED,et al.AC133,a novel marker for human hematopoietic stem and progenitor cells[J].Blood,1997,(90):5002-5012.
[8]By Sheri M iraglia,Wayne Godfrey,Amy H.Yin,et al.A novel five-transmembrane hematopoietic stem cell antigen:isolation,characterization,and molecular cloning[J].Blood,1997,(12):5013-5021.
[9]Buhring HJ,Seiffert M,bock TA,et al.expression of novel surface antigens on early hematopoietic cells[J].Ann N Y Acad Sci,1999,(872):25-38.
[10]KobartL,Giarratana MC,Pflum io F,et al.CD133+cell selection is an alternative to CD34+cell selection for ex vivo expansion of hematopoietic stem cells[J].J Hematother Stem Cell Res,2001,(10):273-281.
[11]Nimgaonkar MT,Roscoe RA,Persichetti J,et al.A unique population of CD34+cells in cord blood[J].Stem Cells,1995,(13):158-166.
[12]Yu Y,Flint A,Dvorin El,Bischoff J.AC133-2,a novel isoform of human AC133 stem cell antigen[J].J Biol Chem,2002,(277):20711-20716.
[13]Matsumoto K,Yasui K,Yamashita N,et al.In vitro proliferation potential of AC133 positive cells in peripheral blood[J].Stem Cells,2000,(18):196-203.
[14]Giebel B,Corbeil D,Beckmann J,et al.Segregation of lipid raftmarkersincluding CD133 in polarized human hematopoietic stem and progenitor cells[J].Blood,2004,(104):2332-2338.
[15]KobariL,Giarratana MC,Pflum io F,et al.CD133+cell selection is an alternative to CD34+cell selection for ex vivo expansion of hematopoietic stem cells[J].J Hematother Stem Cell Res,2001,(10):273-281.
[16]郝思国,孙关林,邬维礼,等.人脐血CD34+细胞体外短期培养中生物学特性的变化[J].中国实验血液学杂志,2003,(11):569-575.
[17]Handgretinger R,Gordon PR,Leimig T,et al.Biology and plasticity of CD133+hematopoietic stem cells[J].Ann N Y Acad Sci,2003,(996):141-151.
[18]Koehl U,Zimmermann S,EsserR,Sorensen J,etal.Autologous transplantationofCD133 selected hematopoieticprogenitor cells in a pediatric w ith relapsed luekem ia[J].Bone Marrow Transplant,2002,(29):927-930.
[19]Matsumoto K,Yasui K,Yamashita N,et al.In vitro proliferation potential of AC133 positive cells in peripheral blood[J].Stem Cells,2000,(18):196-203.
