模拟高原训练对大鼠红细胞的影响及小麦肽的干预作用
2013-11-17刘霞唐波金爱娜潘兴昌金其贯蔡木易
刘霞 唐波,2 金爱娜 潘兴昌 金其贯 蔡木易
1 扬州大学体育学院(扬州225009)
2 广东省中山市特殊教育学校 3中国食品发酵工业研究院
高原训练中,机体承受高原缺氧和运动双重刺激,促红细胞生成素(EPO)分泌和红细胞(RBC)生成增加,血液运氧能力和机体有氧运动能力均提高[1]。但Biselli研究认为,在高原训练中,由于缺氧和训练导致产生高浓度毒性羟基,引起红细胞破坏,使游离铁增加[2],表明高原训练显著增加机体氧化应激,损伤能量代谢和细胞膜完整性。因此,采取有效措施减少红细胞氧化损伤对提高高原训练效果有重要作用。小麦肽是以小麦蛋白为原料经过特定微生物发酵或特定蛋白酶水解,分离制得的有多种生物活性的活性肽,具有抗氧化、调节机体免疫力、改善脂质代谢、抗肥胖、抑制胆固醇等作用[3-9]。而在高原训练中补充小麦肽对红细胞影响的研究尚未见报道。本研究通过观察模拟高原环境及补充小麦肽对运动训练大鼠血细胞(Red blood cell,RBC)数量、血红蛋白(hemoglobin,Hb)含量、红细胞压积(hematocrit,Hct),红细胞超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性,血液丙二醛(Malondialdehyde,MDA)、促红细胞生成素(erythropoietin,EPO)含量及油镜下红细胞形态的影响,探讨高原环境和/或小麦肽补充对大鼠红细胞的作用及其机制,为高原训练研究提供理论依据。
1 材料与方法
1.1 实验动物与分组
选用清洁级雄性Sprague-Dawley(SD)大鼠50只,6周龄,体重160~180 g,购于购于浙江省实验动物中心,许可证号Scxk(浙)20080033,质量合格证号0016507。饲养温度(20±2)℃,自然光照,分笼饲养,每笼5只,每天更换一次垫料,保持笼内干燥。随机分成正常对照组(C组,n=10)、高原对照组(HC组,n=10)、常氧训练组(E组,n=10)、高原训练组(HE组,n=10)和高原训练+小麦肽组(HEW组,n=10)。本实验在扬州大学比较医学中心实验室完成。
1.2 模拟高原训练和补充方案
大鼠采用无负重游泳运动,每周6天,每天下午训练,游泳时间从30 min开始,2周内逐渐增加到90 min。游泳池为100 cm×70 cm×60 cm长方体,水深50 cm,水温(32±1)℃。由 The MAG-10 Mountain Air Generator产生低氧条件,从模拟海拔1600 m开始,2周逐渐提高到3000 m,氧浓度为14.2%,正式训练9周。运动时注意观察大鼠状态,防止溺水死亡;及时捞出老鼠粪便,保持游泳池清洁。实验中由于操作不当,E组有2只大鼠溺亡。每次训练后HEW组按500 mg/kg体重剂量灌服新鲜配制的小麦肽溶液,小麦肽由中国食品发酵工业研究院(北京中食海氏生物技术有限公司)提供。
1.3 实验取材
末次训练后,禁食12 h。第二天早晨依次称重,按50 mg/kg剂量腹腔注射2%戊巴比妥钠溶液麻醉大鼠。从腹主动脉取血约10 ml,先采用手工推片法制作血涂片,后将血液分成3份,1份注入血常规试管,2 h内测定血常规;1份加入肝素抗凝管备测红细胞SOD和GSH-Px活性;1份注入真空无菌试管,4℃、3000 r/min离心10 min分离血清,备测血清EPO和MDA含量。
1.4 指标测定
采用UnicelDXC800 Beckman Coulter血液分析仪测试血常规指标。采用ELISA测定血清EPO,试剂盒购于上海朗顿生物科技有限公司,测定仪器为ELX800型酶标仪。采用羟胺法测定红细胞SOD,采用硫代巴比妥酸法(TBA)测定血清MDA,采用比色法测定红细胞GSH-Px,试剂盒购于南京建成生物研究所,测试仪器为722型紫外分光光度计。在血涂片上滴1至2滴瑞氏-姬母萨复合染液A液,5分钟后滴几滴B液覆盖,干燥后在油镜下拍片,连续观察1000个红细胞的形态,计算畸形RBC数。
1.5 统计学分析
使用SPSS17.0统计软件处理数据,结果用均数±标准差(± s)表示。C组、HC组、E组和HE组之间采用双因素方差分析,HE组和HEW组之间采用独立样本t检验,P<0.05表示为显著性差异,P<0.01表示为极显著性差异。
2 结果
2.1 血液RRBBCC数量、HHbb、HHCCTT含量
从表1可见,长期低氧暴露使大鼠RBC数量、Hb和HCT显著升高(P<0.05),运动训练对大鼠RBC数量、Hb和HCT均无显著影响,低氧环境和运动训练对RBC数量、Hb和HCT改变无显著交互作用。与HE组相比,HEW组RBC数量显著增加(P<0.05)。
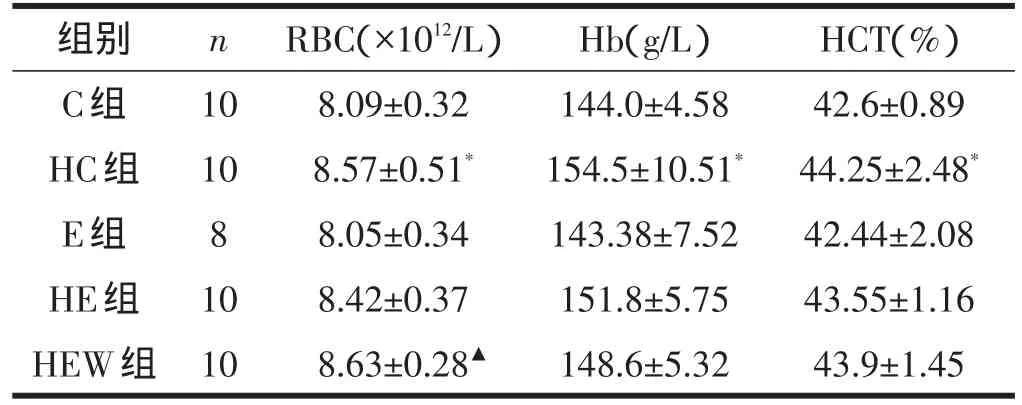
表1 各组大鼠血液RBC数量、Hb、HCT含量比较
2.2 血清EPO含量
由表2可知,长期低氧暴露使大鼠血清EPO含量显著降低(P<0.05),运动训练对血清EPO含量无显著影响,低氧环境和运动训练对血清EPO含量无显著交互作用。与HE组相比,HEW组血清EPO含量显著增加(P<0.05)。
2.3 红细胞畸形率
在油镜下,正常红细胞为轻度双凹盘状,中央部分淡染,表面光滑规整。此外,还可见到以下几种异形红细胞(图1)。(1)碎片红细胞(&),红细胞呈碎片状,无任何规则,大小不一;(2)口型红细胞(*),红细胞外形呈现出口的形状;(3)泪滴状红细胞(*),红细胞外形像泪滴或者是梨形;(4)棘型红细胞(#),红细胞呈盘形,但边缘不规整,呈剌状或棘状突起等。双因素方差分析结果(表3)显示,长期低氧暴露使大鼠血液红细胞畸形率降低,但无显著性差异,运动训练使血液红细胞畸形率显著升高(P<0.05),低氧和运动训练对血液红细胞畸形率升高有显著交互作用(P<0.01)。另外,HEW组血液红细胞畸形率显著低于HE组。
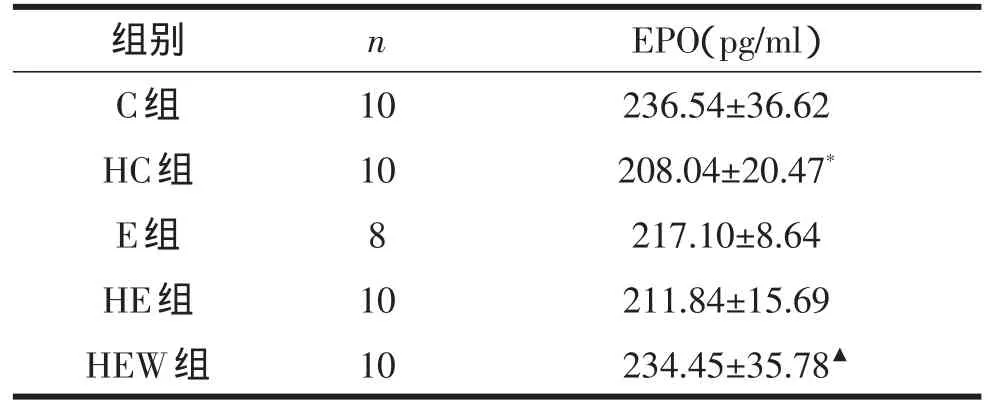
表2 各组大鼠血清EPO含量比较


表3 各组大鼠红细胞畸形率比较
2.4 红细胞SOD、GSH-Px活性及血清MDA含量
从表4可见,长期低氧暴露和运动训练对红细胞SOD、GSH-Px活性和MDA含量无显著影响,而低氧和运动训练对降低红细胞SOD和GSH-Px活性和升高MDA含量有显著交互作用(P<0.05)。与HE组相比,HEW组红细胞SOD活性显著升高(P<0.05),MDA含量显著降低(P<0.01),而GSH-Px活性有所升高,但无统计学意义。
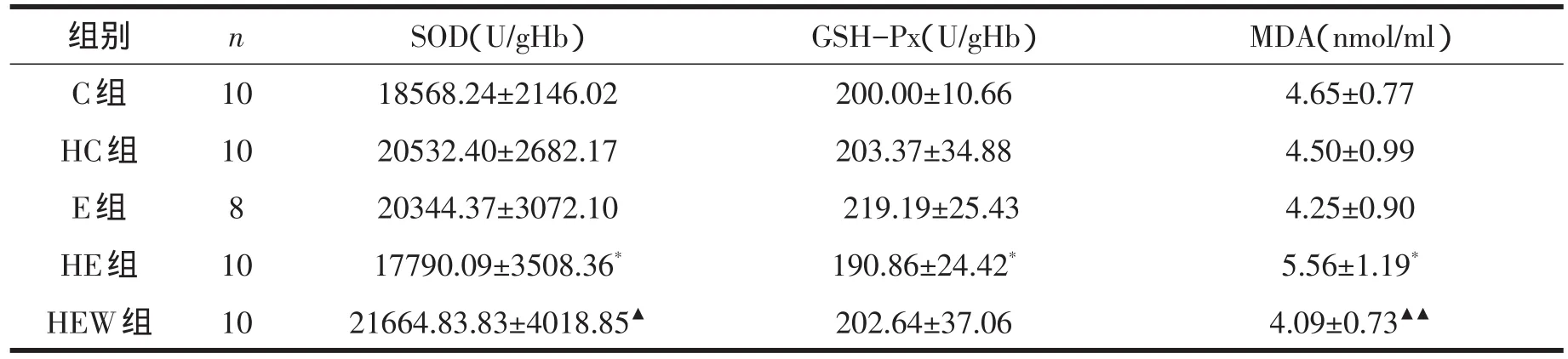
表4 各组大鼠红细胞SOD、GSH-Px活性和血清MDA含量比较
3 讨论
研究证实,不同模式低氧训练,包括传统高原训练能有效增加血液RBC数量和Hb含量[10-13]。而高原训练中,低氧和运动训练两个因素的交互作用不完全清楚。Wolfel等[14]认为,即使非运动员在高原停留3~4周不进行训练,RBC数量也会升高。然而,冯连世等[15]研究发现,与高原安静相比,高原训练更能促进RBC生成。在中等海拔高度训练组RBC较久居高原安静组明显增加,表明缺氧和运动两种刺激分别起作用,红细胞生成促进不仅与缺氧程度有关[15]。本研究采用交互设计方案,通过双因素方差分析,发现长期低氧暴露使大鼠RBC数量、Hb和HCT显著升高,运动训练使大鼠RBC数量、Hb和HCT有所降低,但无显著性差异,而低氧环境和运动对RBC数量、Hb和HCT改变无显著交互作用,表明低氧暴露是促进血液红细胞数量、Hb含量和HCT增加的主要因素。同时,本研究还发现,低氧联合运动训练不仅未引起血液RBC数量、Hb含量和HCT进一步升高,而且与HC组相比,RBC数量、Hb含量和HCT均有降低趋势。在某种程度上可以说明在低氧环境中进行运动训练对低氧促进血液RBC数量增多和Hb含量增加起到一定的抑制作用。
血液RBC数量取决于RBC生成和破坏的平衡。EPO是促进红细胞生成的非常重要的因素之一。但维持高水平EPO并不是RBC持续增加所必需的[16]。研究认为,世居平原运动员到高原训练3~4天后,血清EPO浓度迅速增高,而随着Hb和Hct上升,EPO浓度反而下降[17,18]。因此,低氧环境时引起EPO浓度变化的原因不是缺氧而是氧浓度[19]。本研究发现,长期低氧暴露使大鼠血清EPO含量显著降低,运动训练对血清EPO含量无显著影响,低氧和运动训练对血清EPO含量无显著交互作用。其原因可能是长期低氧使血液RBC数量和Hb含量显著增加,反馈性抑制了EPO分泌,导致血液EPO含量减少。
有研究证实,机体进行大强度运动时,血乳酸增加、氧自由基生成增多,血流加快使红细胞之间及红细胞与血管壁之间的机械摩擦增多,常常引起血液RBC破坏增多,导致运动性贫血[20]。本研究结果发现,长期低氧暴露使大鼠血液红细胞畸形率降低,但无显著性差异,而运动训练使血液红细胞畸形率显著升高,低氧和运动训练对升高血液红细胞畸形率有显著交互作用。这表明长期低氧暴露对血液红细胞畸形率无显著影响,而常氧下运动和高原训练均可明显增加血液红细胞畸形率,导致红细胞破坏增多,引起红细胞数量减少和Hb含量降低。本研究还发现,长期低氧暴露和运动训练使红细胞SOD和GSH-Px活性有增加趋势,MDA含量有降低趋势,但均无显著性差异,而低氧环境和运动训练对降低红细胞SOD和GSH-Px活性和升高MDA含量有显著交互作用,从而说明低氧暴露或常氧运动训练虽然对血液氧自由基代谢无显著影响,但在低氧环境中进行同样负荷的运动训练使机体的氧化应激增强,从而产生大量氧自由基。这与前人的研究结果相同[21-24]。因此,在低氧环境下运动,大鼠机体氧自由基含量升高,SOD和GSHPx活性降低,MDA含量升高,自由基对红细胞膜的破坏增多,同时运动时细胞之间的碰撞和红细胞与血管的冲撞,导致红细胞损伤加重,红细胞畸形率大幅度升高,红细胞数量有限减少,血红蛋白浓度降低。因此,在高原训练过程采取有效措施干预氧自由基生成,维持红细胞正常形态和功能,对提高训练效果有重要意义。
研究表明,小麦肽有很强的抗氧化性,能显著提高组织SOD活性,同时显著降低MDA含量[4-8]。殷微微等[9]推测小麦肽的抗氧化活性可能通过以下途径起作用:(1)作用于脂质过氧化物,打断其恶性循环连锁反应,抑制膜结构上不饱和脂肪酸的过氧化;(2)酶解物中活性肽或游离氨基酸通过复杂的代谢途径,激活内源性SOD和GSH-Px,并提高其活性[9]。本研究让大鼠在模拟海拔3000 m的低氧舱中进行9周运动训练,每天定时补充小麦肽。结果发现,与HE组相比,HEW组RBC数量、血清EPO含量显著增加,血液红细胞畸形率显著降低。同时,HEW组红细胞SOD活性显著升高,MDA含量显著降低,而GSH-Px活性有升高趋势,但无显著性差异。这表明高原训练时补充小麦肽一方面提高EPO分泌,促进RBC生成,另一方面显著抑制氧自由基生成,对减轻RBC过氧化损伤,维持其正常形态结构和功能有重要作用。
4 总结
4.1 高原训练提高大鼠RBC数量、Hb含量和HCT,低氧因素起决定性作用。
4.2 在低氧环境中进行运动训练使红细胞抗氧化作用降低,氧自由基生成增加,导致红细胞畸形率显著增多,影响高原训练效果。
4.3 小麦肽显著抑制高原训练大鼠氧自由基生成,对减轻高原训练大鼠RBC过氧化损伤,维持RBC正常形态结构和功能有重要作用。
[1]Saunders PU,Pyne DB,Gore CJ.Endurance training at altitude.High Alt Med Biol,2009,10(2):135-148.
[2]Biselli R,Pecci G,Oliva C,et al.Effects of hypobaric hypoxia(HH) on polymorphonuclear granulocytes(PMNL)respiratory activity in HH-acclimatized and non-acclimatized rats.Int J Sports Med,1992,13:94.
[3]王岁楼,祝红蕾,张栋.小麦蛋白酶解制备活性多肽的研究.生物工程(食品科学),2008,29(9):388-392.
[4]柳小军,刘国琴,李琳.小麦源生物活性肽研究进展及其应用.农产品加工学刊,2009,(3):81-84,96.
[5]陈英,朱科学,彭伟,等.小麦胚活性肽对D-半乳糖衰老模型小鼠抗氧化作用研究.食品科学,2010,31(19):325-328.
[6]陈英,朱科学,彭伟,等.小麦胚活性肽体外抗氧化活性研究.中国油脂,2010,35(12):16-19.
[7]代卉,施用晖,韩芳,等.小麦肽免疫活性及抗氧化作用的研究.天然产物研究与开发,2009,(21):473-476.
[8]代卉,乐国伟,孙进,等.小麦肽对受环磷酰胺免疫抑制小鼠的免疫调节及抗氧化功能.生物工程学报,2009,25(4):549-553.
[9]殷微微,任学坤,郝为民,等.小麦胚芽蛋白酶解物体内抗氧化性评价.粮食与油脂,2011,(5):23-25.
[10]张缨,胡扬.不同氧浓度的高住高练低训对红细胞等血象指标的影响.体育科学,2005,25(11):29-32.
[11]Heinicke K,Heinicke I,Schmidt W,et al.A three-week traditional altitude training increases hemoglobin mass and red cell volume in elite biathlon athletes.Int J Sports Med,2005,26(5):350-355.
[12]Saunders PU,Telford RD,Pyne DB,et al.Improved running economy and increased hemoglobin mass in elite runners after extended moderate altitude exposure.J Sci Med Sport,2009,12(1):67-72.
[13]Friedmann B,Frese F,Menold E,et al.Individual variation in the erythropoietic response to altitude training in elite junior swimmers.Br J Sports Med,2005,39(3):148-153.
[14]Wolfel EE,Groves BM,Brooks GA,et al.Oxygen transport during steady-state submaximal exercise in chronic hypoxia.J Appl Physiol,1991,70(3):1129-1136.
[15]冯连世,宗丕芳,李福田,等.高原训练对中长跑运动员红细胞生成的作用.体育科学,1998,18(4):78-81.
[16]Berglund B.High-attitude training.Aspects of hematological adaptation.Sport Med,1992,14(5):289-303.
[17]Son HJ,Kim HJ,Kim JH,et al.Erythropoietin,2,3 DPG,oxygen transport capacity,and altitude training in adolescent Alpine skiers.Aviat Space Environ Med,2012,83(1):50-53.
[18]Garvican L,Martin D,Quod M,et al.Time course of the hemoglobin mass response to natural altitude training in elite endurance cyclists.Scand J Med Sci Sports,2012,22(1):95-103.
[19]赵鹏,路瑛丽,冯连世,等.低氧训练对大鼠EPO/EPOR及其表达的影响.山东大学学报,2009,47(5):5-13.
[20]黄园.运动性红细胞损伤机理的研究——氧化应激与红细胞老化.北京体育大学博士学位论文,2001:27-50.
[21]Zhou J,Zhou S,Gao Y,et al.Modulatory effects of quercetin on hypobaric hypoxic rats.Eur J Pharmacol,2012,674(2-3):450-454.
[22]李海英,赵娟,佟长青.低氧及复合运动对大鼠血清超氧化物歧化酶活性及丙二醛含量的影响.现代中西医结合杂志,2008,17(15):2284-2285.
[23]鲁政,胡扬,田野,等.低氧运动对血清MDA、SOD、GSH的影响及电解质饮料干预效果的研究.北京体育大学学报,2007,30(2):198-202.
[24]张爱芳,田野,胡杨,等.间歇性低氧暴露对足球运动员自由基代谢的影响.中国运动医学杂志,2006,25(1):84-86.
