依达拉奉对6-OHDA诱导的帕金森病大鼠黑质纹状体MDA、NO含量的影响
2013-11-17吴二兵张元媛施建生高志伟
吴二兵, 陈 鑫, 张元媛, 施建生, 高志伟
氧化应激在PD的发病机制中占有十分重要的地位,很多环节最后都通过氧化应激这一共同通路起作用,因此,针对PD抗氧化治疗的研究越来越多[1,2]。本研究探讨依达拉奉对6-羟基多巴(6-OHDA)诱导的帕金森病大鼠模型黑质纹状体系统丙二醛(MDA)、一氧化氮(NO)含量的影响和神经元保护作用。
1 材料和方法
1.1 实验动物 成年健康雄性SD大鼠,体重250~300g,由南通大学实验动物中心提供。标准环境饲养。
1.2 主要试剂和药品 6-OHDA、抗坏血酸、阿朴吗啡(apomophine,APO)、抗TH抗体、戊巴比妥钠、DAB(Sigma公司,美国),SABC试剂盒(北京中杉金桥生物技术有限公司),依达拉奉(Edaravone,ED,必存)(南京先声东元制药有限公司),MDA试剂盒(南京建成科技有限公司)NO试剂盒(南京建成科技有限公司)。
1.3 主要仪器 MICRO4型动物脑立体定位仪(WPI公司,美国),5μl微量进样器(上海光正医疗仪器有限公司),EL303电子天平(梅特勒-托利多仪器(上海)有限公司),CM1900冰冻切片机(LAICA,德国),BX50WI倒置显微镜(Olympus公司,日本)。
1.4 动物分组 将实验动物分为神经生化学和组织学两组,各组分为:(1)正常对照组(n=6);(2)NS对照组(n=6);(3)依达拉奉组(n=24),依达拉奉又分为0.3mg/kg 14d 组(n=6),1mg/kg 14d 组(n=6),3mg/kg 14d组(n=6)及3mg/kg 28d组(n=6)4个亚组。
1.5 模型的制备 模型组大鼠用复合麻醉剂(0.25ml/100g体重)腹腔注射麻醉,待大鼠后肢回缩反射及角膜反射消失后,将其头部水平位固定在脑立体定位仪上(美国WPI公司),剪除颅顶鼠毛,碘酒、酒精消毒皮肤,沿中线切开一长约2cm切口,充分暴露前囟,参照Paxinos and Watson(1996)《大鼠脑立体定位图谱》确定左侧前脑内侧束(MFB)三维坐标位置,选取mfb区坐标:前囟后2.8mm,中线左侧2.0mm,硬膜下8.2mm。根据注射位点确定钻颅部位,手术刀尖小心钻开一直径约2mm颅骨孔,微量进样器缓慢进针至靶点,留针10min,以9ng/s的速度注入2μg/μl 6-OHDA 4μl(含0.02%抗坏血酸),注射完毕后留针 10min,以1mm/min的速度退针。手术完毕,用明胶海绵堵塞颅骨孔,适量青霉素涂敷创口,消毒缝合皮肤,放回笼中饲养。并于2w、4w后分别检测大鼠行为学和组织学的改变。假手术组同法予含0.02%抗坏血酸的生理盐水4μl,正常组不作任何处理。正常对照组不进行任何处理,其余5组均在大鼠MFB注射6-OHDA,方法同第一部分,术后30min即分别腹腔注射NS 1ml、依达拉奉0.3mg/kg、1mg/kg、3mg/kg,每天两次,连续应用 14d,其中3mg/kg 28d组大鼠在最末一次用药后继续饲养至术后28d。
1.6 旋转试验 实验大鼠在最后一次用药后,腹腔注射AP0诱发旋转行为。APO诱导旋转试验:模型组分别于术后2w、4w于动物腹腔内注射APO 0.5mg/kg诱发大鼠以健侧后肢为支点,向右侧(健侧)旋转,于APO注射后5min开始记录,共记录30min。以2w、4w诱发旋转次数大于210次/30min为合格模型。
1.7 组织学方法 各组大鼠在行为学检测后,用复合麻醉剂将大鼠深度麻醉,快速灌注生理盐水(37℃)150~200ml冲洗。随即灌注4%甲醛(4℃)先快速灌注200ml,再缓慢灌注300ml。然后断头取脑,置于4%甲醛,放4℃冰箱固定4h,再依次置入20%及30%蔗糖磷酸盐缓冲液内4℃冰箱至脑块沉入瓶底。取纹状体及中脑组织块进行冠状连续冰冻切片,片厚20μm。切片作尼氏体染色;高倍镜下计数各组标本两侧黑质致密部(SNc)的尼氏体阳性细胞数,取每组黑质区的冠状切片各10张,每张切片连续计数3个互不重叠高倍视野内阳性细胞数,求其平均值。
1.8 神经生化学检测 实验大鼠在最后一次用药后次日,快速断头,迅速取出大脑,在冰台上分离出纹状体和中脑黑质,用4℃生理盐水冲洗除去血液,在干冰上用滤纸拭干,立即置于-80℃超低温冰箱。待样本收齐后,称重并用眼科小剪剪碎组织块,置于冰浴的玻璃匀浆器中充分匀浆,按照试剂盒操作要求,用酶标仪检测各组大鼠两侧纹状体和黑质部MDA、NO活性的变化。
1.9 统计学处理 数据资料表达采用χ±s表示。用SPSS13.0统计软件处理,两组间比较采用独立样本t检验,多组间比较采用方差分析,P<0.05表示差别有统计学意义。
2 结果
2.1 依达拉奉对大鼠旋转行为的影响 除空白对照组APO未诱发出旋转外,其余各组均出现向健侧旋转(>210次/min),统计学差异显著(P<0.01);ED 3mg/kg 14d、28d 组较 NS、ED 0.3mg/kg 和 ED 1mg/kg组旋转次数减少,差异有统计学意义(P<0.05);ED 3mg/kg组大鼠14d后出现随意爬行行为,NS、ED 0.3mg/kg和ED 1mg/kg组无此行为改变(见表1)。
2.2 依达拉奉对大鼠黑质内尼氏体细胞数的影响 高倍镜下可见NS和ED组大鼠左侧Cpu(尾状核)和SNc(黑质纹状体致密部)神经细胞均有不同程度的损伤,NS和ED组左侧SNc尼氏体阳性细胞较对照组减少(P<0.05),NS和ED组左侧SNc尼氏体阳性细胞比右侧减少(P<0.05);ED 3mg/kg 14d、28d组左侧 SNc尼氏体阳性细胞较 NS、ED 0.3mg/kg和ED1mg/kg组增加,差异有统计学意义(P <0.05),14d、28d两组间结果无统计学差异(见表2、图1)。
2.3 依达拉奉对NO含量的影响 ED3mg/kg组黑质纹状体NO含量较NS、ED0.3mg/kg和ED1mg/kg组减少(P<0.05),ED3mg/kg 14d组与28d组间比较无统计学差异(见表3)。
2.4 依达拉奉对MDA含量的影响 ED 3mg/kg组黑质纹状体MDA含量较NS、ED 0.3mg/kg和ED 1mg/kg组减少(P <0.05),ED 3mg/kg 14d组与28d组间比较无统计学差异(见表4)。
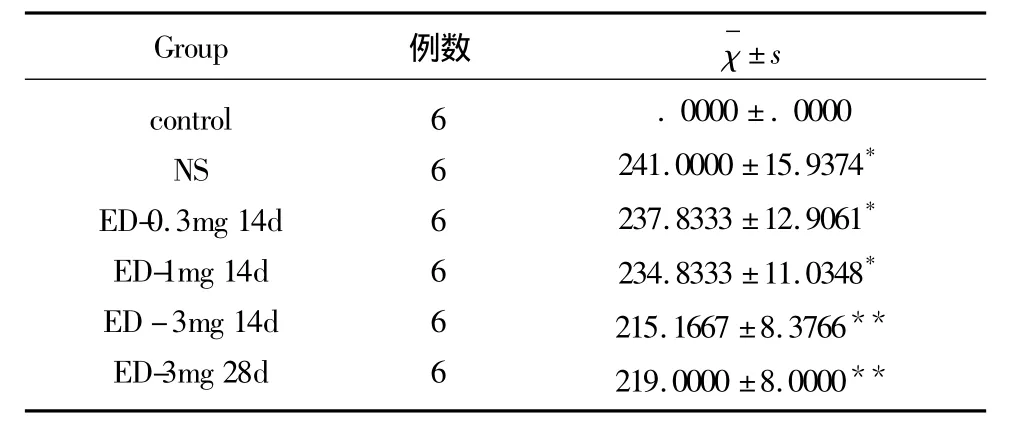
表1 依达拉奉对大鼠旋转行为的影响(次/30min)(χ±s)

表2 依达拉奉对大鼠黑质内尼氏体细胞数的影响(个/高倍视野)(χ±s)

表3 依达拉奉对大鼠左侧黑质纹状体NO含量的影响(μmol/gprot)(χ±s)

表4 依达拉奉对大鼠左侧黑质纹状体MDA含量的影响(nmol/mgprot)(χ±s)
3 讨论
氧化应激是由于过多的氧自由基和过氧化合物超过了机体自身的抗氧化能力,引起细胞膜脂质过氧化链式反应和膜的流动性改变而破坏细胞的过程。任何进行需氧代谢的细胞都处于氧化应激状态中,随着机体的老龄化,抗氧化能力不断下降,最终导致机体重要结构和功能分子的氧化损伤。多巴胺(DA)神经元胞质内的DA可被单胺氧化酶B(MAO-B)所降解,生成H2O2、醌、半醌和氨,在正常黑质高水平铁存在的条件下,H2O2通过Fenton反应产生毒性更强的羟自由基,影响多种细胞内成分(如酶、转运体、蛋白、脂肪酸及DNA等)的功能,攻击生物膜中的不饱和脂肪酸,引起脂质过氧化反应,从而导致细胞器裂解、DA神经元死亡。DA自氧化产生的高活性分子,作用于细胞成分后被吸收或形成更多的ROS,形成恶性循环。
应用左旋多巴仍是治疗PD最重要的方法之一,但其仅仅是对症治疗,不能从根本上防治PD及延缓病情的进展,长期用药后疗效减退,可出现运动波动、异动症和精神症状。因此,新的治疗策略提出神经保护治疗,以减缓甚至阻止神经元变性的进展。依达拉奉的主要成分为3-甲基-1-苯基-2-吡唑啉-5-酮,通过转移一个电子给自由基而产生MCI-186基团从而打断脂质过氧化反应链来保护神经细胞;也能防止由花生四烯酸的代谢中间体脂质过氧化物15-HPETE引起的氧化性细胞损害,抑制神经元死亡;还能防止血管内皮细胞损伤,保护线粒体功能,发挥有益的抗自由基损伤作用[3]。依达拉奉具有亲脂基团,其血脑屏障穿透率约为60%,静脉给药之后可以清除大脑内的具有高度细胞毒性的羟自由基,抑制脑细胞血管内皮细胞和神经细胞的过氧化作用,减少缺血半暗带发展成梗死的体积,延迟神经细胞死亡,减轻脑缺血以及脑缺血引起的脑水肿和组织损伤。
吴冠会等[4]用γ放射性计数仪测定6-OHDA诱导的PD大鼠双侧纹状体、大脑皮质、小脑多巴胺转运体(dopamine transporter,DAT)的含量,结果显示,大剂量依达拉奉腹腔注射能阻止损伤侧的DAT放射性计数的减少,与对照组相比差异有显著性(P<0.05),提示依达拉奉能增强组织的抗氧化能力。
本研究除空白对照组APO未诱发出旋转外,其余各组均出现向健侧旋转(>210次/min),统计学差异显著(P <0.01);ED 3mg/kg 14d、28d 组较 NS、ED0.3mg/kg和ED1mg/kg组旋转次数减少,差异有统计学意义(P<0.05)。依达拉奉(3mg/kg)能够减少APO诱发的旋转次数,且对大鼠自发的行为变化也有改善作用。实验发现,3mg/kg组大鼠在治疗14d时虽然动作缓慢,但能随意爬行,其他治疗组大鼠无此改变,仍向损伤侧自发缓慢旋转或少动,对此目前国内外尚未见报道。这一结果可能与依达拉奉阻止了自由基对DA神经元的损伤,减少DA的丢失,从而延缓或阻止病情的进一步发展,提示依达拉奉可改善6-OHDA诱导的PD大鼠行为学变化。
一氧化氮(NO)是一种重要的生物信使分子,在中枢神经系统(CNS)中参与调节一系列生理过程,如神经突触的发生以及脑血流量的调节等。但过量的NO则表现出神经毒性作用,介导神经变性的病理过程。
(iNOS)[5]编码 NOS 的基因(NOS1,NOS2A,and NOS3)可能会引起NO过剩,从而促成PD的神经元变性发生。Carbone 等[6]研究发现,低浓度的1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)、肿瘤坏死因子(TNF-α)和干扰素(INF-γ)能激活初原星型胶质细胞,选择性诱导NOS1 mRNA及其蛋白,增加NO的生成,并显著提高球蛋白的硝基化。Hancok等[7]研究认为,NOS1和NOS2A可作为PD的基因危险因子,并可与已知的环境因子相互作用而调制环境效应。MPTP可使酪氨酸羟化酶硝基化而失活,导致神经元中DA水平下降。研究发现[8],与野生鼠相比,nNOS基因敲除的小鼠对MPTP的毒性有抵抗力,提示NO可能使DA能神经元易损性增加。NO主要通过过氧化亚硝基阴离子(ONOO-)发挥神经毒性作用,NO与超氧阴离子(O2
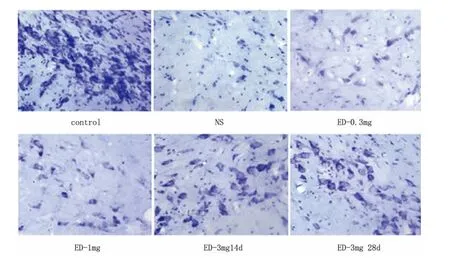
图1 依达拉奉对各组大鼠左侧黑质NISSL小体的影响(×400)
-)相互作用形成ONOO-,后者是一种极其活跃的强氧化剂,它不仅自身有细胞损伤作用,还可与H+形成ONOOH,并迅速分解成许多毒性代谢产物如·OH、NO2-和NO3-等,而毒性更强的·OH则进一步对细胞产生损伤作用。此外,NO还可通过抑制线粒体呼吸链的功能和介导谷氨酸兴奋性毒性作用而使神经细胞损伤。
6-OHDA损伤大鼠黑质纹状体后,可多种氧化应激产物形成,如MDA、NO等,它们可进一步对神经细胞发挥损伤作用。MDA是生物膜中的多不饱和脂肪酸受到氧自由基攻击后,形成的一种脂质过氧化物。在PD中,随谷光甘肽(GSH)含量下降,神经元清除自由基能力降低,引起黑质脂质过氧化增强,其产物MDA增加,同时游离铁又参与DA的自身氧化应激反应,导致自由基增多,从而损伤黑质神经元。NO是一种重要的生物信使分子,参与调节一系列生理过程。
本实验结果显示,6-OHDA导致MDA、NO含量增加(P<0.05),依达拉奉3mg/kg可阻止此增加,而依达拉奉0.3mg/kg和1mg/kg对此变化影响不显著,表明依达拉奉对PD大鼠的保护作用呈剂量依赖性,这种作用主要可能与其抑制自由基的活性有关。为观察依达拉奉对DA神经元的远期保护作用,本实验检测了依达拉奉停药后14d大鼠行为学、形态学及神经生化方面的改变,结果发现,此时其对6-OHDA导致的黑质纹状体损伤的保护作用与治疗4d时效果相当,说明依达拉奉对神经元损伤后较远期仍有保护作用。本实验结果显示,依达拉奉(3mg/kg)阻止了6-OHDA损伤后黑质尼氏体阳性细胞减少,表明依达拉奉可能通过抑制自由基的损伤对6-OHDA损伤后黑质的神经细胞产生保护作用,且呈剂量依赖性。
虽然目前PD的确切发病机制尚不清楚,但氧化应激机制参与了6-OHDA导致的大鼠黑质纹状体的损伤。本实验结果显示,大剂量的依达拉奉通过减少6-OHDA大鼠黑质和纹状体中MDA、NO含量而对神经元起保护作用,目前国内外尚未见类似报道。
[1]Stack EC,Ferro JL,Kim J,et al.Therapeutic attenuation of mitochondrial dysfunction and oxidative stressin neurotoxin models of Parkinson’s disease[J].Biochimica et Biophysica Acta,2008,1782:151-162.
[2]Younes MS,Frih AM,Kerkeni A,et al.Peripheral blood markers of oxidative stress in Parkinson’s disease[J].Eur Neurol,2007,58(2):78-83.
[3]The Edaravone acute brain infarction study group.Effects of a novel free radical,Edaravone(MCI-186),on acute brain infarction randomized,placebo-controlled,doubled-blind study at multicenters the Edravone[J].Cerebralvasc Dis,2003,15(3):222-229.
[4]吴冠会,包仕尧,罗蔚峰,等.依达拉奉对帕金森病大鼠多巴胺转运体保护作用的研究[J].临床神经病学杂志,2006,19(4):296-298.
[5]Bredt DS,Snyder SH.Nitric oxide,a physiological messenge rmolecule[J].Annu Rev Bi-ochem,1994,63:175-195.
[6]Carbone DL,Moreno JA,Tjalkens RB.Nuclear factor kappa-B mediates selective induction of neuronal nitric oxide synthase in astrocytes during low-level inflammatory stimulation with MPTP[J].Brain Res,2008,27:1-9.
[7]Hancock DB,Martin ER,Vance JM,et al.Nitric oxide synthase genes and their interactions with environmental factors in Parkinson’s disease[J].Neurogenetics,2008,9(4):249-262.
[8]Matthews RT,Beal MF,Fallon J,et al.Mpp+induced substantial nigra degeneration is attenuated in nNOSknock-out mouse[J].Neurobiol Dis,1997,4(2):114-121.
