经导管主动脉瓣置入术后管理和常见并发症分析——早期单中心经验
2013-11-16牛红霞吴永健滕思勇裴汉军张海涛许海燕钱杰阎秀英于欣吕滨王浩杨跃进高润霖
牛红霞,吴永健,滕思勇,裴汉军,张海涛,许海燕,钱杰,阎秀英,于欣,吕滨,王浩,杨跃进,高润霖
退行性主动脉瓣狭窄是成人最常见的获得性瓣膜性心脏病,75岁以上患者发生率接近5%,死亡率高[1]。外科瓣膜置换预后好且显著改善生活质量[2],然而,近30%的患者因高龄、心功能差或合并症等原因不适合开胸手术[3]。作为一种替代性新型治疗手段,经导管主动脉瓣置入术(Transcatheter aortic valve implantation,TAVI)改善症状、提高存活率的疗效已被PARTNER等研究证实,成为部分主动脉瓣狭窄患者的有效治疗手段之一[4-7]。然而,TAVI手术操作复杂,且患者多系高龄、合并症多、储备功能差,手术风险大、并发症和死亡率较高。国内介入主动脉瓣置入开展尚在起步阶段,数据较少,尤其术后管理鲜少论及。本文就近一年本院施行TAVI的患者的术后管理和常见并发症进行汇总。
1 资料与方法
研究连续入选了2012-03至2013-03期间12例行TAVI的主动脉瓣狭窄患者,男性7例,女性5例,平均年龄(77.9±6.2)岁。手术入选标准:①症状性的退行性重度主动脉瓣狭窄,有效瓣口面积<0.8 cm2,平均跨瓣压差 >40 mm Hg;② NYHA 心功能分级≥Ⅱ级;③包括主动脉磁化、慢性阻塞性肺病、肺动脉高压、肾功能不全、心功能低下、既往胸部放疗史、严重胸廓畸形等外科禁忌证。排除标准:①经食管超声心动图证实的主动脉瓣环内径<18 mm或>25 mm;②急性心肌梗死<14天;③无保护左主干狭窄>70%;④急性感染;⑤预期寿命<12月;⑥梗阻性肥厚型心肌病;⑦血流动力学不稳定等。
患者的选择由内外科医生团队共同认定,明确存在外科瓣膜置换禁忌证、具有TAVI指征。所有患者优化药物治疗积极改善心功能,完善超声心动图、X线电子计算机断层摄影术(CT)等检查,签署知情同意书后施行介入治疗。术前应用抗生素预防感染[8],操作在杂交手术间进行,外科后备。术中根据外周动脉情况酌情局麻经股动脉或全麻经升主动脉途径实施瓣膜置入。术毕注射鱼精蛋白中和肝素。经股动脉途径者术毕至内科病房,设置专门重症监护房间、由固定医护小组管理。全麻经升主动脉途径者术毕至外科术后恢复室,拔出气管插管后转至内科继续治疗。术后根据心功能、血压等酌情补充血容量,谨慎应用利尿剂。常规予抗生素预防感染、质子泵抑制剂预防应激性消化道出血,必要时静脉营养、补充肠道益生菌等支持治疗。严密监测临床症状体征,动态观察各脏器功能指标变化。观察终点包括全因死亡、血管并发症(血肿、夹层、动静脉瘘)、大出血(血红蛋白水平较术前下降>25%)、急性肾功能损害(血肌酐水平较术前升高>50%)、心脏传导异常(房室传导阻滞、束支阻滞)和脑缺血事件(短暂脑缺血发作或卒中)等。
统计学处理 所有数据采用SPSS 17.0软件进行统计分析。连续变量以均数±标准差表示,应用配对t检验进行统计学分析。分类变量以百分比表示。P<0.05定义为差异有统计学意义。
2 结果
12例患者入选此研究,男性7例,女性5例,年龄65~87岁,平均年龄(77.9±6.2)岁。术前左心室射血分数平均为(62.3±11.9)%,平均跨瓣压差(56.6±11.9)mmHg,最大跨瓣压差(97. 8±19.1)mmHg。12例患者均成功置入主动脉瓣,经股动脉途径者9例,3例患者因动脉迂曲狭窄等原因改为全麻经升主动脉途径。术后平均左心室射血分数为(63.3±5.4)%(P=0.71),平均跨瓣压差下降至(14.3±7.2) mmHg(P<0.001),最大跨瓣压差下降至(24.5±10.5) mmHg(P<0.001)。术后瓣膜返流多为轻中度,较术前无返流程度加重。
住院期间无死亡事件,无血管夹层/血肿等穿刺并发症。术后常见并发症包括4例大出血(33.3%)、2例急性肾功能损害(16.7%)、6例新发心脏传导异常(50.0%)、4例脑缺血症状(33.3%)。术后新发并发症及处理详述如下:
病例1:①手术次日一过性神志淡漠,头颅CT(-),观察后好转;②急性肾功能损害,血肌酐水平较术前升高 55.7%(82 μmol/L vs. 128 μmol/L),给予水化治疗后好转。
病例2:①新发完全性左束支传导阻滞,因极度消瘦(体重指数仅为16.02 kg/m2)、贫血等原因未置入起搏器,严密观察,无黑朦、晕厥;②血红蛋白水平由术前90 g/L最低降至70 g/L,血肌酐水平由术前 336 μmol/L 升至 493 μmol/L,加强营养支持、水化治疗后好转,建议密切随诊必要时透析治疗。
病例3:①嗜睡、谵妄,CT除外新发脑梗死或出血,对症治疗后好转;②粪肠球菌+绿脓杆菌肺部感染,抗感染、化痰、解痉等治疗;③进食差、口腔黏膜出血、便潜血间断阳性,给予抑酸、保护胃黏膜治疗;④尿潴留、肉眼血尿、急性肾功能不全,血肌酐水平较术前升高81.4% [81 μmol/L (术前)vs 166 μmol/L(术后第3天)];给予导尿、膀胱冲洗以预防泌尿系感染、水化治疗后好转;⑤手术次日血红蛋白水平由术前113 g/L降至70 g/L,输悬浮红细胞支持后再次下降,输血支持。血小板进行性下降,由术前117×109/L下降至27×109/L,考虑肝素诱导的血小板减少,给予丙种球蛋白等治疗后缓慢回升至正常;⑥阵发性心房颤动,经药物治疗转复为窦律。
病例4:术后24小时内新发完全性左束支传导阻滞合并Ⅰ°房室传导阻滞,置入永久起搏器。
病例5:术后22小时新发完全性左束支传导阻滞,置入永久起搏器。
病例6:①肺部感染,升级抗生素至三代头孢菌素+糖肽类抗生素抗感染后好转;②血红蛋白水平下降(术前90 g/L、术后次日69 g/L),输血支持;③躁动、谵妄,CT示陈旧脑梗死,镇静治疗后好转。
病例7:术后24小时内表现为Ⅰ°房室传导阻滞和Ⅱ°Ⅰ型房室传导阻滞,术后70小时出现间歇左束支传导阻滞,术后第5天进展为高度房室传导阻滞,观察3天后未恢复而置入永久起搏器。
病例8、病例9、病例10:顺利。
病例11:术后24小时内出现Ⅰ°房室传导阻滞合并间歇性完全性左束支传导阻滞、间歇性右束支传导阻滞,置入永久起搏器。
病例12:①血红蛋白水平由术前123 g/L降至术后87 g/L,输注红细胞4 U后好转;②术后6天,患者出现谵妄,CT显示右侧基底节区腔隙性梗塞,给与对症镇静治疗;③术中Ⅲ°房室传导阻滞给予临时起搏,后过渡至永久起搏器。
术后血红蛋白水平下降多在手术第二天达高峰,平均下降幅度为23.6%(最小12.8%,最大38.1%),见图1。4例患者的血红蛋白水平下降>25%,大出血发生率为33. 3%(4/12)。其中,1例是基线状态下慢性肾功能不全合并中度贫血患者,3例是全麻经升主动脉途径进行瓣膜置入者,后3例患者均输注了悬浮红细胞2~4 U。血小板下降多在术后第2~3天达峰,平均下降幅度达45.4%(最小16.1%,最大76.9%)。其中1例患者出现血小板进行性下降并出血,可疑微栓塞而诊断肝素诱导的血小板减少症。血肌酐升高在术后1~2天达峰,较术前平均升高31.3%,最大升幅81.4%(图2)。其中16.7%(2/12)患者发生急性肾功能损害,表现为血肌酐水平较术前升高>50%。

图1 经导管主动脉瓣置入术后血红蛋白水平变化趋势
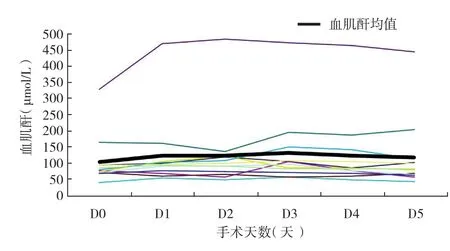
图2 经导管主动脉瓣置入术后血肌酐变化趋势
术后7例(7/12,58.3%)患者出现心律失常, 包括1例(1/12,8%)阵发性心房颤动和6例(6/12,50.0%)传导异常,传导异常多发生在术中和术后24小时内,6例传导异常患者中,除1例新发完全性左束支阻滞密切观察外,5例(5/12,41.7%)患者植入起搏器,分别为:1例Ⅲ°房室传导阻滞(发生在术中)、1例高度房室传导阻滞并间歇完全性左束支传导阻滞(发生在术后第5天)、1例Ⅰ°房室传导阻滞+间歇完全性左束支传导阻滞+间歇右束支传导阻滞(发生在术后24小时内)、1例Ⅰ°房室传导阻滞并新发完全性左束支传导阻滞(发生在术后24小时内)、1例术后新发完全性左束支传导阻滞(发生在术后24小时内)。4例(33.3%)患者在术后出现谵妄、躁动、神志淡漠等神经系统症状,对症治疗后好转。
3 讨论
TAVI适用于高龄、心功能低下、合并多脏器功能不全等外科禁忌证而不能施行常规外科瓣膜置换手术的主动脉瓣狭窄患者。该项技术的疗效已被认可,但其安全性备受关注。目前我国的TAVI技术处于起步阶段,术后管理尤其需要重视。本研究纳入施行TAVI治疗的12例患者,发现瓣膜置换术后平均跨瓣压差由56.6 mmHg显著下降至14.3 mmHg,未出现新发瓣膜反流或反流程度加重,疗效与既往研究一致[5-7]。经过术后常见并发症的分析,提示TAVI术后出血、心脏传导异常、脑血管事件、感染等发生率较高,需要加强防治工作。
出血:出血是TAVI术后最常见并发症。既往研究显示,TAVI出血发生率为 22.8%~77.0%[9,10]。本研究亦证实介入术后出现显著的血红蛋白水平下降,大出血发生率达33.3%。出血的原因考虑与术中操作相关失血、术后补液稀释、不显性失血有关。目前何时输血、血红蛋白的参考值无统一标准,需综合考虑。本中心在研究后期常规于手术结束时应用鱼精蛋白中和肝素可能是后期患者出血较少的原因之一。
急性肾功能损害:行TAVI手术的患者多为高龄,长期的外周缺血缺氧以及肾动脉硬化常常已导致肾功能损害或处于临界状态。此外,术中需应用较大剂量的造影剂、一过性的肾缺血缺氧、有效循环血量不足等原因都可导致肾功能恶化。本研究结果中血肌酐升高≥50%的发生率为16.7%。研究显示,26%的患者术后可出现急性肾功能损害(血肌酐绝对值升高≥26.4 μmol/L或者升高百分比≥50%),而且急性肾功能损害是TAVI术后近期和远期死亡的预测因子[11-13]。因此,除了围术期必要时水化、术中减少造影剂的应用外,术后还需严密监测血压和尿量,保证肾脏灌注,避免应用肾损害药物,保证水电酸碱平衡。
心律失常:由于瓣膜支架在扩张和置入过程中会压迫传导束区域心肌,造成局部水肿、缺血乃至坏死,从而表现为TAVI围术期新发各种传导异常,尤其是束支传导阻滞、房室传导阻滞,严重者需植入永久起搏器。各研究报道的因新发传导异常需植入起搏器的发生率不一,约为4%~36%[9],这可能与各中心所应用的瓣膜类型、起搏器植入指征存在差异有关。
本研究中符合传统起搏适应证的患者有3例(3/12,25%),包括2例房室传导阻滞和1例间歇双束支传导阻滞,出现在术中至术后第5天不等。这提示由于房室传导阻滞出现时间不定,应至少在术后3~5天内进行持续的心电监测。此外,持续的新发完全性左束支传导阻滞是常见的TAVI术后新发心律失常,其发生率为20%~55%不等[14-15]。其长期的预后意义尚不明确,或不增加1年全因死亡、心源性死亡率[16]。本组患者中有2例患者因术后完全性左束支传导阻滞置入永久起搏器,系从保障患者安全角度出发,可能人为提高了起搏器植入率。尚待开展新发完全性左束支传导阻滞的预后意义评估,以明确是否需要植入起搏器。
脑血管事件:实施TAVI的患者通常为高龄,主动脉粥样硬化/钙化发生率高,术中需应用更复杂的导丝和导管,因此更容易因斑块破裂和/或钙化瓣叶碎片脱落导致临床典型的和/或无症状性的脑栓塞[17-18]。报道显示,TAVI围术期的卒中发生率达3.8%~20%[6,9,19],临床无明显卒中表现但核磁共振证实的“隐匿性卒中”发生率高达68%~84%[20-21]。本研究中高达25%的患者出现神志改变,其中3例患者是经升主途径瓣膜置入者,提示神志改变可能与术中箝夹主动脉导致斑块脱落、术后机械通气镇静处理有关。
感染:本研究遵循最新的美国心脏病协会指南,在介入术前常规应用二代头孢菌素类抗生素预防感染[8]。术后50%患者(6例)应用二代头孢菌素足以预防感染。高龄、合并基础肺病、经升主途径操作的患者多需升级至三代头孢菌素,仅有1例患有支气管哮喘、慢性阻塞性肺疾病同时经升主途径施行瓣膜置入的患者合并了较严重肺部感染。感染重在预防,术中严格无菌操作,术后成立专门医护小组、设置专用监护房间、严格房间标准化消毒、强调操作手卫生等有助于降低感染几率。
血管并发症:血管并发症是TAVI的重要并发症。由于TAVI术中所用鞘管直径大、输送系统长、高龄患者动脉粥样硬化严重、显著的钙化弯曲,因此动脉夹层、血管穿孔及穿刺点血肿等的并发症发生率明显增高[22]。Genereux等开展的Meta分析提示血管并发症发生率为9.5%~51.6%[9]。本研究中术后常规行穿刺动脉封堵,并在研究后期常规术毕中和肝素,无一例血管并发症的发生,不失为降低血管并发症的有效防治手段。
研究局限性:本中心TAVI的开展尚处于学习曲线中。再者,研究入选病例数少,不足以评估出现并发症的预测因素。其三,评估疗效还需要长期随访。
结论:本中心小规模研究证实了TAVI可有效降低主动脉瓣狭窄患者的跨瓣压差,术后出血、新发传导异常等并发症的发生率较高,提示TAVI术后需严密监测,早期识别并积极处理并发症。
[1] Nkomo VT, Gardin JM, Skelton TN, et al. Burden of valvular heart diseases: a population-based study. Lancet, 2006, 368: 1005-1011.
[2] Vahanian A, Baumgartner H, Bax J, et al. Guidelines on the management of valvular heart disease: the task force on the management of valvular heart disease of the European Society of Cardiology. Eur Heart J, 2007, 28:230-268.
[3] Iung B, Cachier A, Baron G, et al. Decision-making in elderly patients with severe aortic stenosis: why are so many denied surgery? Eur Heart J, 2005, 26:2714-2720.
[4] Bekeredjian R, Krumsdorf U, Chorianopoulos E, et al. Usefulness of percutaneous aortic valve implantation to improve quality of life in patients >80 years of age. Am J Cardiol, 2010, 106:1777-1781.
[5] Leon MB, Smith CR, Mack M, et al. PARTNER Trial Investigators.Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med, 2010, 363:1597-1607.
[6] Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med,2011,364, 2187-2198.
[7] Makkar RR, Fontana GP, Jilaihawi H, et al. PARTNER Trial Investigators. Transcatheter aortic-valve replacement for inoperable severe aortic stenosis. N Engl J Med, 2012, 366:1696-1704.
[8] Bonow RO, Carabello BA, Chatterjee K, et al. ACC/AHA Task Force on Practice Guidelines.2008 focused update incorporated into the ACC/AHA 2006 guidelines for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol, 2008, 52: e1-142.
[9] Géneéreux P, Head SJ, Van Mieghem NM, et al. Clinical outcomes after transcatheter aortic valve replacement using Valve Academic Research Consortium definitions: a weighted meta-analysis of 3519 patients from 16 studies. J Am Coll Cardiol, 2012, 59: 2317-2326.
[10] Tchetche D, Van der Boon RM, Dumonteil N, et al. Adverse impact of bleeding and transfusion on the outcome post-transcatheter aortic valve implantation: insights from the Pooled-RotterdAm-Milano-Toulouse In Collaboration Plus (PRAGMATIC Plus) initiative. Am Heart J, 2012, 164: 402-409.
[11] Bagur R, Webb JG, Nietlispach F, et al Acute kidney injury following transcatheter aortic valve implantation: predictive factors, prognostic value, and comparison with surgical aortic valve replacement. Eur Heart J, 2010, 31:865-874.
[12] Sinning JM, Ghanem A, Steinhäuser H, et al. Renal function as predictor of mortality in patients after percutaneous transcatheter aortic valve implantation. JACC Cardiovasc Interv, 2010, 3: 1141-1149.
[13] Nuis RJ, Van Mieghem NM, Tzikas A, et al. Frequency,determinants,and prognostic effects of acute kidney injury and red blood cell transfusion in patients undergoing transcatheter aortic valve implantation. Catheter Cardiovasc Interv, 2011, 77: 881-889.
[14] Piazza N, Onuma Y, Jesserun E, et al. Early and persistent intraventricular conduction abnormalities and requirements for pacemaking after percutaneous replacement of the aortic valve. JACC Cardiovasc Interv, 2008, 1: 310-316.
[15] Godin M, Eltchaninoff H, Furuta A, et al. Frequency of conduction disturbances after transcatheter implantation of an Edwards Sapien aortic valve prosthesis. Am J Cardiol, 2010, 106: 707-712.
[16] Testa L, Latib A, De Marco F, et al. Clinical impact of persistent left bundle-branch block after transcatheter aortic valve implantation with CoreValve Revalving System. Circulation, 2013, 127: 1300-1307.
[17] Omran H, Schmidt H, Hackenbroch M, et al. Silent and apparent cerebral embolism after retrograde catheterisation of the aortic valve in valvular stenosis: a prospective, randomized study. Lancet, 2003,361:1241-1246.
[18] Erdoes G, Basciani R, Huber C, et al. Transcranial Doppler-detected cerebral embolic load during transcatheter aortic valve implantation.Eur J Cardiothorac Surg, 2012, 41: 778-783
[19] Arnold M, Schulz-Heise S, Achenbach S, et al. Embolic cerebral insults after transapical aortic valve implantation detected by magnetic resonance imaging. JACC Cardiovasc Interv, 2010, 3: 1126-1132.
[20] Rodes-Cabau J, Dumont E, Boone RH, et al. Cerebral embolism following transcatheter aortic valve implantation: comparison of transfemoral and transapical approaches. J Am Coll Cardiol, 2011, 57:18-28.
[21] Kahlert P, Knipp SC, Schlamann M, et al. Silent and apparent cerebral ischemia after percutaneoustransfemoral aortic valve implantation: a diffusion-weighted magnetic resonance imaging study. Circulation,2010, 121: 870-878.
[22] Généreux P, Webb JG, Svensson LG, et al. PARTNER Trial Investigators.Vascular complications after transcatheter aortic valve replacement: insights from the PARTNER (Placement of AoRTic TraNscathetER Valve) trial. J Am Coll Cardiol, 2012, 60: 1043-1052.
