甲基紫光度法测定红霉素肠溶片中的红霉素
2013-11-15陈莲惠曹洪斌
陈莲惠,简 易,曹洪斌
(1.川北医学院化学教研室,四川 南充 637000;2.川北医学院物理教研室,四川 南充 637000)
0 引 言
红霉素属大环内酯类抗生素,作为青霉素过敏患者的替代用药,对很多炎症都有很好的疗效,在高浓度时对某些细菌具杀菌作用,因此在临床上应用极广。已报道的红霉素分析方法有微生物检测法[1]、高效液相色谱法(HPLC)[2-3]、电化学方法[4]、荷移分光光度法[5-7]、比浊法[8-9]等。这些方法中,有的灵敏度较低不能满足痕量分析的要求,有的操作繁琐、仪器昂贵、成本高。因此开发简单、快速、灵敏的测定方法有实际意义。本文提出了利用红霉素在近中性条件下与甲基紫反应生成缔合物,用分光光度计在535nm处测定其吸光度降低值,建立了新的分光光度法测定红霉素,可用于红霉素肠溶片中红霉素含量的测定。
1 实验部分
1.1 仪器与试剂
WFJ7200分光光度计(北京宏昌信科技有限公司);PHS-4C+酸度计(成都市方舟科技开发公司);ML104电子天平(杭州汇尔仪器设备有限公司)。
红霉素(Erythromycin)标准品(中国药品生物制品检定所,批号30307-200716);甲基紫(Methyl Violet)标准品(成都科龙化工试剂厂);红霉素肠溶片1(吉林省长恒药业有限公司,国药准字H22020606);红霉素肠溶片2(辅仁药业集团有限公司,国药准字 H20073314);冰乙酸(A.R.)(成都市科龙化工试剂厂);磷酸(A.R.)(武汉市化学试剂厂);硼酸(A.R.)(中国四川成都化学试剂厂);氢氧化钠(A.R.)(成都市科龙化工试剂厂);无水乙醇(成都市科龙化工试剂厂);实验用水皆为二次石英蒸馏水。
1.2 实验方法
1.2.1 试剂的配制
Britton-Robinson缓冲溶液:取2.47 g硼酸、2.36 mL冰乙酸和3.92g磷酸配制成1L的水溶液,与0.2mol/L的氢氧化钠按照一定比例混合可配制一系列不同pH值的缓冲溶液,使用时用酸度计准确测定。
甲基紫溶液:准确称取0.05g甲基紫标准品配制成250.00mL水溶液,此时浓度为5.08×10-4mol/L,使用时用水稀释成5.08×10-5mol/L的标准工作溶液。
红霉素贮备液:准确称取200.4mg的红霉素,用无水乙醇溶解、定容,配制成100.00mL的贮备液,使用时用水稀释成0.1mg/mL的标准工作溶液。
1.2.2 实验操作
准确移取5.00 mL红霉素工作液于15.00 mL比色管中,加入5.00 mL甲基紫工作溶液和2.00 mL pH 6.8的B.R.缓冲溶液,用水稀释至刻度,摇匀,室温下静置30 min,以试剂空白作参比,用1 cm比色皿在535nm处测定吸光度。
2 结果和讨论
2.1 检测波长的确定
按照试验方法显色后,在分光光度计上分别对甲基紫-红霉素溶液、甲基紫溶液和红霉素溶液进行扫描,结果如图1所示。甲基紫在可见光区有强烈的吸收,最大吸收波长在584nm;而红霉素在可见光区无明显吸收;在pH 6.8的B.R.缓冲溶液中,甲基紫和红霉素生成稳定的离子缔合物,在可见光区吸光度较甲基紫有明显增大,且增大最多时对应的波长在535nm附近,较甲基紫的最大吸收波长蓝移了49nm;因此本文选择测定波长为535nm。
2.2 反应条件的选择
2.2.1 稀释剂
试验研究了甲醇、乙醇、水作溶剂定容时对显色反应的影响,结果表明,用甲醇、乙醇和水作稀释剂对试验结果没有明显的影响。本实验选用水作稀释剂。
2.2.2 缓冲溶液种类及pH
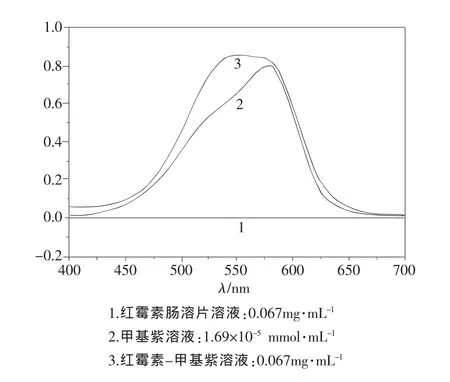
图1 吸收光谱(pH 6.8)
试验了 HAc-NaAc、B.R.、Tris-HCl等缓冲溶液对试验体系的影响,结果如图2所示。用HAc-NaAc和Tris-HCl作缓冲介质时,缓冲范围有限,且在可使用范围内检测到体系吸光度值均比B.R.缓冲溶液体系中的测定值小;当选用近中性的B.R.缓冲溶液时,反应体系的吸光度值最大。本实验选用pH 6.8的B.R.缓冲溶液。
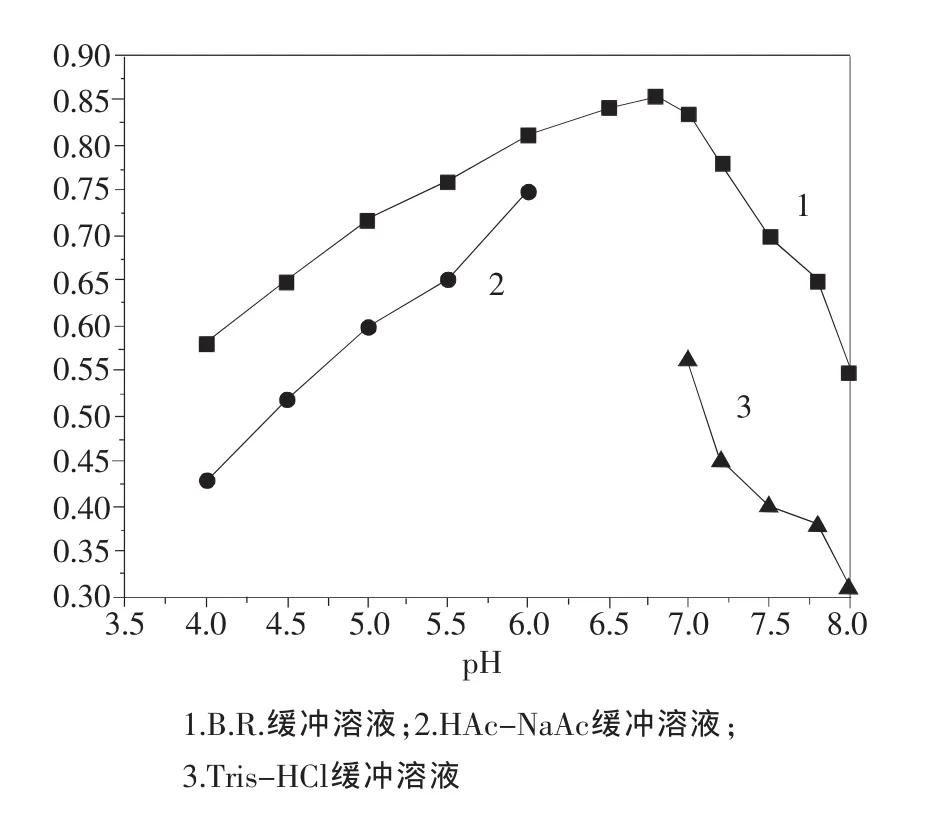
图2 缓冲溶液的影响
2.2.3 显色剂用量
按试验方法,加入 1.00,2.00,3.00,4.00,5.00,6.00,7.00mL等不同用量的甲基紫工作液,测定吸光度,结果显示:当显色剂用量为5.00mL以上时,吸光度不再明显增加。因此,本实验选用5.00mL。
2.2.4 温度
按试验方法,将配制好的溶液摇匀后,置于0,10,20,30,40,50,60,70,80,90,100℃等不同温度的水浴中恒温加热20min,冷却到室温,用试剂空白作参比分别测定吸光度。结果表明,室温下反应最完全,吸光度最大。
2.2.5 显色时间和体系稳定性
其他反应条件不变,按试验方法,将配制好的溶液摇匀后,在室温条件下放置 5,10,15,20,25,30,40,50,60,80,100min 后进行测定,结果显示:反应 30min后吸光度不再有明显的增加。其他条件不变,将配制好的溶液从30min起,相隔不同时间测定吸光度,直到误差大于±5%。结果显示:从最佳反应时间起,10h内吸光度差值非常小,体系稳定性好。
2.2.6 共存物质的影响
按实验方法考察了常见8种氨基酸、维生素、糖类和无机盐离子等共存物质对体系RRS的影响。试验结果见表 1。较大倍数的 NH4+,Cl-、K+、Br-、K+、HCO3-等无机离子和一定量的氨基酸、糖类均不干扰,而Bi3+、Re3+、HPO42-和强力霉素等有一定干扰。加标回收试验(表2)也显示药物中的辅料对测定无影响。
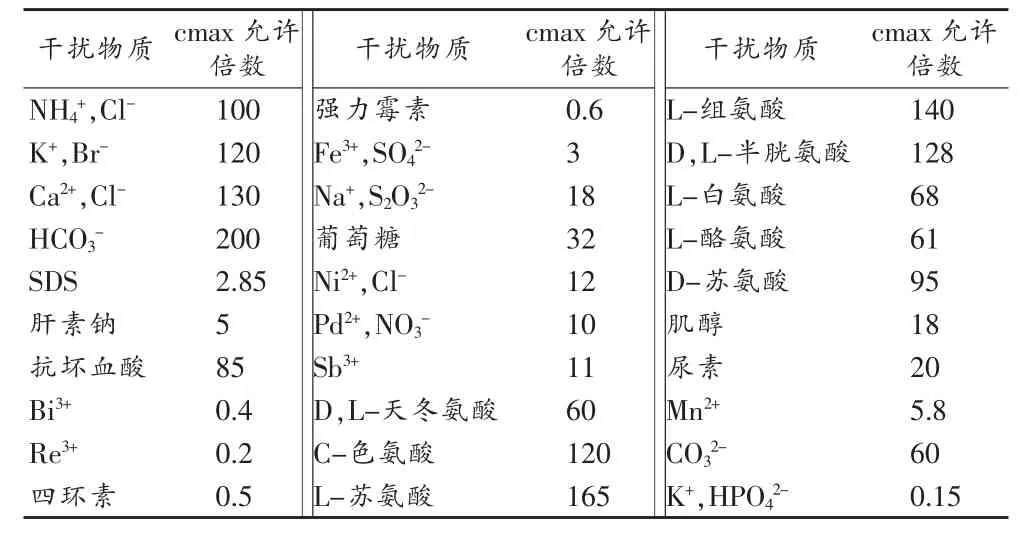
表1 共存物质的影响(红霉素肠溶片溶液0.067mg·mL-1)
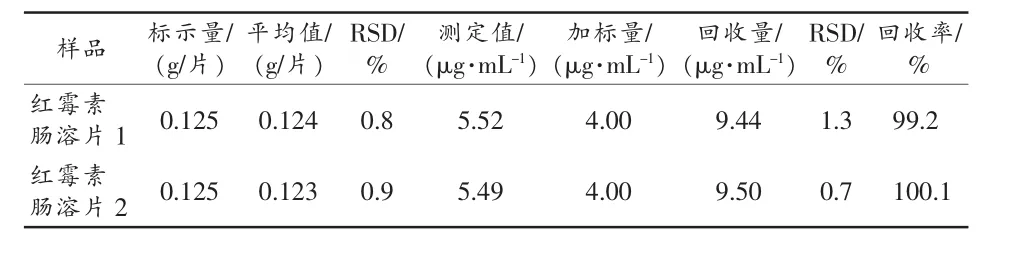
表2 样品分析及加标回收实验结果(n=6)
2.3 标准曲线和相关参数
准确移取一系列不同体积的红霉素标准工作液于15.00 mL比色管中,按试验方法测定吸光度,绘制标准曲线。结果表明:红霉素的浓度在0.000 8~0.050 mg/mL范围内服从Beer定律,有很好的线性关系。回归方程为:A=12.336c+0.0173,r=0.9989;对15.00 mL 5.0×10-3mg/mL红霉素连续测定6次,RSD=0.9%。方法的检出限为0.18μg/mL(用空白加标的方法求得检出限:将分析物红霉素标准品配在空白溶剂中,用光度计重复测定,标准偏差的3倍所对应的浓度值为检出限)。缔合物的表观摩尔吸光系数ε为1.63×104L/(mol/cm)。
2.4 试样的测定
按照2010版药典[1],取两个不同厂家的红霉素肠溶片各4片,在研钵中研细,用50 mL无水乙醇,分次研磨使红霉素肠溶片溶解,定量转移到500 mL容量瓶中,用二次蒸馏水定容,摇匀,静置。实验时精密量取上清液适量,在最佳实验条件下进行测定,同时采用在样品中加入已知量的方法做回收试验,结果见表2。由表2可知:用甲基紫作为显色剂,用分光光度法可以测定红霉素肠溶片中的红霉素,用该法测得值与正规厂家生产和标示的含量基本一致;并且加标回收实验也证明了方法可行,其稳定性和重现性均比较好。
3 结束语
在医学院或药物研究单位,研究简便、快速、高效、灵敏、选择性好的检测高效广谱抗生素红霉素的方法具有非常重要的现实意义,近年来有不少的科学研究工作者都为之付出了心血和汗水。本文基于甲基紫与红霉素的反应建立了测定红霉素的分光光度法,该方法简单,灵敏度较高,选择性较好,回收率符合要求,具有一定的实用价值。
[1]国家卫生部药典委员会.中华人民共和国药典(二部)[S].北京:化学工业出版社,2010,301.
[2]Petr M S,Lymburn M,Clear M H.High-performance liquid chromatography determing erythromycin in plasma[J].J Assoc Off Anal Chem,1987(70):691.
[3]于慧娟,蔡友琼,顾润润.高效液相色谱法测定红霉素、甲红霉素和罗红霉素的研究[J].分析试验室,2006,25(6):63-66.
[4]Helena T,Britt-maric E.Determination of erythromycin in gastric-juice and blood plasma by liquid chromatography and electrochemical detection[J].J Chromatogr B,1995,673:81.
[5]李春香,徐婉珍,闫永胜.结晶紫-红霉素体系电荷转移分光光度法测定红霉素的研究[J].药物分析杂志,2006,26(12):1737-1739.
[6]贾云宏,李华侃,李东辉.茜素红的荷移反应测定红霉素[J].数理医药学杂志,2003,16(1):69-70.
[7]江虹,刘艳,湛海粼.麦迪霉素、红霉素与茜素的分光光度分析研究[J].分析实验室,2007,26(5):19-22.
[8]谭俊,高勇生,郝玉有,等.比浊法测定红霉素生物效价及其高通量测定方法探讨[J].中国抗生素杂志,2009,34(3):170-172.
[9]刘珂.比浊法自动测定红霉素及红霉素肠溶片的效价[J].中国药品标准,2010,1(3):204-206.
