ELFMFs 诱导大鼠腓肠肌钝挫伤恢复的组织学、超微结构及血清酶活性的影响
2013-11-12董贵俊葛新发潘卫东李可峰
董贵俊,王 超,葛新发,潘卫东,李可峰
骨骼肌钝挫伤是最常见的运动损伤之一,在不同项目运动中均占据较高的比率[1],严重影响骨骼肌的收缩功能,破坏肌纤维质膜和基底膜的完整性,并最终造成细胞的死亡,引起骨骼肌的进一步损伤[2-4]。在运动医学研究领域中,对骨骼肌损伤病理机制的研究及预防、治疗及康复措施的探讨一直都是热点。近些年,电磁治疗的特殊作用及无创性等优点越来越多地受到人们关注,其研究多数集中于30~300 Hz 的极低频电磁场(ELFMFs)。ELFMFs 对生物体不同层次如器官、组织、细胞、大分子的影响主要表现为非热效应,具体表现为能加快组织愈合、促进细胞分化[5-6]。前人研究中,ELFMFs 通过影响钙离子通道的活性从而调控肌质网钙泵活性,影响肌细胞中的能量代谢。本研究以骨骼肌钝挫伤的SD 大鼠模型为实验对象,通过施加ELFMFs 处理,通过组织学、超微结构、酶学指标检测等方法来分析电磁场在损伤恢复过程中的作用,分析ELFMFs 在受损骨骼肌恢复过程中缓解能量危机的作用,为运动骨骼肌损伤的治疗与康复提供理论支持。
1 研究对象与方法
1.1 研究对象及分组
10周龄SPF 级雄性SD 大鼠26 只,由协和医院(北京)实验动物中心提供,体重260~300 g,分笼正常饲养,自由饮食,给予国家标准混合饲料和自来水,动物房保持适宜的温度及光照时间(室温25℃,光照昼夜各12 小时)。
将大鼠随机分为正常组、损伤组、假暴露组、磁场暴露组、注射bFGF 组。为了将极低频磁场的作用效果与目前已经取得效果的bFGF 治疗进行对比,本研究设注射bFGF 组作为一个阳性对照。
1.2 实验方法
1.2.1 钝挫伤模型处理
打击前,分别在大鼠右下肢的腓肠肌中端标记,然后用2%的戊巴比妥钠(生理盐水配制)按0.3 ml/100 g 体重的标准进行腹腔麻醉,大鼠处于深度麻醉状态后,参照董贵俊等[7]的方法,造成其右侧腓肠肌急性钝挫伤(图1),经解剖证实损伤成功率100%。E 组麻醉状态下即刻于损伤部位局部一次性皮下注射bFGF溶液0.1 ml(2 μg/ml)。

图1 打击器图示及打击部位图
1.2.2 磁场暴露装置处理
假暴露组大鼠在实验开始后放置于对照组线圈内(每天6 h,10 天,时间09:00-15:00);磁场暴露组在实验开始后放置于暴露组线圈内(每天6 h,10 天,时间09:00-15:00);注射bFGF 组在损伤后即刻于右小腿腓肠肌损伤处局部注射0.1 ml bFGF 溶液(2 μg/ml,生理盐水配制),实验开始后放置于动物房内正常饲养10 天;假暴露组、磁场暴露组、注射bFGF 组于实验开始后第10 天处理结束后麻醉取材(图2)。

图2 自制磁场处理装置及磁场波形图
1.2.3 组织、电镜标本制备及观察
光学显微镜观察标本的制备采用石蜡组织切片技术。日本OLYMPUS 公司生产的DP70 数码成像系统进行观察。透射电子显微镜标本的制作采用超薄切片技术。通过中国科学院生物物理研究所生物成像技术实验室提供的FEI 生产的Tecnai Spirit 120KV 透射电子显微镜及成像系统进行观察。
1.2.4 血清提取及检测指标
实验大鼠腹腔麻醉后,静脉取血6~10 ml,3 000 rpm、4℃离心两次,取上层血清分装于EP 管中,用于测定血清肌酸激酶(CK)、乳酸脱氢酶(LDH)、碱性磷酸酶(ALP)的酶活性,测定试剂盒购自南京建成。
1.3 数据统计与处理
所有数据统计分析均使用SPSS17.0 软件系统及EXCEL 进行统计学分析处理,所得数据均以平均数±标准差表示,两组比较分析采用t 检验,多组组间比较采用单因素方差分析;P <0.05 为具有差异性,P <0.01为显著差异性,具有统计学意义。
2 结果与分析
2.1 组织病理切片观察
病理切片(图3)纵切面显示,正常组(A)表现为排列紧密而规律的纵向肌纤维,边界清晰,细胞核多且分布于细胞质边缘,其他组均出现肌纤维排列不紧密、紊乱现象,其中损伤组(C)可见局灶性破坏,损伤处肌纤维完全断裂,断面不整齐,损伤严重处因细胞溶解而边界模糊;假暴露组(E)肌纤维排列不整齐,可见中央膨大且粗细不等的梭形肌纤维及大量核内移现象;暴露组(G)肌纤维排列较紧密,膜结构界限清晰,核内移数量较少,细胞粗细较不均匀;注射bFGF 组(I)细胞排列较为正常,少量相间的萎缩肌细胞内出现核内移现象。横切面显示正常组(B)肌细胞呈不规则的卵圆形,且排列紧密,大小均匀(注:不同的细胞类型染色程度不同);其他组均出现大小不一、形状变化的细胞,并且各组有不同程度的炎细胞浸润和核内移现象;其中损伤组(D)细胞因组织水肿而间隙明显,细胞形态发生改变,边界模糊,出现膨大的细胞核;假暴露组(F)细胞间隙明显,细胞为增大、深染的圆形肌细胞,炎性细胞浸润;暴露组(H)细胞形态较为规则,肌细胞核增生,少量增大、深染圆形细胞;注射bFGF 组(J)较为正常,但无法通过染色程度辨别肌细胞类型。

图3 SD 大鼠腓肠肌病理切片(HE 染色,×200)
2.2 超微结构变化分析
电子显微镜观察纵切面(图4)显示,正常组(A)粗细肌丝相间平行排列,肌原纤维排列整齐,明暗带交替出现,Z 线连续且完整,存在大量位于Z 线附近肌原纤维间的线粒体。其他组均显示肌小节不规则排列,肌原纤维杂乱不齐、模糊不清,线粒体数量明显减少,出现空泡状线粒体结构;损伤组(B)Z 线断裂、不连续,出现漂移现象,细胞膜界限模糊不清;假暴露组(C)Z 线不连续,细胞膜界限可以分辨;暴露组(D)Z 线局部不连续,出现少量空泡化线粒体结构;注射bFGF 组(E)肌小节排列较规则,但与正常组相比Z 线较细,且Z 线附近的线粒体数量明显减少,且有空泡化线粒体结构。根据电镜照片测量肌小节长度结果显示,与正常组相比,C、D、E 组肌小节长度均明显缩短(P <0.05),且与假暴露组相比,D、E 组有显著差异(P <0.05)。

图4 SD 大鼠腓肠肌透射电子显微镜切片(×8400)
2.3 血清中CK、LDH、ALP 酶活性测定
2.3.1 血清肌酸激酶(CK)含量
与正常组相比,损伤组、假暴露组有显著差异性(P <0.05),并且与假暴露组相比,磁场暴露组与注射bFGF 组有显著差异性(P <0.05)(图5)。
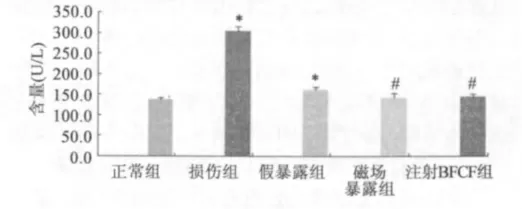
图5 SD 大鼠血清肌酸激酶(CK) 含量(U/l)
2.3.2 血清乳酸脱氢酶(LDH)含量
与正常组相比,除注射bFGF 组其他各组均有显著差异(P <0.05),并且与假暴露组相比,磁场暴露组与注射bFGF 组有显著差异性(P <0.05)(图6)。

图6 SD 大鼠血清乳酸脱氢酶(LDH) 含量(U/l)
2.3.3 血清碱性磷酸酶(ALP)含量
与正常组相比,其他组均有显著差异性(P <0.05),并且与假暴露组相比,磁场暴露组与注射bFGF组有显著差异性(P <0.05)(图7)。

图7 SD 大鼠血清碱性磷酸酶(ALP) 含量(U/l)
3 讨论与结论
3.1 讨论
本研究采用重物打击的方法来模仿运动中骨骼肌受到瞬间爆力冲击造成的运动损伤来建立SD 大鼠腓肠肌急性钝挫伤模型[8]。损伤后给予多种不同处理,通过检测大鼠生化指标及特殊病理组织学的变化评价不同组之间损伤恢复情况。研究发现,受损骨骼肌组织切片中膨大的圆形细胞说明肌细胞有炎症反应、组织水肿及后期自身修复的开始,炎性细胞的浸润提示存在慢性的炎症过程,核内移现象可能是存在神经肌肉接头功能异常现象;超微结构中肌小节排列紊乱,Z线飘移,线粒体数量减少,结构异常,提示为肌肉损伤处存在能量危机现象,并且超微结构显示肌纤维存在损伤现象,肌纤维存在受损后异常收缩现象。ELFMFs能促进肌细胞核增生,使受损伤部位圆形细胞数目明显减少,同时Z 线较自然恢复组更规则,减少空泡化线粒体数量,说明ELFMFs 能减少受损肌细胞的炎症反应,促进有氧代谢能力恢复,减缓能量危机现象。
骨骼肌损伤导致细胞膜通透性增加,引起血清中部分酶活性升高[9-10]。随着肌肉再生及损伤恢复,血清酶活性逐渐恢复至正常水平[11-12]。本研究发现,10天的ELFMFs 处理能有效降低CK 的水平,说明ELFMFs 处理能显著提高受损肌细胞细胞膜的完整性;血清中LDH 及ALP 的显著降低,说明受损肌细胞中LDH 及ALP 得到有效保留,从而提高了受损肌细胞中有氧代谢能力。
3.2 结论
ELFMFs 能引起钝挫伤大鼠腓肠肌肌细胞核增生,显著改善钝挫伤后腓肠肌肌小节长度,改善线粒体空泡化程度,有利于提高钝挫伤恢复过程中有氧代谢能力;ELFMFs 处理,能显著降低钝挫伤后血清中CK、LDH 及ALP 水平,说明ELFMFs 能显著改善钝挫伤后腓肠肌肌细胞膜的稳定性,有利于缓解受损肌组织的能量危机,加速组织恢复速度。因此,ELFMFs 通过改变钝挫伤后腓肠肌肌细胞核增生,加快线粒体自身修复速度,减少肌细胞膜的通透性,加速受损肌细胞有氧代谢能力的恢复,从而有利于钝挫伤恢复。
[1]Lockhart NC,Brooks SV.Protection from contraction- induced injury provided to skeletal muscles of young and old mice by passive stretch is not due to a decrease in initial mechanical damage[J].J Gerontol A Biol Sci Med Sci,2006,61(6):527-533.
[2]张海平,宋吉锐.急性骨骼肌损伤动物实验模型构建及应用[J].中国组织工程研究与临床康复,2007,11(49):9984-9987.
[3]Huard J,Li Y,Fu FH.Muscle injuries and repair current trends in research[J].J Bone Joint Surg,2002,84(5):822-832.
[4]Toumi H,Best TM.The inflammatory response:friend or enemy for muscle injury[J].Br J Sports Med,2003,37(4):284-286.
[5]曹学成,宁镭.极低频磁场生物效应的生物物理机制研究[J].山东农业大学学报,2007,38(3):403-406.
[6]吴稚冰,孔祥鸣,马胜林.磁场治疗肿瘤的研究进展[J].中华物理医学与康复杂志,2006,28(2):140-142.
[7]董贵俊,葛新发,潘卫东,李可峰.磁场定位磁纳米化bFGF治疗大鼠腓肠肌钝挫伤恢复效果研究[J].武汉体育学院学报,2011,45(2):43-46.
[8]Baker BA,Mercer RR,Geronilla KB,et al.Stereological analysis of muscle morphology following exposure to repetitive stretch shodening cycies in a rat model[J].Physiol Nutr Metab,2006,31(2):167-179.
[9]董宇,陈世益,李云霞,等.黄芪注射液对大鼠骨骼肌钝挫伤后修复过程中断裂强度和拉伸率的影响[J].中国运动医学杂志,2007,26(3):283-285.
[10]董贵俊,李可峰,葛新发,潘卫东.补充磷脂对大鼠腓肠肌钝挫伤收缩力、松弛特性及自由基清除的影响[J].武汉体育学院学报,2011,45(10):52-55.
[11]Bennett M,Best TM,Babul S,et al.Hyperbaric oxygen therapy for delayed onset muscle soreness and closed soft tissue injury[J].Cochrane Database Syst Rev,2005(4):CD004713.
[12]李玥,霍小林,宋涛.极低频正弦磁场对大鼠痛阈及氨基酸神经递质的影响[J].中国应用生理学杂志,2010,26(2):210-221.
