脐带间充质干细胞移植治疗糖尿病周围神经病变的疗效观察
2013-11-08安沂华王晓东滑蓉蓉母义明
郑 培,安沂华,王晓东,滑蓉蓉,朱 岩,母义明
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病最常见的慢性并发症之一,是导致糖尿病足和其他危重病变的重要危险因素[1]。其发病机制尚未完全清楚,尚无确切、有效的治疗手段。笔者旨在通过脐带间充质干细胞(human umbilical cord mesenchymal stem cells,HUC-MSCs)移植治疗,观察其在移植后1、3、6个月时血糖控制情况、临床症状改善程度及神经电生理各指标的变化,并探讨HUC-MSCs 移植治疗DPN 的可能机制。
1 对象与方法
1.1 对象 选择2010-11至2011-07 在武警总医院细胞移植科住院的DPN 患者32例,其中男22例,女10例;年龄36~66岁,平均(51.13 ±10.37)岁;糖尿病病程2~22年,平均(8.75 ±6.45)年。患者均知情同意并签署知情同意书。DPN 诊断标准:(1)有明确的糖尿病史;(2)有四肢末端感觉异常和(或)感觉障碍,膝、跟腱反射减弱或消失;(3)神经电生理检查异常。排除标准:(1)血糖控制差;(2)目前使用其他药物治疗周围神经病变且所使用的药物有可能影响干细胞疗效者;(3)有严重下肢溃疡或坏疽,不适合行下肢介入手术者;(4)恶性肿瘤;(5)严重的心肝肾疾病;(6)患有可导致周围神经病变的其他疾病;(7)同时患血液病、感染未完全控制者。
1.2 治疗方法
1.2.1 HUC-MSCs 制备及检测 采自健康正常孕周的剖宫产产妇的脐带约10 cm,无菌条件下分离、培养、传代。收集第6~8 代的细胞,利用倒置相差显微镜和流式细胞仪进行鉴定再用于移植。检测项目包括:(1)细胞形态学;(2)细胞表面标记;(3)无菌;(4)支原体;(5)内毒素。
1.2.2 干细胞移植方法 完善术前检查后,分别行1次静脉输注干细胞移植和1次右侧股动脉穿刺胰腺血管插管输注干细胞移植,两次间隔3~5 d。
1.2.3 观察指标 分别于移植前,移植后1、3、6个月时测定并比较患者的用药情况,空腹血糖、餐后2 h 血糖、糖化血红蛋白水平,多伦多临床评分系统(TCSS 评分)[2]、神经电生理指标,同时观察治疗过程中的不良反应。神经电生理检查设备选择俄罗斯生产的Neurosoft Neuron-Spectrum-5(序列号150032)。神经传导测定神经包括正中神经、尺神经、胫后神经和腓总神经,测定电生理参数包括感觉神经传导速度、感觉神经动作电位的波幅、运动末梢潜伏期、复合肌肉动作电位波幅,检测方法见表1。
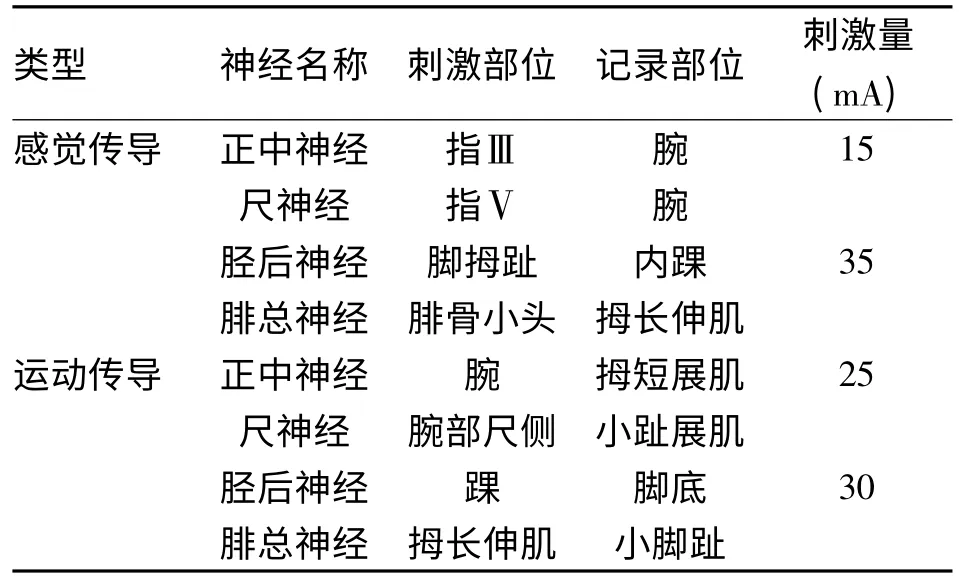
表1 电生理指标检测信息
1.3 统计学处理 采用SPSS 13.0 进行数据处理,计量资料采用±s 表示,术前、术后1、3、6个月各重复测量数据比较采用重复测量资料的方差分析;计数资料使用百分率表示,各时间点百分率的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
入组32例均顺利完成随访。
2.1 血糖控制情况 移植后,有6例(18.75%)完全停用降糖药物,仅通过注意饮食和运动来调整血糖;有24例(75.00%)胰岛素或口服降糖药物剂量较移植前下降;有2例(6.25%)胰岛素或口服降糖药物剂量与移植前比较无变化。移植后1、3、6个月时患者的空腹血糖、餐后2 h 血糖、糖化血红蛋白水平均较移植前下降(P 均<0.05,表2),其共同的变化趋势为术后第1个月下降最明显,术后3个月时继续下降,但幅度较第1个月时平坦,第6个月时较第1、第3个月时略升高,但仍低于术前值。
表2 糖尿病周围神经病变患者移植前后空腹血糖、餐后2 h 血糖和糖化血红蛋白水平比较(n=32;)
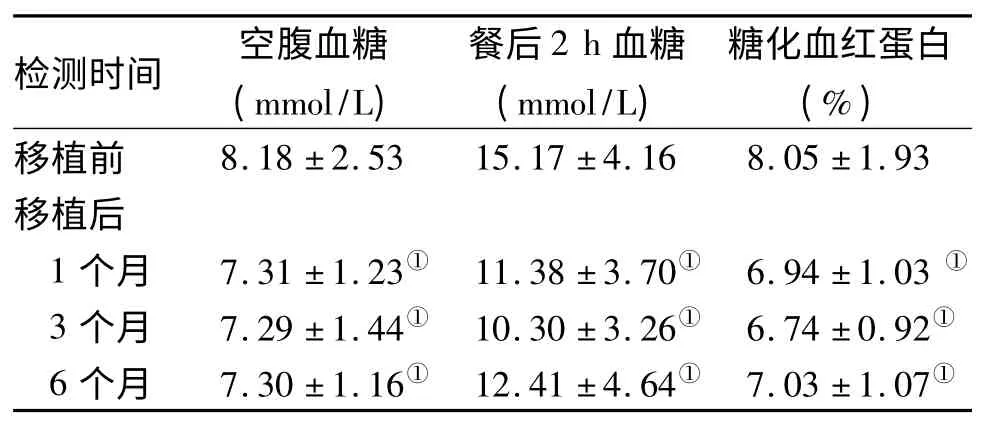
表2 糖尿病周围神经病变患者移植前后空腹血糖、餐后2 h 血糖和糖化血红蛋白水平比较(n=32;)
注:与移植前比较,①P<0.05
2.2 TCSS 评分 移植前TCSS 评分为(6.81 ±4.37)分,移植后1、3、6个月时分别是(4.25 ±3.22)分、(3.50 ±2.54)分和(3.50 ±2.91)分,移植后各时间点较移植前TCSS 评分均降低(P<0.01),说明移植后患者临床症状得到显著改善。
2.3 神经电生理变化 患者术前正中神经、尺神经、胫后神经和腓总神经感觉神经传导引出率分别为100%、100%、18.75%(6/32)和0%(0/32);治疗后,胫后神经和腓总神经感觉传导引出率分别升至37.50%(12/32)和25.00%(8/32),与治疗前比较,差异有统计学意义(P<0.05)。不同时间点正中神经的运动末梢潜伏期、尺神经的感觉传导速度和运动末梢潜伏期改善均具有统计学差异(P 均<0.05,表3),变化趋势为术后第1个月改善最明显,6个月内均有持续疗效。
2.4 不良反应 有4例(12.8%)于介入术后第2天发现术区有皮下渗血,直径6~10 cm,嘱患者适当减少下肢运动,5~7 d 自行消退,考虑与介入术后过早活动有关;有2例(6.25%)于脐带干细胞移植术后24 h 内有一过性中、低热(<38.0℃),给予物理降温后可降至正常。患者住院期间及随访过程中均进行体温、心率、呼吸、血压等一般状况检查及血生化检查,均未见异常。
表3 糖尿病周围神经病变患者移植前后神经电生理指标变化情况 (n=32;)

表3 糖尿病周围神经病变患者移植前后神经电生理指标变化情况 (n=32;)
注:与移植前比较,①P<0.05
3 讨 论
DPN 是糖尿病最常见的慢性并发症之一,其发病率高,危害性大,是导致糖尿病患者丧失劳动能力的主要原因之一。DPN 发病机制还不完全清楚,目前普遍认为DPN 发生与以下因素共同作用有关:(1)代谢紊乱,高血糖环境下线粒体内电子传递链过氧化物产生过量,从而导致多元醇通路的激活、糖基化终末产物的形成、蛋白激酶C 通路和氨基己糖通路的激活[3,4];(2)微血管病变,糖尿病影响小血管内皮细胞,使基底膜变性与玻璃样变,血流减慢,导致小血管闭塞、神经缺血、缺氧;(3)神经生长因子(NGF)减少;(4)过氧化物和自由基损伤以及必需脂肪酸代谢异常等其他因素[5]。临床上对DPN 尚无特异性治疗方法,本研究旨在应用HUC-MSCs 移植,观察能否改善周围神经病变的症状和神经传导速度,探索治疗DPN 的新方法。
本研究结果显示,治疗后患者正中神经的运动末梢潜伏期、尺神经的感觉传导速度和运动末梢潜伏期,胫后神经感觉传导引出率、腓总神经的感觉传导引出率和运动末梢潜伏期较治疗前均有所改善,证明HUC-MSCs 移植可以改善DPN 各周围神经的神经传导。在神经电生理中,神经传导速度降低主要由神经节段脱髓鞘引起,而动作电位波幅下降主要由神经节段轴索变性引起,两者可相互独立[6]。在本研究中,所测各神经的波幅变化均无统计学意义,可能因HUC-MSCs 主要通过改善周围神经的髓鞘脱失发挥作用,对轴索变性的影响不大,从而造成波幅变化无统计学差异,但这仍需要进一步研究证实。
本研究还显示,治疗后空腹血糖、餐后2 h 血糖、糖化血红蛋白、TCSS 评分均较治疗前好转,说明患者临床症状及血糖情况同样得到明显改善。通过对移植后1、3、6个月进行随访,各观察指标的总体变化趋势为术后第1个月改善最明显,术后6个月内均有持续疗效。本研究中,所采用的移植方式不同于以往报道的按固定间距下肢肌肉注射的干细胞移植方法[7],主要考虑到多点肌肉注射痛苦大,感染概率高,且术后造成患肢胀痛、水肿加重的可能性大。采用静脉输注干细胞创伤小、不良反应小,干细胞可以到达四肢最远端,而右侧股动脉穿刺胰腺血管插管干细胞移植则是通过临床上已经相当成熟的介入技术,直接将干细胞输送到胰腺血管,修复胰岛功能。
近年来,大量临床与动物实验均证实将自体骨髓或外周血干细胞移植入缺血肢体后,在缺血、缺氧环境下可诱导生成血管内皮细胞、表皮细胞等,形成新生毛细血管、再生表皮,并逐渐分化并形成新的毛细血管,促进血管再生[8];同时干细胞可反应性分泌多种生长因子[9,10],如血管内皮生长因子、胰岛素样生长因子、碱性成纤维细胞生长因子和神经生长因子等,这些因子能产生神经保护作用和促进局部微血管再生,支持新生血管形成、神经再生和重构,从而起到治疗神经损伤的作用,最终可改善和恢复患肢血流,提高患肢皮肤温度,缓解下肢疼痛及冷、凉感觉,使溃疡面缩小或愈合[11,12],提示干细胞移植可能从整合再生、神经营养、改善神经微循环等途径治疗DPN。但骨髓动员和采集为有创操作,对采集环境、身体条件、心理接受程度要求较高,且糖尿病下肢缺血患者多为年龄偏大的老年患者,不论是其自体骨髓还是外周血来源的干细胞,其数量、增殖、分化、黏附和成血管能力均降低[13],可能会影响治疗效果。与骨髓和自体外周血干细胞相比,脐带中含有丰富的间充质干细胞及造血干细胞,间充质干细胞更原始,分化扩增能力更强,诱导分化后获得足量干细胞且向血管、骨、肌肉、神经分化能力更强大,具有更加有效的干细胞潜能,且HUC-MSCs 采集简单、资源丰富,不存在伦理争议,故HUC-MSCs无论是从来源上还是从生物学特性及临床效果上均优于骨髓及外周血干细胞[14]。
本研究尚有以下局限性:样本量小,未设对照组进行比较,没能从组织学方面进一步研究,长期疗效仍需进一步随访、观察。总之,本研究结果表明,应用HUC-MSCs 移植治疗糖尿病周围神经病变安全、有效、可行,是临床治疗糖尿病周围神经病变的一条新思路。
[1]Little A A,Edwards J L,Feldman E L.Diabetic neuropathies[J].Pract Neurol,2007,7:82-92
[2]Perkins B A,Bril V,Olaleye D,et al.Simple screening tests for peripheral neuropathy in the diabetes clinic[J].Diabetes Care,2001,24(2):250-256.
[3]Brownlee M.Biochemistry and molecular cell biology of diabetic complications[J].Nature,2001,41(4):813-820.
[4]沈 薇,董继宏.糖尿病周围神经病的发病机制及治疗展望[J].中国临床神经科学,2008,16(2):204-207.
[5]Dejgaard A.Pathophysiology and treatment of diabetic neuropathy[J].Diabet Med,1998,15:97-112.
[6]Behse F,Buchthal F,Carlsen F.Nerve biopsy and conduction studies in sural nerves in diabetic neuropathy[J].Neurol Neurosurg Psychiatty,1977,40:1070-1082.
[7]谷涌泉,张 建,齐立行,等.自体骨髓干细胞移植治疗下肢神经病变的效果:3例讨论[J].中国临床康复,2005,9(18):46-48.
[8]Kawamoto A,Asahara T,Losordo D W.Transplantation of endothelial progenitor cells for therapeutic neovascul arization[J].Cardiovasc Radiat Med,2002,3(3-4):221-225.
[9]Busik J V,Tikhonenko M,Bhatwadekar A,et al.Diabeticretinopathy is associated with bone marrow neuropathy and adepressed peripheral clock [J].Exp Med,2009,206(13):2897-2906.
[10]Schmidt R E,Dorsey D A,Beaudet L N,et al.Insulin-like growth factor I reverses experimental diabetic autonomic neuropathy[J].Pathol,1999,155(5):1651-1660.
[11]Lakshmipathy U,Verfaillie C.Stem cell plasticity[J].Blood Rev,2005,19(1):29-38.
[12]Lange C,Schroeder J,Stute N,et al.High-potential human mesenchymal stem cells[J].Stem Cells Dev,2005,14(1):70-80.
[13]Tepper O M,Galiano R D,Capla J M,et al.Human endothelial progenitor cells from type II diabetics exhibit impaired proliferation,adhesion,and incorporation into vascular structures[J].Circulation,2002,106(22):2781-2786.
[14]Wang H S,Hung S C,Peng S T,et al.Mesenchymal stem cells in the wharon's jelly of the human umbilical cord[J].Stem Cells,2004,22(7):1330-1337.
