中西药术中及术后腹腔温热低渗化疗治疗胃癌58例分析
2013-11-08尤龙
尤 龙
泌阳县人民医院,河南泌阳 463700
·经验交流·
中西药术中及术后腹腔温热低渗化疗治疗胃癌58例分析
尤 龙
泌阳县人民医院,河南泌阳 463700
进展期胃癌(advanced gastric carcinoma,AGC)术后5年生存率低,预后差,其主要原因是术后肿瘤复发和肝转移,这是由于腹腔内游离癌细胞(dissociation cancer cell,DCC)和残余微小癌灶形成亚临床种植及经门静脉系统导致肝转移[1]。腹腔温热低渗灌注化疗(intraperitoneal hyperthermic chemoperfusion,IHCP)杀灭腹腔DCC比静脉化疗具有明显药代动力学优势,且对患者细胞免疫功能抑制较轻,在临床上广泛应用[2]。本文旨在探讨术中及术后早期应用中西药联合IHCP的临床疗效。本院于2000年1月―2012年6月对58例T3、T4期胃癌患者进行术中、术后早期中西药联合IHCP,5年随访效果良好,现报告如下。
1 资料与方法
1.1 一般资料
选择2000年1月―2012年6月均经病理与临床确诊在本院住院的AGC患者116例,其中男86例,女30例;年龄39~70岁,平均年龄54.5岁;T3期83例,T4期33例。将患者随机分为观察组和对照组各58例。观察组T3期41例,T4期17例;对照组T3期42例,T4期16例。两组患者在年龄、性别、临床分期、KPS评分、肝肾功能、白细胞及血小板计数等一般资料比较差异均无统计学意义(Pgt;0.05),具有可比性。
1.2 入选及排除标准
入选标准:①术后病理证实为胃腺癌;②KPS评分≥60分;③术前未行放、化疗;④无心、肺、肝肾功能损害;⑤年龄lt;70岁;⑥均为T3期和T4期。排除标准:①既往有腹部手术史;②术中原发癌灶无法切除;③肝或肺等脏器有转移;④术中吻合不满意。
1.3 治疗方法
观察组:手术毕向腹腔注入43 ℃~45 ℃无菌双蒸水2 000 ml,使液体温度维持在43 ℃左右,15 min后吸尽全部蒸馏水,再注入43 ℃ 5-氟脲嘧啶(5-FU)1.0 g,丝裂霉素(MMC) 10 mg,蒸馏水溶液2 000 ml,最后将茵栀黄和黄芪注射液分别溶于生理盐水250 ml注入腹腔,15 min后关腹,留置900 ml灌注液于腹腔,最后分别于剑突下和膀胱直肠陷凹(Dauglas窦)留置中心静脉导管,夹管以待术后IHCP用。术后第4天自剑突处中心静脉导管用同样方法(先预热腹腔,再灌注温热化疗液)每日快速灌注1次,注药后夹管,嘱患者反复变换体位,以利于药物腹腔均匀分布,6~8 h后自Dauglas窦处中心静脉导管放出全部液体,1次/d,连续5 d ,5次为1个疗程,每次化疗结束后拔管,每个疗程间隔21 d,一般治疗4~6个疗程。
对照组:术中用蒸馏水冲洗腹腔后关腹,术后4 d应用5-FU 1.0 g 加生理盐水1 000 ml静脉点滴,6~8 h滴完,连续5 d,MMC 10 mg 加生理盐水40 ml静脉推注,第1天。
1.4 疗效评价标准
每次化疗结束后休息3周,复查血常规和肝、肾功能,观察两组毒副作用,进行生活质量评价,并随访1、3、5年腹腔内肿瘤复发和肝转移率以及1、3、5年生存率。毒副作用按WHO抗癌药物毒性反应标准评判,分为0~4度。生活质量按Karnofsky体力状况计分标准计分,比治疗前评分增加gt;10分者为提高,减少gt;10分者为降低,变化不超过10分者为稳定。
1.5 统计学处理
采用SPSS 17.0统计软件分析数据,等级资料采用Ridit分析,率的比较用χ2检验,以Plt;0.05为差异有统计学意义。
2 结果
2.1 两组毒副反应
观察组患者的白细胞计数下降、胃肠道反应、腹痛、肝功能异常、肾功能异常的发生率均明显低于对照组,两组比较差异有统计学意义(Plt;0.05)。见表1。
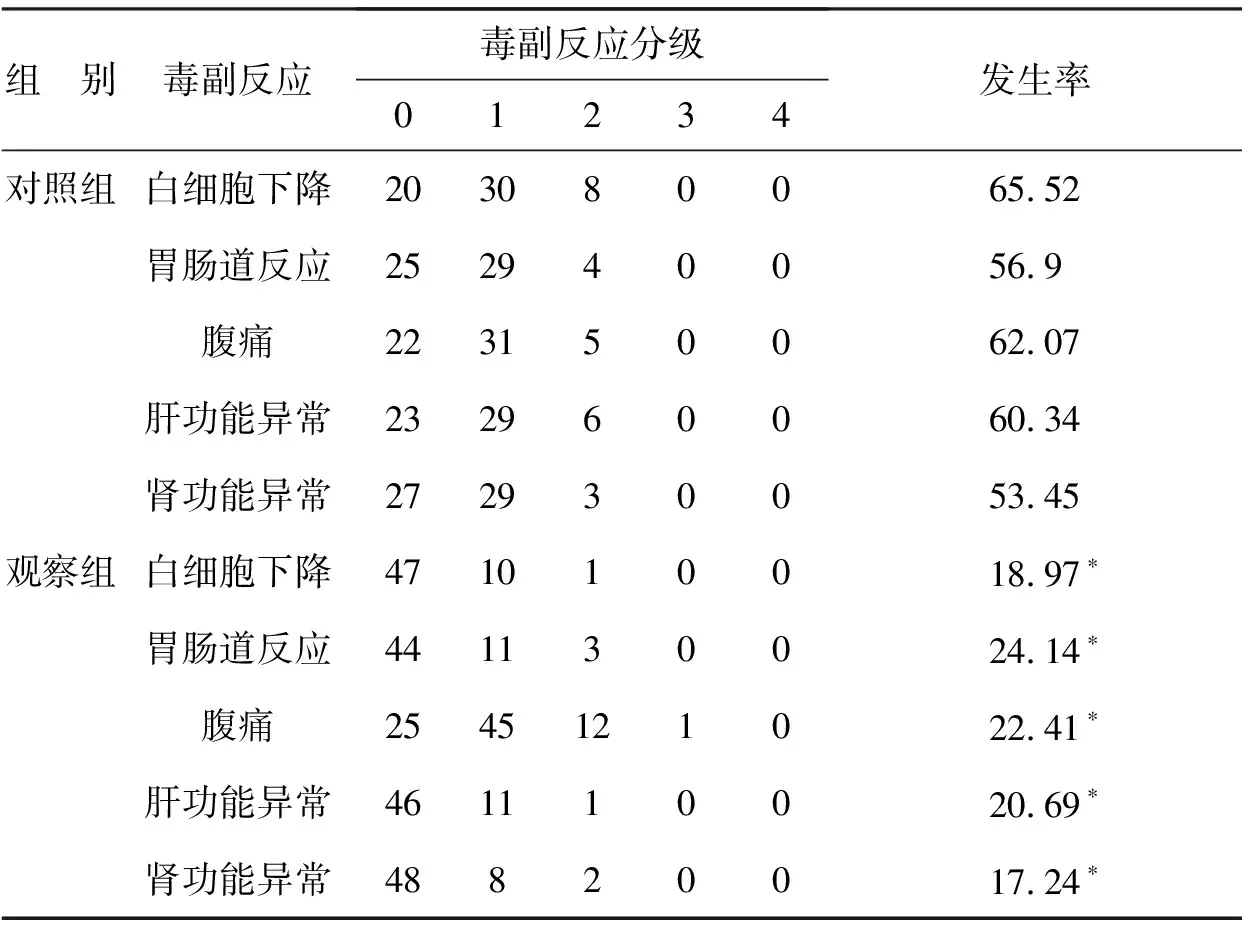
表1 两组毒副反应比较(n=58,例,%)
与对照组比较*Plt;0.05
2.2 两组Karnofsky评分
治疗结束后,观察组Karnofsky评分提高43例,稳定14例,降低1例;对照组Karnofsky评分提高27例,稳定26例,降低5例。观察组生活质量改善程度明显优于对照组(Plt;0.05)。见表2。

表2 两组Karnofsky评分比较(n=58,例,%)
与对照组比较*Plt;0.05
2.3 两组1、3、5年腹腔内肿瘤复发率、肝转移率及生存率
观察组1、3、5年腹腔内肿瘤复发率、肝转移率均明显低于对照组,生存率1、3、5年均高于对照组,两组比较差异有统计学意义(Plt;0.05)。见表3。

表3 两组腹腔内肿瘤复发率、肝转移率及生存率比较(n=58,例,%)
与对照组比较*Plt;0.05
3 讨论
胃癌根治术应包括充分地胃切除,彻底地胃周淋巴结清除,完全地消灭腹腔内DCC,此三点中任何一点不完善均会导致治疗失败。胃癌术后的主要致死原因是腹腔内转移和肝转移,其中腹腔转移致死者占40%~50%[3]。Kodera等[4]报道,胃癌术后腹腔游离癌细胞阴性者5年生存率为51.5%,阳性者仅为18.7%。临床检测腹腔DCC(+)患者如不予特殊处理,绝大多数手术后3年内发生腹膜转移。究其原因系原发癌浸透浆膜或转移淋巴结浸透被膜,癌细胞脱落、黏附、种植于腹膜,侵入间质,增殖导致腹腔内复发转移。虽然腹腔内DCC不一定均形成种植,但腹腔是DCC生存的良好环境。已知晚期胃癌组织和大量DCC均能分泌释放大量CEA。CEA是癌细胞黏附、着床的有利条件。尤其手术所致损伤出血,血液流入腹腔,血液中的白细胞、血小板、血浆均可促进癌细胞与腹膜黏附。可见消除腹腔内游离癌细胞和残存微小癌灶对改善胃癌患者预后有重要意义[5]。术中温热低渗液腹腔灌注可杀灭DCC。动物体内药代动力学研究证实腹腔给药后腹腔液和门静脉内的药物浓度明显高于体循环中浓度并且局部药物浓度恒定,维持时间长,使腹腔内病灶处于高浓度的药液中,能更有效、更直接杀灭腹腔内癌细胞;同时体循环内药物浓度相对较低,减轻5-FU及MMC的全身毒副反应。腹腔内药物经门静脉系统吸收后在门静脉和肝脏内形成较高的药物浓度,有利于防治肝转移癌。热疗(43 ℃~45 ℃)可广泛阻止癌细胞的周期增殖,甚至直接杀灭癌细胞;又由于热可导致药物分子布郎氏运动增强,癌细胞膜通透性增高,进入癌细胞内的药物增多,其杀伤效应更加显著。温热联合化疗药物对杀伤肿瘤具有协同作用,可降低化疗药物剂量,温热效应还可促进肿瘤组织对药物摄取。低渗液可使癌细胞肿胀、破碎和溶解,低渗环境促进化疗药物与癌细胞结合,有利于化疗药物进入癌细胞内增强其杀伤作用[6]。T3、T4期胃癌根治术后腹腔残留和种植癌细胞的机会较多,而且由于术后早期体内肿瘤负荷最小,肿瘤细胞增殖速度较快,临床上见到不少患者术后较早出现局部复发或转移。有报告胃癌切除术后如未辅以其他有效治疗,腹膜复发率达90%,肝转移达30%。术后早期腹腔内粘连尚未形成,有利于药物均匀分布,最大面积地作用于腹腔,发挥最广泛的杀伤效应;而灌注、引流的机械作用,也促进了腹腔内不良成分的排出,对减少术后并发症、降低癌症复发率有一定意义。合理的灌注时间安排,既保证了早期及时化疗的效果,也减少了可能因早期化疗所导致的吻合口愈合不良的风险。基于这样一个现实,本文设计于术中及术后尽早进行腹腔温热化疗,旨在维持腹腔内及肝内(经门静脉吸收入肝)较高的化学药物浓度,及时杀灭残留和种植的癌细胞,从而有效地减少或延缓术后腹腔内复发和肝转移[7]。术后早期IHCP可因三者协同作用,将残留DCC杀死或降低DCC在腹腔内种植,减少腹腔内肿瘤复发和肝转移[2]。
尽管近来新的抗癌药不断出现,但化疗的毒副反应,晚期患者很难耐受。化疗药物最主要的毒副反应是血液毒性及肾毒性,如何有效地减轻化疗的毒性已经成为有效实施化疗,减少化疗风险和改善患者生活质量的关键。笔者近几年来采用中药制剂茵栀黄注射液及黄芪注射液联合腹腔灌注收到满意效果。茵栀黄注射液由黄芩、茵陈、栀子提取物制成,有清热解毒,燥湿利湿,利水消肿,抑菌杀菌,降低谷丙转氨酶,保护肝功能及退黄等作用[8-9]。黄芪注射液为中药黄芪提取物制成,具有益气养元、扶正祛邪、通脉养心、健脾利湿作用。二药合用于腹腔内灌注能抗感染、抗渗出、利水消肿、缓解粘连等,降低化疗药物的毒性,减低毒副反应,为化疗药物发挥抗肿瘤作用打下基础,提高患者生存质量,但不降低其抗肿瘤的活性。
现代医学研究发现,黄芪的有效成分黄芪多糖能有效促进胸腺和脾脏的生长,加强损伤的修复,增强网状内皮系统的吞噬功能,促进T淋巴细胞的转化,增强NK细胞的细胞毒活性,提高机体免疫功能,抑制肿瘤生长。刘晓等[10]研究证明,黄芪能保护和改善骨髓造血微环境,改善骨髓基质细胞,与造血干细胞的接触,促进粒细胞集落刺激因子等内源性细胞因子的分泌,促进造血干细胞的增殖分化,减轻血液系的毒性反应。黄芪可促进血细胞的生成,发育和成熟,使红细胞和白细胞低下状态恢复到正常水平,使网织红细胞和巨核细胞的低下状况恢复正常。唐锦程等[11]也认为黄芪注射液能减轻鼻咽癌患者放疗的毒副作用,保护骨髓,预防白细胞下降。吴炎等[12]和胡利发等[13]证明黄芪注射液对肝、肾功能有很好的保护作用。
从本组资料中可以看出,观察组化疗的毒副作用明显低于对照组,KPS评分及生活质量明显高于对照组;3年及5年腹腔内肿瘤复发和肝转移率明显降低;3年及5年生存率明显提高。中药茵栀黄注射液、黄芪注射液联合化疗药物腹腔内灌注,能显著改善患者临床症状及全身情况,保护骨髓造血功能,肝肾功能,减轻化疗药物对骨髓功能损伤程度,提高病人的免疫功能,减轻粘连等引起的疼痛,从而改善了肿瘤患者对化疗的耐受性,有利于化疗顺利进行。总之,5-FU、MMC、茵栀黄注射液及黄芪注射液联合术中及术后腹腔温热低渗灌注化疗起到了减毒增效作用,值得临床推广应用。
[1]韩少良,姚建高,张陪趁,等.胃癌术中腹腔冲洗液Cox-2 mRNA及CEA mRNA检测临床意义的探讨[J].中华肿瘤防治杂志,2008,15(8):607-609.
[2]邓海军,魏志刚,甄莉,等.胃癌围手术期腹腔热灌注化疗的临床应用[J].南方医科大学学报,2009,29(2):295-297.
[3]高丽珍,高峨嵋,白云飞,等.胃肠肿瘤根治术后腹腔热灌注化疗结合高频热疗序贯静脉化疗与单纯静脉化疗的对比研究[J].肿瘤,2012,32(1):65-69.
[4]KODERA Y,NAKANKSHI H,ITO S,et al.Prognostic significance of intraperitoneal cancer cells in gastric carcinoma:detection of cytokeratin 20 mRNA in peritoneal washes,in addition to detection of carcinoembryonic antigen[J].Gastric Cancer,2005,8(3):142-148.
[5]郑朝旭,袁兴华,孙跃民,等.腹腔冲洗细胞学检查对胃癌预后的价值[J].中华普通外科杂志,2005,20(7):414-416.
[6]张桂英,陈小春,潘凯,等.术中腹腔内温热灌注化疗在胃癌治疗中的应用[J].中华胃肠外科杂志,2007,10(4):362-364.
[7]曲秋莲,张英鸽,杨留中,等.纳米活性炭吸附丝裂霉素C腹腔化疗的实验研究[J].中华肿瘤杂志,2006,28(4):257-260.
[8]杜延琪,张帆,龚文菲,等.茵栀黄注射液的药理作用及不良反应研究分析[J].中药材,2009,32(4):641-643.
[9]陈辉扬,陈军,温平康.茵栀黄注射液的药理作用与临床应用评价[J].药品评价,2005,2(2):122-124.
[10]刘晓,武正炎,范萍.黄芪在外周血造血干细胞移植中应用的初步实验研究[J].镇江医学院学报,2001,11(1):15-17.
[11]唐锦程,欧可富.黄芪注射液对鼻咽癌患者放疗期间白细胞的影响[J].实用医学杂志,2007,23(2):280-281.
[12]吴炎,田怡,陈建文.黄芪注射液对肝硬化患者肝功能的影响[J].中国中西医结合杂志,1999,19(6):363-364.
[13]胡利发,俞天麟,贾正平.黄芪及丹参对防治甘油致家兔急性肾功能衰竭的实验研究[J].中华外科杂志,1996,34(5):311-314.
10.3969/j.issn.1674-4616.2013.01.007
2012-11-12)
