水处理剂高铁酸钾的制备及表征
2013-11-06陈林萍长江大学化学与环境工程学院湖北荆州434023
陈林萍 (长江大学化学与环境工程学院,湖北 荆州 434023)
彭友新 (宁波润泽畜牧环保科技有限公司,浙江 宁波 315100)
陈 武,梅 平 (长江大学化学与环境工程学院,湖北 荆州 434023)
水处理剂高铁酸钾的制备及表征
陈林萍 (长江大学化学与环境工程学院,湖北 荆州 434023)
彭友新 (宁波润泽畜牧环保科技有限公司,浙江 宁波 315100)
陈 武,梅 平 (长江大学化学与环境工程学院,湖北 荆州 434023)
利用次氯酸盐氧化法制备了高铁酸钾(K2FeO4),研究了硝酸铁的质量分数、氧化反应温度、氧化反应时间、重结晶温度以及重结晶时间等因素对制备K2FeO4产品的纯度或产率的影响。综合考虑纯度和产率,确定制备K2FeO4的适宜条件为:采用一步法,以Fe(NO3)3·9H2O作为铁源,投料质量百分比为20%,NaClO的质量浓度为270g/L,合成Na2FeO4的时间为1.5h,合成温度20℃,合成K2FeO4的适宜时间15min,合成温度20℃,洗涤温度-5℃,干燥温度60℃。对合成的固态K2FeO4样品进行了纯度、产率的分析,并对合成产品进行了结构表征。红外分析结果表明,所合成产物具有K2FeO4特征吸收峰;SEM图表明,合成的K2FeO4产品晶体与β-K2FeO4型正交晶系的晶胞一致。XRD测试结果表明,合成的K2FeO4产品晶胞参数与标准衍射卡的晶胞参数基本一致。因此,合成产品就是目标产物K2FeO4,且纯度高达98%以上。
K2FeO4;次氯酸盐氧化法;制备;结构表征
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、助凝、杀菌、除臭为一体的非氯新型高效多功能绿色水处理剂[1],它弥补了传统水处理剂对水体形成二次污染的不足[2]。具有良好的氧化除污功效,可以有效去除难降解有机污染物及氰化物等无机污染物,如它能迅速有效地氧化分解生物污泥中产生的硫化氢、甲硫醇、氨等恶臭物质[3],还具有良好的絮凝和助凝效果[4]。此外,高铁酸钾比次氯酸盐的杀菌能力强,是一种理想的氯源杀菌剂的替代品。目前K2FeO4的合成方法有次氯酸盐法、电解法、过氧化物高温氧化法等[5],由于高铁酸钾在制备,储存和应用过程中还存在制备方法复杂、操作条件严苛、产品稳定性较差等问题,以至现在高铁酸钾产品没有得到规模化生产和应用。为此,笔者选取次氯酸盐法开展高铁酸钾制备工作。
1 试验部分
1.1药品与仪器
1)药品 高锰酸钾、浓盐酸、浓硫酸、磷酸、氢氧化钠、氢氧化钾、九水合硝酸铁、磷酸钠、硅酸钠、氯化铜、高碘酸三钠、甲苯、甲醇、无水乙醚、亚铬酸铜、硫酸亚铁铵、二苯胺磺酸钠。
2)仪器 真空干燥箱、定时恒温磁力搅拌器、电热鼓风干燥箱、玻璃砂芯漏斗、电磁恒温水浴锅、离心机、旋片式真空泵。
1.2合成原理
次氯酸盐氧化法又称为湿法[5-6],该法是以次氯酸盐和铁盐为原料,在碱性溶液中反应,生成高铁酸钠,然后加入氢氧化钾,将其转化成高铁酸钾。利用高铁酸钠与高铁酸钾在氢氧化钠浓溶液中的溶解度差异,从混合液中分离出高铁酸钾晶体。经过滤分离、洗涤纯化、干燥得到固体的K2FeO4产品。次氯酸钾法是用次氯酸钾作为氧化剂直接氧化得到K2FeO4,再经分离、洗涤纯化、干燥得到产品。反应原理如下:
2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O
或:
Fe(NO3)3+3NaClO+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O
(1)
Na2FeO4+ 2KOH=K2FeO4+2NaOH
(2)
制备时按式(1)、式(2)的比例关系算出原料理论重量比。
1.3合成工艺
1)制备NaClO碱性溶液 试验中发现,用购买的分析纯NaClO制备高铁酸钾(有效氯浓度约为125g/L),制得成品产率很低,甚至无法于砂芯漏斗上取得成品。因此,该研究首先采用KMnO4与浓HCl作用,将产生的氯气通入盛有浓H2SO4的洗气瓶,再通入氢氧化钠溶液中自制得到亮黄色的NaClO碱性溶液。
2)合成Na2FeO4在20~30℃恒温、搅拌下,向自制NaClO碱性溶液中分批加入研细的铁盐,加完后反应0.5~1.0h,得紫黑色浆状物,并加入少量硅酸钠作稳定剂,即得到Na2FeO4。
3)除盐 在上述紫黑色浆状物中分批加入固体NaOH至饱和,用冰水浴冷却至温度不超过20℃,继续搅拌一定时间,Na2FeO4因溶解度降低而析出。用砂芯漏斗抽滤,弃去紫色滤液,用一定浓度NaOH溶液分多次冲洗滤饼,滤液即为较纯净的Na2FeO4溶液。
4)合成K2FeO4在Na2FeO4溶液中加入一定量饱和KOH溶液,保持一定温度20~30℃,搅拌至K2FeO4大量析出。用砂芯漏斗抽滤,得紫黑色K2FeO4滤饼(粗产品),滤液为 Na2FeO4溶液,可循环使用。
5)后处理 将上述得到的K2FeO4粗产品用一定浓度的 KOH溶液溶解、抽滤,将滤液转移至冰水冷却的饱和KOH溶液中,进一步冷却-5℃,并搅拌15min至晶体析出,用G3玻璃砂芯漏斗抽滤即得K2FeO4滤饼,再用一定量甲苯分3次洗涤滤饼、除水;然后用一定量甲醇分4次洗涤滤饼、除杂质;再用一定量无水乙醚分2次洗涤、脱甲醇,加速干燥;最后将产品于一定温度真空干燥,使水分、有机物挥发,保证K2FeO4的稳定性。
1.4分析方法
1)产品纯度分析 产品纯度分析方法有分光光度法[7]和氧化还原滴定法[8],笔者选择用亚铬酸盐氧化还原滴定法分析纯度[8]。
2)产品产率计算 高铁酸钾产率计算公式如下:
高铁酸钾产率=(合成的高铁产品质量×纯度/理论产量)×100%。
2 结果与讨论
2.1铁源对高铁酸钾纯度、产率的影响
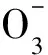
2.2铁盐添加量对高铁酸钾纯度、产率的影响
按照上述合成工艺条件,研究Fe(NO3)3·9H2O的添加量对K2FeO4产品的纯度和产率的影响。经过一次重结晶后产品纯度和产率随硝酸铁盐添加量的变化情况如图1所示。从图1可以看出,随着Fe(NO3)3·9H2O添加量的增加,产品产率略有提高,但纯度却大幅度下降。这是由于Fe (Ⅲ)对高铁酸根具有很强的催化还原作用,它的存在将显著降低产品的稳定性。
2.3NaClO浓度对高铁酸钾纯度、产率的影响
NaClO浓度的多少直接影响K2FeO4的产率,不同浓度的NaClO(有效氯)与高铁酸钾产率的关系如图2所示。从图2可知,当NaClO的质量浓度为270g/L时,高铁酸钾的产率最高,达到45.5%。因此,该试验采用自制NaClO,现制现用制备K2FeO4。

图1 硝酸铁的质量分数对产品纯度、产率的影响 图2 NaClO(有效氯)浓度对产率的影响
2.4合成Na2FeO4投料顺序对高铁酸钾纯度、产率的影响
为了探讨投料顺序对合成K2FeO4的影响,分别采取一步法、二步法[9]来进行制备。结果表明,一步法制备K2FeO4的产率及纯度分别为45.5%、98.3%,二步法制备K2FeO4的产率及纯度分别为50.2%、98.6%,由于二步法操作更繁琐,而产率、纯度较一步法提高不是太多。因此,以下试验采用一步法。
2.5合成Na2FeO4反应温度、时间对高铁酸钾纯度、产率的影响
合成Na2FeO4时温度高,可加快反应速率,提高生产效率;但同时也加速了Na2FeO4水解,降低产物的产率,反应时间为1.5h时,不同温度对产率的影响如图3所示;同样合成时间短,反应不完全,产物产率低,时间长,产物要水解,同样导致产率低。反应温度为20℃,不同反应时间对产率的影响如图4所示。从图3、图4可以看出,合成Na2FeO4的适宜时间为1.5h,合成温度20℃。

图3 反应温度对产率的影响 图4 反应时间对产率的影响
2.6合成K2FeO4反应温度、时间对高铁酸钾纯度、产率的影响
由于合成K2FeO4的反应是非氧化还原反应,反应无明显放热,所以此反应温度、时间的控制不如合成Na2FeO4时严格。反应时间为15min时,温度对K2FeO4产率的影响如图5所示;反应温度为20℃时,时间对K2FeO4产率的影响如图6所示。从图5、图6可以看出,合成K2FeO4的适宜时间15min,合成温度20℃。
2.7后处理条件对高铁酸钾纯度、产率的影响
1)有机物洗涤温度的选择 同批次K2FeO4样品在不同洗涤温度下所得结果如表1所示。从表1可以看出,产物呈红色,即完全被还原成Fe(Ⅲ);产物呈紫红色,即部分被还原为Fe (Ⅲ);产物颜色为紫黑色,表明K2FeO4较纯,所以有机物洗涤应在-5℃下进行。
2)真空干燥温度的选择 为了研究干燥温度对K2FeO4纯度的影响,将同批次K2FeO4样品在不同干燥温度下干燥,并测产品纯度,所得结果如表2所示。从表2可以看出,80℃干燥时,产物呈红色,即完全被还原成Fe(Ⅲ);25℃干燥时,产物呈紫红色,即部分被还原为Fe (Ⅲ);60℃干燥时,产物颜色为紫黑色,表明K2FeO4较纯。其原因可能是25℃时,温度较低,干燥速度慢,K2FeO4固体表面残留部分溶液,导致其分解;80℃时,产品中残留有未除净的溶剂(甲苯、甲醇、乙醚、水),同时,80℃的温度可能导致K2FeO4分解,使其分解为铁钾化合物和氧气。所以最佳干燥温度为60℃。

图5 反应温度对产率的影响 图6 反应时间对产率的影响

表1 不同洗涤温度所得产品特性

表2 不同干燥温度所得产品特性
2.8产品分析与结构表征

图7 合成高铁酸钾的FIRT图谱

图8 高铁酸钾的SEM照片(1300×)

图9 高铁酸钾的XRD图谱
1)红外光谱 (FIRT)分析 将上述条件下得到的K2FeO4样品送往武汉大学测试中心,采用NICOLET 5700 FT-IR显微红外光谱仪(美国)测试,结果如图7所示。
由图7解析可知,在807.8cm-1处有强吸收峰,617.1cm-1处有肩峰,与文献[10-11]报道一致,表明合成产物具备K2FeO4产品特征。
2)扫描电镜(SEM)分析 将在最佳条件下得到的K2FeO4样品送往武汉大学测试中心,采用Quanta 200型扫描电镜(荷兰)进行测试,结果如图8所示。由图8可以看出,K2FeO4晶体的形态饱满,外形为柱状,晶粒两端有明显的锥形生长面,这与其属β-K2FeO4型正交晶系的晶胞一致,且晶体在C轴方向上有一个V型生长面。图8与文献[12]的SEM图具有一致性,进一步表明产品是高铁酸钾。
3)X射线衍射(XRD)分析 选取最佳条件下得到的大小为0.8mm×1mm×0.6mm的K2FeO4样品送往武汉大学测试中心,采用D/max-2550PC型XRD仪(日本)进行晶体结构测定,结果如图9所示。
由图9对照高铁酸钾的标准谱图(JCPDS No.25-652)及标准衍射卡,其各特征衍射峰的峰位均相互一致无杂质峰,属于正交晶系结构。根据Scherrer公式[13]计算高铁酸钾晶胞参数分别为a=7.7064A;b=5.8644A;c=10.3654A;与标准衍射卡的晶胞参数a=7.705A;b=5.863A;c=10.360A相比,基本一致。并与文献[13]XRD图谱一致,说明合成产品是目标产物高铁酸钾,其纯度达98%以上。
3 结 论
(1)高铁酸钾适宜的合成条件:以Fe(NO3)3·9H2O作为铁源,投料质量百分比为20%,采用一步法进行制备,NaClO的质量浓度为270g/L,合成时间为1.5h,合成温度20℃,洗涤温度-5℃,干燥温度60℃。
(2)对合成产品做了纯度和产率的分析及产品结构表征。红外分析结果表明,所合成产物具有K2FeO4特征吸收峰;SEM图表明,合成的K2FeO4产品晶体与属β-K2FeO4型正交晶系的晶胞一致。XRD测试结果表明,合成的K2FeO4产品晶胞参数与标准衍射卡的晶胞参数基本一致,且纯度高达98%以上。
[1]姜洪泉,金世洲,王鹏.多功能水处理剂高铁酸钾的制备与应用[J].工业水处理,2001,21(2):2-6.
[2]罗志勇,李和平,郑泽根.高铁酸钾的合成及其在水处理中的应用[J].重庆建筑大学学报,2002,24(6):39-42.
[3]Luca D S J,Idle C N,Chao A C.Quality improvement of biosolids by ferrate(Ⅵ) oxidation of offensive odour compounds[J].Wat Sci Tech,1996,33(3):119-130.
[4]Luca DS J,Cantelli M,Luca D M A.Ferrate vs traditional coagulants in the treatment of combined industrial wastes[J].Wat Sci Tech,1992,26(9~11): 2077-2080.
[5]陈武,彭友新. 高铁酸钾的制备及应用研究进展[J]. 无机盐工业,2009,41(5):9-11.
[6]李元昊,丁忠浩. 新型水处理剂高铁酸钾的制备及应用研究[J]. 绿色科技,2011(11):105-107.
[7]雷钢铁,苏光耀,李朝辉.高铁酸钾的合成及性能研究[J].精细化工中间体, 2002,32(3):28-30.
[8]姜洪泉,刘红.亚铬酸盐滴定法测定高铁酸钾[J].佳木斯大学学报(自然科学版),2001,19(1):106-108.
[9]冉亮.绿色水处理剂高铁酸钾的合成技术研究[D].合肥:合肥工业大学,2007.
[10]黄莉莉.高铁酸盐对水中微量有机物的去除作用[J].当代化工,2004,33(4):231-233.
[11]Jiang J Q, Lloyd B. Progress in the Development and Use of Ferrate(VI) Salts as an Oxidant and Coagulant for Water and Wastewater Treatment[J].Water Res,2002,36(32):1397-1408.
[12]董娟,汪永辉,吴小倩.高铁酸钾水处理剂的制备及稳定性研究[J].环境科学与管理,2006,31(8):136-140.
[13]Li C, Li X Z,Graham N.A Study of the preparation and reactivity of potassium ferrate[J].Chemosphere,2005,6(4):537-543.
[编辑] 洪云飞
TQ085.412
A
1673-1409(2013)25-0027-05
2013-06-19
国家科技重大专项(2011ZX05024-004-11);长江大学基础学科科学研究发展基金支持计划项目。
陈林萍(1989-),女,硕士生,现主要从事水处理剂方面的研究工作。
陈武(1967-),男,博士,教授,现主要从事油气田环境保护方面的教学与研究工作;E-mail:ccww91@126.com。
