白背三七愈伤组织诱导及培养条件优化
2013-11-06郭紫娟上官新晨尹忠平
郭紫娟,上官新晨,蒋 艳,尹忠平
(江西农业大学 食品科学与工程学院/江西省高校天然产物研究与开发重点实验室,江西 南昌 330045)
白背三七[Gynura divaricata(L.)dc.]为菊科菊三七属植物,又名白子菜、白背菜,分布于中国南部、西南部和台湾[1]。白背三七植株主要含有黄酮、三萜、甾醇及核苷类等化学成分,根、茎和叶均可入药,具有清热解毒、舒筋接骨、凉血止血、散瘀消肿、降血糖降血压之功效[2-5]。民间素有将白背三七地上部分作为食药两用之品,广泛用于治疗“三高”病等,具有较高的开发价值。然而,白背三七野生资源破坏十分严重,植株结实性差,种子数量少,传统扦插繁殖方法有限,无法进行大规模商业化生产,不能满足市场的需求[6]。
利用植物细胞培养生产药用成分是近年来发展起来的新领域,已成为开发药用植物资源的重要途径[7]。植物细胞生产次级代谢产物具有提高产率、缩短周期、提高产品质量、不占用耕地、不受地理环境和气候影响等显著特点[8]。目前,白背三七组织培养的研究多集中在快繁方面,如黄余磊等[6]、黄丽莉等[9]建立了成本低廉、周期短的快速繁殖体系。而关于建立白背三七细胞培养体系并生产次级代谢产物的研究鲜有报道,本文拟研究白背三七愈伤组织诱导及继代培养的最佳培养基及激素组合,为开发利用植物细胞培养生产白背三七天然活性成分奠定理论基础。
1 材料与方法
1.1 试验材料
白背三七叶:采自江西农业大学科技园。
1.2 外植体消毒
采集3—7月初的白背三七带芽嫩叶、茎段,用流水冲洗2 h,于超净工作台作消毒处理[6,9]:20 g/L洗衣粉水溶液漂洗5 min,自来水冲洗30 min,体积分数75%乙醇浸泡表面20 s,1 g/L升汞溶液消毒5 min,20 g/L次氯酸钠溶液消毒10 min,无菌水冲洗4~6次,然后将外植体切成含1~2个芽的小段接种于诱导培养基上。
1.3 愈伤组织的诱导
将白背三七带芽嫩叶、茎段接种于诱导培养基上[6,9](MS 培养基 +1.0 mg/L KT+0.5 mg/L 2,4 -D+0.3 mg/L NAA+1.0 mg/L 6-BA+30 g/L 的蔗糖 +6 g/L琼脂,pH 值6.0),在相对湿度40% ~60%、(25±2)℃下暗培养数日,每隔2 d观察1次并记录。
1.4 继代培养基的初步筛选
将初代萌发的愈伤组织转为光培养(每天光照14 h,光照强度1 000~1 500 lx),培养基及其他培养条件同1.3,每15 d转接一次。至第6代后,将愈伤组织接种于MS、B5、N6、WPM、White及DKW 6种培养基上,均附加1.0 mg/L KT+0.5 mg/L 2,4 -D+0.3 mg/L NAA+1.0 mg/L 6 - BA,以细胞净生长量及生长状态(颜色、质地、生长快慢、稳定性)为指标,挑选状态较一致的培养物用于筛选适合愈伤组织稳定生长的继代培养基[9],18 d后收集。
1.5 激素组合对愈伤组织生长效果的影响
在 MS 基础培养基中研究激素(KT、2,4 -D、NAA、6 -BA),质量浓度0,0.3,0.5,1 mg/L 对愈伤组织生长的影响;在B5基础培养基中研究激素KT与2,4-D组合,6-BA与NAA组合分别在质量浓度0.5~10 mg/L对愈伤组织生长的影响。

表1 MS培养基中L16(45)正交试验因素水平Tab.1 Level and factor of L16(45)orthogonal experiments in MS culture
1.6 愈伤组织生长曲线的绘制
以B5+0.5 mg/L NAA+2.0 mg/L 6-BA为继代培养基,研究白背三七愈伤组织生长过程中生物量及生长状态的变化,绘制白背三七愈伤组织生长曲线,确定愈伤组织继代、收获的最佳时期。
1.7 愈伤组织生长量的测定[10]
生长量以鲜质量计,每瓶接种1.0 g鲜质量。

数据统计分析采用DPS软件(vb5.55专业版),对数据进行邓肯氏分析,以上试验每个处理5次平行,2次重复,结果取其平均值。

图1 白背三七愈伤组织生长状态Fig.1 The growth shape of Gynura divaricata(L.)DC.callus
2 结果与分析
2.1 愈伤组织的诱导
分别取3—7月白背三七带芽嫩叶、茎段接种于MS培养基 +1.0 mg/L KT+0.5 mg/L 2,4-D+0.3 mg/L NAA+1.0 mg/L 6-BA中暗培养数日。15 d后接种的带芽嫩叶明显增厚,体积膨大,切口周围先形成白须状组织,逐渐转绿、变黄,如图1a;而茎段则逐步褐化,无愈伤组织出现。在第16~20天生长较迅速,出现暗黄色、绿色等致密的愈伤组织,如图1b,而后逐渐褐化、变老。在第22天于相同培养基中进行首次继代,随着继代次数增加,愈伤组织呈现疏松的生长状态,培养周期也缩短,继代4~5次后缩短至18 d,如图1c—图1d。
对3—7月初的白背三七带芽嫩叶进行诱导发现,愈伤组织诱导的最佳时期为3月份,5月份好于4月份,6月份之后基本不能诱导出愈伤组织。由于南方3月上旬至4月中旬的梅雨影响,4月份所诱导的愈伤组织在继代培养的过程中易“夭折”即出现褐化、染菌、死亡等现象,不易增殖成活。
2.2 基础培养基对愈伤组织生长效果的影响
试验结果表明,白背三七愈伤组织在不同基础培养基上的生长情况具有极显著差异;总体而言,以在MS、B5培养基中生长的较好。MS为高盐成分培养基,其中硝酸盐、铵盐、钾盐含量较高,微量元素种类齐全,养分均衡,在组织培养中应用最广;B5含较高的盐酸硫胺素适合双子叶植物[8]。初代愈伤组织在MS培养基上增殖较快,呈现绿色、疏松颗粒状态,生物增长量达13.28 g/瓶;在B5培养基上,呈现黄色、疏松颗粒状态,生物量最高可达15.68 g/瓶;在WPM培养基上达13.63 g/瓶,但愈伤组织呈深绿、水渍状,转接数代后即易褐化、死亡。综上所述:初代愈伤组织在MS和B5两种基础培养基上有较好的培养效果。

表2 基础培养基对愈伤组织生物量积累及生长状态的影响Tab.2 The influence of basic medium in the callus biomass accumulation and growth shape
2.3 激素组合对愈伤组织生长效果的影响
2.3.1 MS培养基中激素组合对愈伤组织生长效果的影响 白背三七愈伤组织可在2、5、9、13、14号试验的激素水平下获得较高的生物量(表3)。而从生长状态来看:愈伤组织在含有激素2,4-D的2、14号试验下呈现致密、深黄、水渍状等不良的现象,不利于继代培养;在不含有激素2,4-D的5、9、13号试验下呈现黄白、疏松有光泽的良好状态;另在其他含有2,4-D激素的培养基中愈伤组织生物量积累也不高,生长状态不良。由此推断,细胞生长素2,4-D可能对继代培养的细胞产生一定的毒害作用,明显抑制白背三七愈伤组织增殖。有研究报道[11],用成熟种子诱导胚性愈伤时,需较高浓度2,4-D;但单双子叶植物在诱导分化后必须及时降低或去掉2,4-D胚性细胞才能正常生长。进一步验证试验表明白背三七愈伤组织能够在13号条件即MS+1.0 mg/L KT+1.0 mg/L NAA+0.3 mg/L 6-BA培养基中更稳定的生长,愈伤组织呈现白绿带黄、疏松有光泽的状态(图1c)。
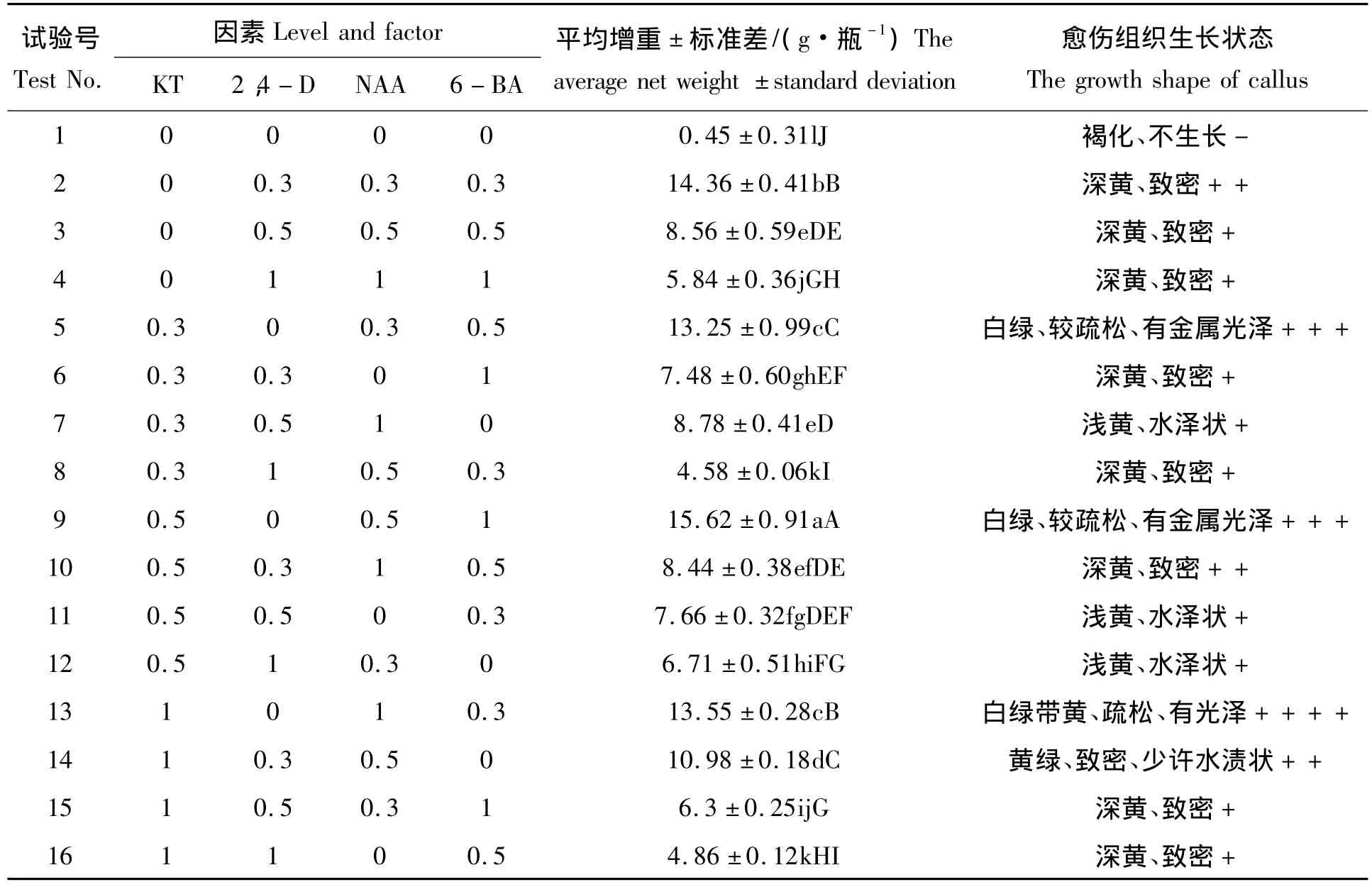
表3 MS培养基中白背三七愈伤组织生长试验结果Tab.3 The growth experiment results of Gynura divaricata(L.)DC.callus in MS culture
2.3.2 B5培养基中激素组合对愈伤组织生长效果的影响 笔者对细胞分裂素KT与生长素2,4-D进行试验,发现愈伤组织呈致密、水渍状,生长状态不良。这一现象与在含有2,4-D激素的MS培养基上相似,也说明白背三七愈伤组织在继代培养中应该脱除细胞生长素2,4-D。表4为6-BA与NAA激素组合试验筛选的部分结果。

表4 B5培养基中白背三七愈伤组织生长试验结果Tab.4 The growth experiment results of plant hormones types and concentration in Gynura divaricata(L.)DC.callus
当两激素总质量浓度为3 mg/L时,6-BA与NAA质量浓度之比[12]在0.5~4皆能够较好的积累白背三七愈伤组织。当NAA为0.5 mg/L时,不断扩大6-BA至10 mg/L,愈伤组织皆能积累到较高的生物量,说明白背三七愈伤组织能够适应较高的6-BA质量浓度。在B5基础培养基中,适合愈伤组织增殖的激素组合为(0.5~2)mg/L NAA和(3~1)mg/L 6-BA。进一步验证试验表明白背三七愈伤组织能够在B5+0.5 mg/L NAA+2.0 mg/L 6-BA 培养基中更稳定的生长,愈伤组织呈现黄白、疏松有光泽的状态(图1d)。

图2 白背三七愈伤组织在B5培养基上生长曲线Fig.2 The growth curve of Gynura divaricata(L.)DC.callus in B5 culture
2.3.3 愈伤组织在2种继代培养基上的生长比较 愈伤组织在 MS附加1.0 mg/L KT、1.0 mg/L NAA、0.3 mg/L 6-BA的培养基上继代30次后,逐渐变致密、老化、死亡,呈现“反愈伤化”生长现象,如图1b中绿色致密状。这一现象在植物组织培养中较易出现,愈伤组织长期继代培养会引起细胞内染色体的变异,出现多倍体、非正倍体、染色体丢失、断裂或重组,导致遗传不稳定[8]。但将这种绿色致密型愈伤组织转接至B5+0.5 mg/L NAA+2.0 mg/L 6-BA培养基培养数代后,愈伤组织逐渐呈现疏松易碎、有金属光泽、生长旺盛的状态,说明更能适应白背三七愈伤组织长期稳定生长的培养基为B5+0.5 mg/L NAA+2.0 mg/L 6 -BA。
2.4 白背三七愈伤组织在B5培养基上的生长曲线
由图2可知,愈伤组织在B5继代培养基上呈平缓的“S”型生长曲线,在生长过程中经历以下4个时期:延迟期、指数期、静止期和衰退期。愈伤组织经过2~4 d短暂适应后便逐步生长,第6天开始进入快速生长的指数期,第18天生物量达到最大值19.54 g/瓶,第22天后愈伤组织开始衰老,此时褐化较快。白背三七愈伤组织最佳继代时间为第16~18天,最佳的收获时期为第18~20天。
3 讨论
白背三七是草本植物,含有较多的酚酸类物质,致使该植物在组织培养过程中易褐变,受到污染甚至死亡的概率较高。外植体消毒过程中,体积分数75%的乙醇浸泡时间不能超过1 min,否则材料易被褐化、死亡;升汞溶液、次氯酸钠溶液的浓度在消毒范围内应尽量低,以免材料被杀死;多次用无菌水冲洗,防止消毒液残留毒害材料。
白背三七愈伤组织诱导培养研究表明,带芽嫩叶(3月份采摘)接种MS+1.0 mg/L KT+0.5 mg/L 2,4-D+0.3 mg/L NAA+1.0 mg/L 6-BA培养基上15 d即能诱导出愈伤组织;而黄余磊等[6]通过在MS+0.5 mg/L BAP+0.1 mg/L NAA培养基上诱导白背三七草叶片、叶柄、茎段,接种55 d才产生愈伤组织。这可能是添加的植物外源激素种类与含量不同所致。因为植物的生长与分化不仅取决于外源激素的添加量,而且细胞分裂素与生长素的比例也起着至关重要的作用。外源激素可通过影响内源激素的合成和代谢而最终影响内源生长素和细胞分裂素的水平[13]。
在白背三七愈伤组织继代培养研究发现,无论是在MS还是B5培养基中,细胞生长素2,4-D对愈伤组织的生长具有明显的抑制作用,具体的抑制机制有待进一步研究。在B5+0.5 mg/L NAA+2.0 mg/L 6-BA培养基中可获得疏松易碎、有金属光泽、生长旺盛的愈伤组织,第18天生物量达到最大值19.54 g/瓶,其中含有的有效活性成分也有待进一步分析检测。
[1]《中国植物志》编辑委员会.中国植物志:第77卷.[M].北京:科学出版社,1988.
[2]黄开珍,郝永靖,曾春晖,等.白子菜水提物对自发性高血压大鼠降血压作用的实验研究[J].中成药,2009,31(10):1505-1508.
[3]马正东,陈 磊,宋洪涛,等.白背三七水提取物对2型糖尿病大鼠的降血糖作用及其机制[J].中草药,2010,4(41):623-626.
[4]胡勇,李维林,林厚文,等.白背三七地上部分降血糖作用研究[J].西南林学院学报,2007,1(27):55-58.
[5]姜曼花,胡剑卓,邱文高,等.白背三七多糖和黄酮降血糖及耐缺氧作用[J].中国医院药学杂志,2009,13(29):1074-1076.
[6]黄余磊,蒋 明,金含丽,等.白背三七草组培快繁技术研究[J].浙江农业科学,2011(1):49-52.
[7]王姝,赵玉桥,罗国坤,等.组织培养技术在药用植物中的应用研究进展[J].江苏农业科学,2010,38(12):26-29.
[8]郭勇,崔堂兵,谢秀祯.植物细胞培养技术与应用[M].北京:化学工业出版社,2004:1-1,95-96,24-25.
[9]黄丽莉,艾 叶,刘峰,等.白子菜的组织培养与快速繁殖[J].植物生理学通讯,2010,46(4):377-378.
[10]秦卫东,高明侠,吕兆启,等.银杏愈伤组织培养及其黄酮生物合成的初步探讨[J].食品科学,2002,23(1):38-41.
[11]Bai Y,Qu R.Factors influencing tissue culture responses of mature seeds and immature embryos in turf-type tall fescue[J].Plant Breeding,2001,120:239 -242.
[12]Chan L K,Lim S Y,Pan L P.Micropropagation of Gynura Procumbens(Lour.)Merr.an important medicinal plant[J].Journal of medicinal Plants Research,2009,3(3):105 -111.
[13]曹孜仪,刘国民.实用植物组织培养技术教程[M].兰州:甘肃科学技术出版社,1996:98-102.
